高分子脲醛緩釋肥料降解菌的篩選及降解酶性質初探
王 芳 胡培毅 向 陽 郄浩然 仝迎芳 劉子超郭仕偉 郭建峰 劉亞青*
(1.中北大學 化學工程與技術學院,太原 030051; 2.納米功能復合材料山西省重點實驗室,太原 030051; 3.山西省高分子復合材料工程技術研究中心,太原 030051)
脲醛(UF)肥料是高分子聚合材料的1種,由不同長度鏈的聚合物組成。全球每年有30多萬t脲醛用做樹脂、粘合劑、絕緣材料和用于綠色植物、草坪或生物修復過程的控釋氮肥。脲醛肥料是最早的緩釋肥料,可在自然環境中逐步降解,緩慢釋放所含氮肥。脲醛肥料中氮等肥料的精準受控釋放是肥效增高的關鍵,溫度、水分、pH等理化因素都會影響其降解過程以及肥效。
其他高分子聚合材料,如聚乙烯(PE)、聚苯乙烯(PS)的生物降解是環境保護研究的熱點。已有研究表明黃粉蟲的幼蟲(Tenebrio
molitor
Linnaeus
)可以降解PE等塑料材料,其腸道中特定微生物以及微生物分泌的降解酶是降解塑料的主要酶。土壤中富含多種微生物,理論上,土壤中可能存在一些微生物,會影響高分子脲醛緩釋肥料(PSRF)的降解過程。有研究表明脲醛緩釋肥與土壤中微生物具有復雜的相互作用:一方面土壤中的微生物參與降解脲醛肥料,提高氮源的釋放速度;另一方面緩釋復合肥對土壤中微生物有促進作用,可以提高土壤微生物種類和含量,減弱對微生物生存環境的脅迫。Ikeda等研究發現洋蔥和甜菜中細菌多樣性的近30%的差異是由于施肥條件造成的,而且2種植物的群落結構在脲醛肥料作用下單向移動。微生物降解高分子聚合材料的難易程度主要取決于聚合物分子的大小和結構、微生物的種類以及微生物的生活環境條件。對聚合物而言,一般可被微生物降解的化學結構順序為:脂肪族酯鍵、肽鍵>氨基甲酸酯>脂肪族醚鍵>亞甲基。此外,相對分子質量大、分子結構排列規整、疏水性大的聚合物,不利于微生物的生長和作用,也就不利于生物降解。高分子聚合材料的結構依據分子在空間排列的規整性可分為結晶型、部分結晶型和無定型(非晶態)三類;高分子材料中除了晶態結構外還有無定型(非晶態)結構。與無定型區域相比,高分子材料的晶體結構區域結構更致密更難降解;與因光、熱等物理因素部分降解的片段相比,不溶性高分子聚合材料從頭降解更難降解。脲醛高分子材料在光、熱、水分等因素作用下可以先將大分子降解為小分子片段,降解后的中小分子片段比較容易被微生物利用。Jahns等篩選出了能夠生物降解脲醛高分子緩釋肥經部分降解后的小分子中間物,如亞甲基脲、二甲基三脲、異丁烯二脲和丁烯二脲。菌種Ralstonia
paucula
能夠產生降解亞甲基脲的MDUase;菌種Burkholderia
sp.能夠產生降解MDU(亞甲基脲)、DMTU(二甲基三脲)的MDUase;菌種Rhodococcus
erythropolis
能夠產生降解IDU(異丁烯二脲)的IDUase;菌種Rhodococcus
sp.能夠產生降解CDU(丁烯二脲)的CDUase.以上微生物能夠利用脲醛小分子中間代謝物作為生長所需的唯一氮源。但是,目前對于不能熱解的、水不溶性的脲醛大分子肥料尚無生物降解的相關報道,而對不易自然降解的大分子進行從頭降解微生物及相關酶是更徹底的、源頭性生物降解,對生物降解的研究更有意義。已有研究篩選得到亞甲基脲等中間代謝物的降解菌及降解酶,然而脲醛高分子肥料的微生物降解過程尚未進行研究。因此,本研究擬以含磷和鉀元素的脲醛高分子緩釋肥料(PSRF)為研究對象(圖1),利用SEM、激光粒度分布、乙酰丙酮分光光度法和鉬酸銨分光光度法,研究高分子脲醛緩釋肥料中不易熱解的、不溶性高分子團聚顆粒部分的生物降解過程,以期為脲醛緩釋肥的生物從頭降解途徑提供及應用參考。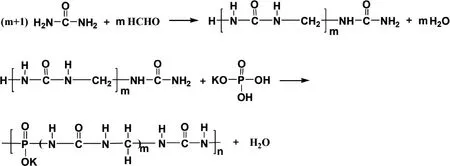
圖1 高分子脲醛緩釋肥料(PSRF)的合成途徑[21]Fig.1 Synthesis of polymer urea-formaldehyde slow-release fertilizer (PSRF)[21]
1 材料與方法
1.1 試驗材料
1
.1
.1
菌株和PSRF肥料樣品本研究中使用的菌株P.
rubens
23229 分離自中北大學連續2年施用PSRF肥料(每年施肥1次,每次種植時施用11.84 g肥料)的盆栽(長120 cm×寬40 cm×深28 cm)土壤(土壤深度為20 cm)樣品,現為本實驗室保存菌株。所使用的含氮磷鉀生物降解高分子脲醛緩釋肥料(PSRF肥料)由山西省高分子復合材料工程技術研究中心提供。1
.1
.2
培養基和主要試劑無機鹽母液的配制:FeCl·4HO 1.8 g,CoCl·6HO 0.25 g,NiCl·6HO 0.01 g,CuCl·2HO 0.01 g,MnCl·4HO 0.70 g,ZnCl0.1 g,HBO0.5 g,NaMoO·2HO 0.03 g, NaSeO·5HO 0.01 g,蒸餾水1 L。配制好后放于冰箱4 ℃保存,使用時取1 mL定容到1 L作為無機鹽溶液使用。
復合維生素母液的配制:生物素0.1 g,煙酸0.35 g,鹽酸硫胺素0.3 g,對氨基苯甲酸0.2 g,鹽酸吡多胺0.1 g,泛酸鈣0.1 g,維生素B0.05 g,蒸餾水1 L。配制好后放于冰箱4 ℃保存,使用時取7.5 mL定容到1 L作為復合維生素溶液使用。
篩選培養基:PSRF 10 g、無機鹽溶液1 mL、復合維生素溶液7.5 mL、蒸餾水1 000 mL。
察氏培養基(Czapek):硝酸鈉3 g、磷酸氫二鉀1 g、MgSO·7HO 0.5 g、KCl 0.5 g、硫酸亞鐵0.01 g、蔗糖30 g、蒸餾水1 000 mL。
磷酸緩沖液的配制(0.2 mol/L pH 7.0):A液(NaHPO·HO 3.161 g),B液(NaHPO·HO 2.760 g),分別溶于蒸餾水,定容至100 mL;A液與B液按61∶39體積比混合。
戊二醛溶液(2.5%):取25%戊二醛水溶液10 mL和磷酸鹽緩沖液(0.2 mol/L pH 7.0) 50 mL,用蒸餾水定容至100 mL。
1.2 試驗方法
1
.2
.1
PSRF降解菌富集篩選土壤采集:采集施用過高分子緩釋肥料PSRF的土壤,用取樣鏟將表層土壤3 cm左右的浮土除去,采取深度5~10 cm處的土壤,裝入預先滅菌的采樣袋中,混合均勻。稱取5 g土壤,溶解于1 000 mL蒸餾水中,接入含有肥料PSRF的液體篩選培養基中(篩選過程中設置了3個重復),置于28 ℃恒溫智能生化培養箱中培養10 d。將對PSRF富集的菌液按10~10倍梯度稀釋后,分別涂布于篩選平板上,28 ℃倒置培養4~5 d。挑選PSRF降解菌株,在篩選平板上多次劃線直至得到純菌落。
1
.2
.2
降解微生物菌落形態特征觀察肉眼觀察降解菌在固體篩選培養基(PSRF)上的菌落形狀、顏色、透明度、隆起和邊緣特征等。挑取菌種于載玻片上,用光學顯微鏡(SK 160,麥克奧迪實業集團有限公司,中國)進行進一步觀察。
1
.2
.3
ITS 基因序列鑒定和系統發育分析采用omega HP真菌DNA提取試劑盒(E.Z.N.A.TM High Performance (HP) Fungal DNA Kit)法提取菌體總DNA。利用ITS1/ITS4(真菌)引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTT ATTGATATGC-3′擴增所篩菌株的序列,將所獲得的擴增片段利用 DNAMAN 軟件進行拼接,使用Contig Express拼接測序結果,并去除兩端不準的部分。測序結果與 NCBI 數據庫進行比對,利用MEGA-X軟件進行多序列比對分析并構建系統發育樹。
1
.2
.4
抗熱解PSRF(rPSRF)肥料的制備稱取100 g PSRF于500 mL三角瓶中,加入200 mL去離子水,置于25 ℃下水浴攪拌30 min,使用中速濾紙進行過濾;棄去濾液,將剩余的PSRF用2 L去離子水洗2次,加入500 mL去離子水重懸,于75 ℃水浴攪拌30 min,使用中速濾紙進行過濾;棄去濾液,將剩余的PSRF用2 L去離子水洗2次,加入500 mL去離子水重懸,于100 ℃水浴攪拌30 min,使用0.45 μm的濾膜進行抽濾,用100 mL去離子水水洗2次;最后將過濾器上的PSRF在40 ℃干燥箱中烘干,備用。
1
.2
.5
無菌發酵液的制備分別在察氏培養基(Czapek)和PSRF篩選培養基中接種產紅青霉,28 ℃ 100 r/min震蕩培養10 d,取發酵液在轉速4 000 r/min,4 ℃的條件下,離心10 min,棄去沉淀,將上清液過0.45 μm的混合濾膜,得到無菌的Czapek發酵液以及PSRF發酵液。
1
.2
.6
微生物及酶從頭降解性能研究以熱處理過的抗熱解高分子肥料(rPSRF)為唯一碳源和氮源,分別接種產紅青霉或無菌發酵液于30 ℃共培養7 d,rPSRF肥料降解分組見表1:
表1 本研究rPSRF肥料降解分組
Table 1 Anti-pyrolytic PSRF fertilizers used in this study
組別Group處理方式Processing mode空白對照 CK20 g rPSRF肥料+200 mL無菌水產紅青霉組 Penicillium rubens group20 g rPSRF肥料+200 mL無菌水+微量元素0.2 mL、維生素1.5 mL+產紅青霉菌種2 mLCzapek發酵液 Czapek fermented liquid group20 g rPSRF肥料+200 mL Czapek無菌發酵液PSRF發酵液 PSRF fermented liquid group20 g rPSRF肥料+200 mL PSRF無菌發酵液
以上樣品每24 h取一次樣,檢測pH、甲醛、磷含量以及電導率。連續監測7 d。甲醛含量的檢測采用乙酰丙酮分光光度法。磷含量檢測采用鉬酸銨分光光度法。電導率用電導率儀(DDSJ-308F,上海儀電科學儀器股份有限公司,中國)測定。
1
.2
.7
降解顆粒粒度分布檢測產紅青霉菌對抗熱解肥料降解15 d后,將液體搖勻后取樣15 mL,使用激光粒度分布儀(Bettersize2600,丹東百特儀器有限公司,中國)對粒度分布進行檢測。
另外取5 mL樣品以0.22 μm的水相濾膜過濾,使用Zeta電位及激光粒度分析儀(Zeta Plus,布魯克海文儀器公司,美國)進行納米粒度分布檢測。
1
.2
.8
抗熱解肥料降解的顯微觀察產紅青霉菌組樣品共培養15 d后,挑取殘余PSRF肥料于載玻片上,使用熒光顯微鏡(Axio Vert A 1,卡爾蔡司公司,德國)進行觀察。同時將另一部分肥料置于1.5 mL離心管內,加入2.5%的戊二醛溶液(固定液加滿離心管,使樣品完全浸沒在固定液中),放置于4 ℃保存,等待SEM使用前的預處理。
SEM樣品預處理:倒掉固定液,用0.1 mol/L,pH 7.0的磷酸緩沖液漂洗樣品3次,每次15 min;用1%的鋨酸溶液固定樣品1~2 h;小心取出鋨酸廢液,用0.1 mol/L,pH 7.0的磷酸緩沖液漂洗樣品3次,每次15 min;用梯度濃度(包括30%,50%,70%,80%,90%和95%五種濃度)的乙醇溶液對樣品進行脫水處理,每種濃度處理15 min,再用100%的乙醇處理2次,每次20 min。用乙醇與醋酸異戊酯的混合液(V
(乙醇)∶V
(醋酸異戊酯)=1∶1)處理樣品30 min,再用純醋酸異戊酯處理樣品1 h或放置過夜。臨界點干燥。鍍膜,觀察。處理好的樣品以生物電鏡(Nova Nano 450,FEI公司,美國)觀察。1.3 統計分析
本研究數據的統計分析(匯總統計、相關性、方差分析和t
檢驗)在Origin 2019 b中進行。2 結果與分析
2.1 PSRF肥料降解菌的篩選及分離
在選擇性培養基上篩選具有潛在降解PSRF功能的菌株的結果見圖2(a)。可知:菌落圓形,菌落面平坦,中心呈深綠色,邊緣白色,質地絨狀或兼輕微絮狀。光學電子顯微鏡下觀察到菌絲和分生孢子(圖2(b)),分生孢子面綠色;菌絲體白色,無滲出液,反面初期為黃綠色或淡黃色;有帚狀枝,分生孢子鏈狀。從形態上觀察與青霉屬菌種相似。

圖2 PSRF培養基上生長菌落的形態(a)和菌體在光學顯微鏡下圖像(b) (400×)Fig.2 Colony morphology on PSRF media (a) and image of under light microscope (b) (400×)
2.2 菌株鑒定及系統發育樹構建
利用NCBI-BLAST對降解菌的ITS rRNA基因進行同源性分析發現,分離得到的菌種與Penicillium
rubens
CBS 129667(序列號NR_111815.1)相似度最高,去除首尾多余序列后同源性達 100.00%。采用Geneious和MEGA軟件構建篩選菌株的系統發育樹如圖3所示。因此,結合該降解菌菌落形態、菌體大小和生理生化等特征,確定該菌種為P.
rubens。菌株送至中國微生物菌種保藏管理委員會普通微生物中心進行專利菌種保藏,保藏號CGMCC 23229。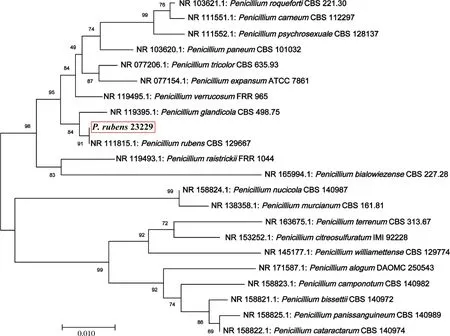
紅框區域是本研究篩選到的菌株P. rubens 23229;圖標中0.010表示代表每1 000個核苷酸/氨基酸中有10個不同。The red box area is the strain P. rubens 23229 identified in this study. The value 0.010 below the scalebar represents 10 different nucleotides/amino acids per 1 000 nucleotides/amino acids.圖3 PSRF降解菌株基于ITS rRNA基因序列的系統發育樹Fig.3 Phylogenetic tree of PSRF degradeted microorganisms based on ITS rRNA gene sequence
2.3 P. rubens 23229對PSRF抗熱解部分降解的形態觀察
P.
rubens
23229對PSRF抗熱解部分降解的形態觀察結果見圖4。圖4(a)為PSRF抗熱解肥料的空白組在熒光顯微鏡下的觀察結果,可以看出肥料平整。P.
rubens
23229與抗熱解肥料培養基在室溫下共培養10~20 d后,三角瓶中出現白色團狀菌絲;挑取部分團狀菌絲,在熒光顯微鏡下觀察(圖4(b))。與無菌的空白組(圖4(a))中只有均勻分布的肥料相比,圖4(d)中可以觀察到肥料上有菌絲纏繞。用生物掃描電鏡進一步觀察與P.
rubens
23229共培養組中rPSRF肥料的碎塊和P.
rubens
23229互相交錯(圖4(c)),圖4(c)中的1和2分別代表rPSRF肥料降解產生的碎塊和P.
rubens
23229的菌絲,圖4(d)中的3、4分別代表圖4(c)中紅色圓圈放大后的P.
rubens
23229的菌絲和rPSRF肥料降解產生的小碎屑。以上顯微觀察結果表明,P.
rubens
23229能在水不溶性的抗熱解脲醛高分子肥料rPSRF上附著生長,并通過生物降解將其從致密的大塊結構分解為小塊甚至更小的碎屑。
(a)PSRF在熒光顯微鏡下放大100倍的圖(CK);(b)P. rubens 23229對rPSRF降解在熒光顯微鏡下放大100倍的圖;(c)和(d)P. rubens 23229對rPSRF降解在生物掃描電鏡下的圖,放大倍數分別為500和10 000倍。(d)和(c)紅圈區域的放大圖。1和4表示PSRF被P. rubens 23229降解后產生的碎塊;2和3表示P. rubens 23229生長產生的菌絲。(a) The 100 fold magnification of PSRF under fluorescence microscope(CK). (b) A 100 fold magnification of the degradation of rPSRF by P. rubens 23229 under fluorescence microscope. (c) and (d) The images of P. rubens 23229 degrading rPSRF under biological scanning electron microscope, with magnification of 500 and 10 000 times, respectively. (d) The enlarged image of the area outlined in red in (c). 1 and 4 represent fragments generated by degradation of PSRF by P. rubens 23229. 2 and 3 are P. rubens 23229 mycelia.圖4 P. rubens 23229 對rPSRF部分降解的形態觀察Fig.4 Morphological observation of P. Rubens 23229 on the anti pyrolysis partial degradation of rPSRF
2.4 Penicillium rubens 23229對PSRF抗熱解部分降解粒度分布
用激光粒度儀檢測P.
rubens
23229對rPSRF部分降解的微米級顆粒大小分布結果見圖5(a)。可見未經處理的空白對照和經過產紅青霉處理的樣品,其顆粒直徑均集中在197.8 μm附近,但分散性有顯著差異。經過P.
rubens
23229處理的樣品在低于197.8 μm處的累積分布達到75.83%,對照組為67.31%,比對照提高了8.52%,說明P.
rubens
23229存在時小顆粒數增加;試驗組在大于567.4 μm處的累積分布為0.28%,對照組為2.18%,比對照降低了1.90%,說明P.
rubens
23229存在時肥料大顆粒數目減少。圖5(a)微米級顆粒大小分布結果表明P.
rubens
23229加強了抗熱解肥料PSRF分解為小顆粒的程度。圖5(b)為加入產紅青霉菌前后抗熱解肥料上清液中小于0.22 μm的納米級顆粒大小分布圖。從圖中可以看出,與P.
rubens
23229共培養后,樣品粒度分布較空白對照朝中軸有一定的收縮趨勢,其有效直徑為693.7 nm,與對照(705.2 nm)相比降低了1.63%。圖5(b)納米級顆粒大小分布結果說明了P.
rubens
23229將rPSRF進一步降解為納米級顆粒。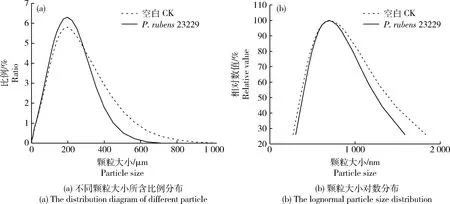
圖5 Penicillium rubens 23229對rPSRF肥料作用的不同顆粒大小的粒度分布Fig.5 Particle size distribution of Penicillium rubens 23229 on rPSRF fertilizer
2.5 P. rubens 23229 對rPSRF的降解產物分析
PSRF經熱處理后,剩余的部分為抗熱解肥料(rPSRF)。研究P.
rubens
23229 與rPSRF共培養期間,甲醛、磷含量以及電導率隨時間的變化趨勢,結果見圖6。從圖6(a)中可以看出,在rPSRF肥料中加入了產紅青霉后,溶液中磷的含量在24 h內顯著升高至0.791~19.228 μg/mL;2~7 d內磷的含量趨于穩定,溶液中的磷含量最高達21.520 μg/mL。相比較而言,空白對照組在0~7 d時間中磷含量變化區間為0.127~1.573 μg/mL。磷是PSRF高分子肥料的組成部分,游離磷含量的增加,說明肥料在降解過程中釋放了磷酸根。空白組經過熱處理,自然降解速率較低,磷含量較低,而有P.
rubens
23229存在時,顯著提高了肥料大分子的降解速度。磷酸根是菌種生長的重要物質,從第1天之后產紅青霉組磷含量雖有波動,但總體保持在18.187~21.520 μg/mL范圍內,這可能是磷酸根在肥料降解和菌種利用速度之間達到的一種動態平衡。甲醛是PSRF合成的單體之一,也是其降解的終端產物之一。從圖6(b)可以看出,空白對照組在試驗期內甲醛含量無顯著變化,含量均低于0.001 8 mg/mL。有P.
rubens
23229存在時,體系中甲醛含量從0.015 7 mg/mL迅速增加到0.134 0 mg/mL,并在隨后的5 d內持續增加,最高達到0.213 0 mg/mL,提高到初始甲醛含量的13.6倍,與對照相比差異顯著(P
<0.05)。與磷酸根一樣,甲醛也是微生物生長可利用的營養物質,尤其在無其他碳源存在的情況下,甲醛是重要的碳源,甲醛含量理論上是肥料降解和微生物利用之間的動態平衡結果。以上結果說明P.
rubens
23229可以降解rPSRF肥料并利用其作為營養素生長繁殖。在rPSRF中加入了產紅青霉后,電導率變化情況見圖6(c)。在第1天,電導率由123.3 μS/cm增加到220.0μS/cm,增加了96.7 μS/cm,是空白對照(CK)的電導率在1 d中增加量28.9 μS/cm(31.2~60.1 μS/cm)的3.35倍,差異顯著(P
<0.05)。試驗組2~6 d的變化趨勢比較平緩,可能是由于P.
rubens
23229的大量繁殖對溶液中離子消耗,6~7 d,試驗組的電導率又有了上升趨勢,菌種繁殖相對飽和對抗熱解肥料降解的離子小于消耗的離子,故電導率開始增加。試驗組的整體趨勢與磷含量變化比較一致,說明了磷酸根離子的對電導率的變化有一定的影響。對照組整體上趨勢比較平緩,說明了抗熱解肥料自身的緩慢降解,導致電導率的逐步增加。
圖6 Penicillium rubens 23229與rPSRF肥料共培養過程中磷含量(a)、甲醛含量(b)以及電導率(c)隨時間的變化趨勢Fig.6 Changes of phosphorus content (a), formaldehyde content (b) and electrical conductivity (c) of Penicillium rubens 23229 on rPSRF fertilizer
2.6 P. rubens 23229 無菌發酵液性質初步分析
利用鉬酸銨分光光度法檢測磷含量分析P.
rubens
23229無菌發酵液對rPSRF的降解能力,結果見圖7(a)。可知:與對照組磷含量(0.127~0.832 μg/mL)相比,加入以PSRF肥料培養P.
rubens
23229無菌發酵液后,rPSRF和P.
rubens
23229無菌發酵液混合體系中磷含量持續增加,最高達10 057.143 μg/mL,差異顯著(P
<0.05)。說明在無菌的發酵液中含有rPSRF降解酶,而且該酶為菌種產生的胞外酶。無菌發酵液中磷含量的最大值遠高于有菌存在時的量(21.520 μg/mL),證實了菌體在降解后對其中磷元素的利用。相反,察氏培養基培養P.
rubens
23229的無菌發酵液與rPSRF共培養后,系統中磷含量增加很少(最大值87.054 μg/mL)。究其原因可能是察氏培養基配方中本身含有的磷元素,在此過程幾乎沒有因為肥料降解而新增的磷。以上結果表明在不含PSRF的察氏培養基中無降解酶產生,也即降解酶的產生必須有PSRF的存在,受PSRF誘導產生。利用乙酰丙酮分光光度法檢測甲醛含量分析P.
rubens
23229無菌發酵液對rPSRF的降解能力,甲醛含量變化結果見圖7(b)。可見:以PSRF肥料培養P.
rubens
23229無菌發酵液中甲醛的含量隨著時間的變化整體呈上升趨勢,由0.169 0 mg/mL增加到最高值0.200 0 mg/mL;Czapek無菌發酵液中甲醛的含量由0.037 8 mg/mL增加到最高值0.139 0 mg/mL;空白對照中甲醛含量無顯著變化,均低于0.001 8 mg/mL。PSRF肥料無菌發酵液中,最初的甲醛含量比Czapek無菌發酵液的甲醛含量高,是由于發酵液中含有初期降解PSRF肥料產生的甲醛,而PSRF肥料無菌發酵液中的誘導酶要優于Czapek無菌發酵液。最終穩定后,PSRF肥料無菌發酵液中最高的甲醛含量0.200 0 mg/mL高于Czapek無菌發酵液中最高的甲醛含量0.139 0 mg/mL,說明不同發酵液中的酶種類含量不同,所能降解rPSRF的產生甲醛的結構有限,故降解穩定后,PSRF肥料無菌發酵液中的酶降解rPSRF生成甲醛的能力優于Czapek無菌發酵液。溶液電導率的變化趨勢見圖7(c)。Czapek無菌發酵液的電導率增加量為280 μS/cm,是空白對照(CK)的電導率在7天中增加量182 μS/cm的1.538倍;PSRF肥料無菌發酵液的電導率增加量為1 890 μS/cm,是空白對照(CK)的電導率增加量182 μS/cm的10.385倍,差異顯著(P
<0.05)。以上結果說明在有PSRF存在時其降解酶活性更強,受PSRF誘導產生。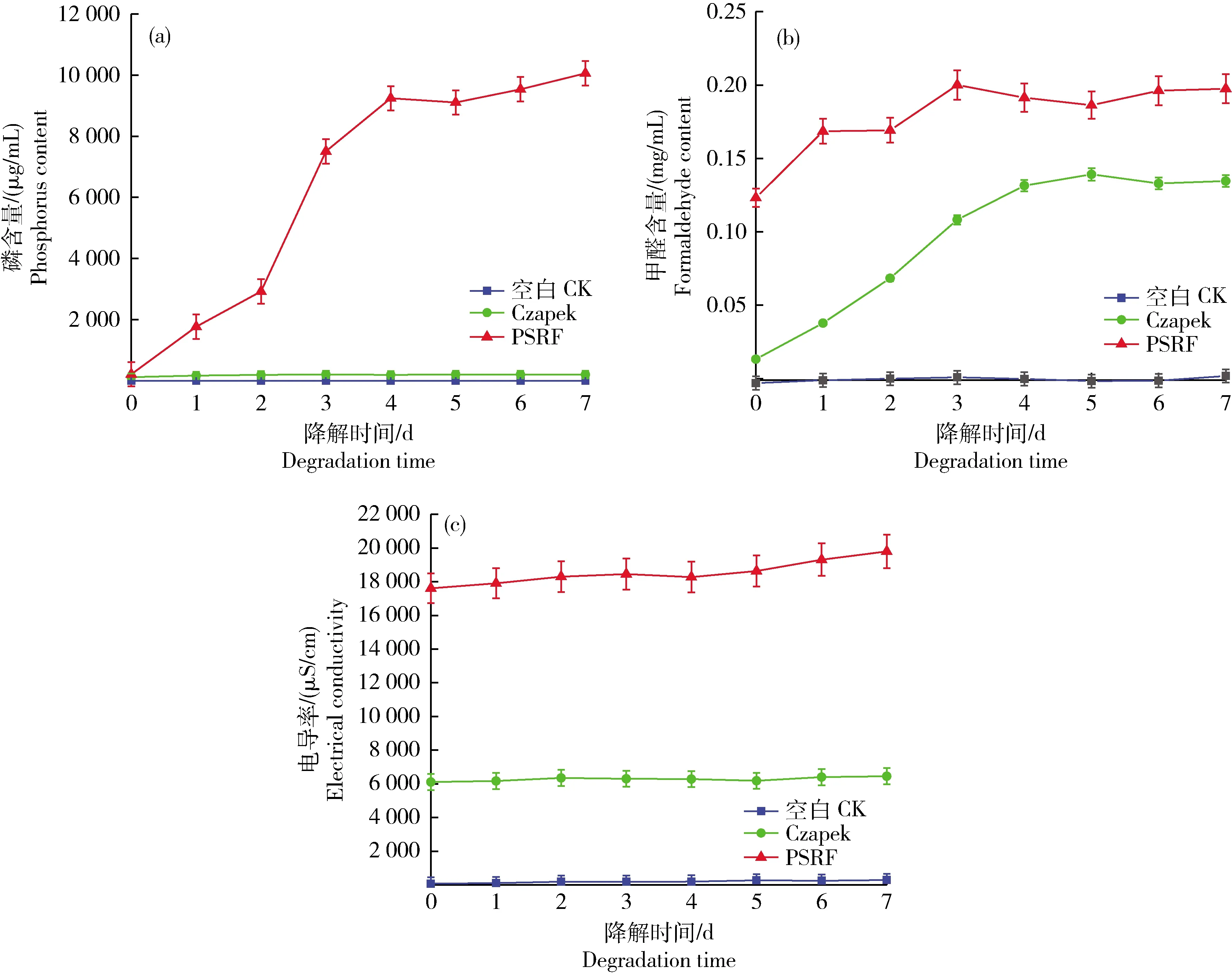
圖7 無菌發酵液對PSRF肥料作用的磷含量(a)、甲醛(b)以及電導率(c)的變化情況Fig.7 Changes of phosphorus content (a), formaldehyde contend (b) and the electrical conductivity (c) of sterile fermentation broth on PSRF fertilizer
3 討 論
本研究以高分子緩釋肥料PSRF為唯一碳源和氮源,從土壤中篩選出1株高分子脲醛降解菌,經鑒定為產紅青霉Penicillium
rubens
CGMCC 23229。產紅青霉菌廣泛存在于土壤、海藻、食品等樣品中,該菌以發霉的哈密瓜、未發酵的葡萄汁、啤酒瓶蓋殘留物質等作為營養來源。產紅青霉菌的次生代謝產物包括青霉素等,另外有些萜烯類、聚酮類、酰胺類化合物等次生代謝物還可刺激植物生長發育、制備西瓜霜等。高分子材料降解菌包括降解塑料的Marinomonas
、降解脲醛的低聚物亞甲基脲等的菌種Ralstonia
paucula
、Burkholderia
sp.和Rhodococcus
sp.等,主要為細菌,真菌報道不多。本研究首次篩選到的脲醛高分子降解菌產紅青霉為真菌,一方面豐富了高分子材料生物降解菌的種類;另一方面,在十幾份土壤樣本近百個篩選樣品中最終只篩選分離到產紅青霉,沒有篩選到他微生物尤其是已有報道的細菌降解菌,分析其原因如下:一方面可能是能夠以脲醛肥料為唯一碳源和氮源進行生長的微生物較少;另一方面也可能是產紅青霉在篩選培養基這種營養貧瘠的條件下生存時由PSRF誘導同時產生了青霉素等抗生素,抑制了土壤中原本可能降解代謝脲醛高分子肥料的其他微生物,包括某些細菌的生長繁殖。高分子聚合材料的降解受光、熱、酸等物理化學的影響,生物降解通常從無定型區開始,對結構緊密的結晶區較難發揮作用。脲醛高分子肥料中間代謝物如亞甲基脲、二甲基三脲、異丁烯二脲、丁烯二脲等,此類化合物分子量小、溶解性高,易為微生物利用,篩選到的降解菌也主要為細菌。對于結構緊密、分子量更大、溶解性小高分子聚合材料,微生物降解難度增大,尚未見報道。為了解決大分子降解的問題,有研究先使用酶解將高分子材料降解為微生物可以利用的聚合物單體,進而再進行微生物降解研究。本研究篩選得到的P.rubens
23229能夠對高分子抗熱解肥料(rPSRF)進行降解,并對其降解酶進行初步研究,試圖探究高分子脲醛緩釋肥料從高聚物到中間代謝物再到甲醛和尿素的生物降解的全過程。根據本研究結果推測脲醛在土壤中可能存在一條完整的生物降解鏈,即:1)由青霉菌等真菌產生降解酶對不溶性的大分子脲醛肥料進行第一步降解;2)產生小分子中間代謝物后,再由土壤中細菌類降解菌進一步降解。微生物是土壤生態的重要組成部分,對肥效及植物生長至關重要。闡明微生物對肥料的降解機制及影響因素對于緩釋效果及肥效有一定的理論意義與應用價值。4 結 論
以含氮磷鉀的高分子脲醛緩釋肥料(PSRF)為唯一碳源和氮源分離和篩選得到1株脲醛高分子肥料降解菌,經鑒定為Penicillium
rubens
CGMCC 23229;該菌可將結構緊密的抗熱解不溶性大顆粒PSRF降解為小分子碎片,釋放出含磷、甲醛等小分子化合物;該菌株產生的降解酶可分泌至發酵液中,且受PSRF誘導產生。
