電刺激迷走神經對血管壁c-kit+ 細胞遷移和分化的影響
石柳柳,許振,吳志意,趙金龍,雷佳琦,吳艷△
經皮冠狀動脈介入(PCI)是治療冠心病的有效手段之一,但術后再狹窄是影響其長期療效的重要因素,新生內膜形成是PCI術后再狹窄的主因[1]。近年有研究發現,在動脈血管壁外膜特別是中外膜交界處存在c-kit 陽性(c-kit+)細胞,當血管受到損傷刺激時,這些c-kit+細胞可向內皮下層遷移并合成大量細胞外基質,參與新生內膜形成[2-3]。因此,探索c-kit+細胞向新生內膜遷移的機制將有助于了解PCI術后再狹窄的機制及尋找新的靶點和治療策略。研究發現,通過刺激迷走神經減弱交感神經活性,可改變血管內皮功能紊亂,激活膽堿能抗炎系統,抑制動脈粥樣硬化等心血管疾病的發生、發展[4-5]。但是迷走神經在血管損傷后新生內膜形成中的作用還不明確,電刺激迷走神經能否通過調控血管壁c-kit+細胞的遷移而影響新生內膜的形成,值得探究。因此,本研究采用大鼠頸總動脈球囊損傷所致血管狹窄模型,觀察電刺激迷走神經對血管壁c-kit+細胞遷移到血管損傷處并參與新生內膜形成的作用及機制,為尋求血管狹窄及PCI術后再狹窄的新的治療靶點和治療策略提供依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 42只SPF級雄性SD大鼠購自湖北醫藥學院實驗動物中心,其中24只12周齡大鼠用于動物模型實驗,18只6~8周齡大鼠用于提取原代c-kit+細胞。大鼠由專人飼養,在溫度(23±2)℃、相對濕度(55±10)%、晝夜交替各12 h的受控條件下自由進食和飲水。所有動物實驗均按照實驗動物的飼養和護理的指南進行,經湖北醫藥學院機構動物護理和使用委員會審查并批準后,根據機構規定進行實驗。
1.1.2 實驗材料及試劑 乙酰膽堿(Ach)、DMEM/F-12培養基、胎牛血清購自美國Sigma-Aldrich;c-kit一抗、平滑肌22α(SM22α)蛋白一抗、α7 煙堿樣乙酰膽堿受體(α7nAChR)一抗、內參(GAPDH)一抗、辣根過氧化物酶標記的二抗、Alexa Fluor 488 偶聯二抗和Alexa Fluor 594 偶聯二抗均購自英國Abcam;c-kit+細胞篩選磁珠購自德國Miltenyi Biotec;α7nAChR拮抗劑購自美國Selleck;大鼠白細胞介素(IL)-6、腫瘤壞死因子(TNF)-α酶聯免疫吸附試驗(ELISA)檢測試劑盒購自中國欣博盛;異氟烷購自中國瑞沃德;戊巴比妥鈉購自美國Sigma-Aldrich。基礎培養基:100 mL 無酚紅的DMEM/F-12培養基含有胎牛血清10 mL、0.1 mmol/L β-巰基乙醇、100 U/mL青鏈霉素和2 mmol/L 谷氨酰胺。干細胞培養基:100 mL 基礎培養基中加入白血病抑制因子,其終濃度為10μg/L。血小板衍生因子-BB(PDGF-BB)誘導平滑肌細胞(SMC)分化培養基:在100 mL 基礎培養基中加入PDGF-BB,終濃度為20μg/L。細胞培養所用的T25培養瓶和24孔板等耗材購自美國Thermo 公司。熒光顯微鏡拍照系統(BX53+DP74)購自日本奧林巴斯(Olympus)。
1.2 實驗方法
1.2.1 動物分組 24只大鼠按隨機數字表法分為假手術組、模型組(左頸總動脈球囊損傷組)和迷走神經刺激組(左頸總動脈球囊損傷+左側迷走神經刺激組),每組8只。
1.2.2 大鼠左頸總動脈球囊損傷模型制備 模型組和迷走神經刺激組大鼠行異氟烷麻醉后,仰臥位固定。去除頸部被毛后,于胸骨上端至頜下皮膚做2~3 cm切口。經鈍性分離肌層后,游離出一段3~5 cm長的左頸總動脈,再沿左頸總動脈遠心端繼續鈍性分離,以暴露頸內動脈和頸外動脈分叉,在頸外動脈靠頭部的位置打結,近心端用動脈夾夾閉左頸總動脈。然后用血管剪在頸外動脈近心端上做一個垂直切口,用血管擴張器將動脈切口輕輕擴開,用鑷子輕輕夾住準備好的球囊桿部,將球囊插入動脈切口。取下動脈夾,無出血后繼續插入導管,直至導管標記位置(距離球囊端約4 cm)。打開三通開關,經導管向球囊內注入約0.02 mL的無菌生理鹽水,關閉三通開關,使球囊保持膨脹狀態。轉動導管的同時,將其慢慢拉出,至動脈切口位置,重復3次。最后,打結以封閉動脈切口,取下動脈夾,恢復血供,縫合筋膜和皮膚。假手術組大鼠經麻醉、頸部去毛、分離出左頸外動脈后,直接縫合筋膜和皮膚,不進行球囊損傷操作。
1.2.3 電刺激迷走神經 因左側迷走神經發出支配心臟的傳出纖維較少,且以支配房室結為主,刺激時對心率及血壓影響相對較小,故選擇刺激左側迷走神經。迷走神經刺激組在左側頸總動脈球囊損傷后72 h 開始刺激,刺激儀(北京眾實迪科技發展有限責任公司,型號:YLS-9A)參數設置如下:電流0.5 mA,電壓2 V,單向波,波寬0.3 ms,波間隙49.7 ms,頻率20 Hz,間斷時間270 s(即每5 min刺激30 s,休息270 s),持續4 h。模型組僅連接刺激儀,但不通電刺激。假手術組既不連接刺激儀,也不通電刺激。
1.2.4 HE染色及免疫組織化學染色 術后14 d,各組均取3只大鼠,麻醉,開胸暴露游離心臟,經左心室插入灌流針并固定,剪開右心耳,生理鹽水沖洗,再灌注4%多聚甲醛進行前固定,大鼠在此過程中死亡。之后取左頸總動脈損傷處血管,4%多聚甲醛固定,石蠟包埋,連續切片,選血管中段位置的切片,HE染色觀察血管內膜平均增厚情況,利用Image J軟件計算內膜厚度,通過免疫組織化學染色觀察c-kit+細胞在血管壁中的分布,利用Image-Pro plus軟件計算光密度值。
1.2.5 大鼠血清中炎性因子TNF-α和IL-6的含量測定 術后14 d,各組3 只大鼠心臟取血,全血4 ℃靜置30 min 后,1 000 r/min于4 ℃離心10 min,分離得到血清,通過ELISA檢測血清中TNF-α和IL-6含量。
1.2.6 血管壁c-kit+細胞的分離、純化及鑒定 利用外膜組織貼塊法獲取血管壁外膜細胞[6]。取另外18 只SD 大鼠,以2.5 mL/kg劑量腹腔注射2%戊巴比妥鈉麻醉大鼠。仰臥位固定后,打開胸腹腔,分離主動脈后迅速置于預冷的D-Hank’s液中。加入0.2%(約2 mL)Ⅱ型膠原酶浸泡血管,37 ℃恒溫搖床120 r/min消化15 min。擦除內皮細胞,用鐘表鑷小心仔細地剝離中膜,并舍棄。將剩余的血管外膜用眼科剪剪成約1 mm×1 mm×1 mm 大小的組織塊,將其均勻地平鋪至T25 培養瓶底部,將培養瓶翻轉倒置,置于37 ℃、5%CO2培養箱中。3 h后,輕輕將培養瓶翻轉,小心加入干細胞培養基3 mL覆蓋組織塊,正置于培養箱繼續培養。培養72 h 后,于相差顯微鏡下觀察細胞生長情況。待大部分組織塊邊緣有細胞遷移萌出,更換培養基,此后每72 h更換1次培養基。當細胞生長融合達到約80%時,胰酶消化后按照磁珠篩選說明書,分選得到c-kit+細胞,并經c-kit+免疫細胞化學染色鑒定。
1.2.7 篩選后c-kit+細胞純度分析及α7nAChR 在細胞中的表達 將磁珠篩選后的細胞按1×104/孔的密度接種在24 孔板中,在干細胞培養基中生長至60%~80%融合時,通過免疫熒光法檢測c-kit 標志物的表達。每孔隨機讀取5 個視野拍照,統計c-kit 陽性細胞的百分率。另外,將磁珠篩選后的c-kit+細胞按1×104/孔的密度接種在24 孔板中,在干細胞培養基中增殖融合至60%~80%時,通過免疫熒光法檢測α7nAChR在c-kit+細胞中的表達。
1.2.8 Transwell 實驗觀察Ach 對c-kit+細胞遷移的影響 取在干細胞培養基培養條件下的c-kit+細胞,分組進行Ach干預,包括對照組(不加入Ach)、1×10-5mol/L Ach 組、1×10-8mol/L Ach組及1×10-5mol/L Ach+α7nAChR拮抗劑組,每24 h換液1次,共培養5 d。c-kit+細胞處理48 h后,Transwell小室放置于預先準備好的24 孔板中,按上述條件培養箱中過夜,向Transwell 小室下室中加入600μL 含體積分數10%胎牛血清的干細胞培養基。用無血清的DMEM/F-12培養液重懸各組細胞,取200 μL 細胞懸液(細胞總數約1×105個)加至Transwell 的上室。48 h后去除下室中的培養液,將小室置于4%多聚甲醛中固定15 min,擦去小室內室膜上的細胞,0.1%結晶紫溶液染色10 min,PBS 漂洗后,顯微鏡下觀察,每孔隨機讀取5個視野拍照,統計并分析。
1.2.9 Western blot檢測Ach對c-kit+細胞分化的影響 c-kit+細胞在SMC 分化培養基條件下,給予Ach 處理,具體細胞分組同1.2.8。取c-kit+細胞裂解液進行SDS-PAGE 電泳,24 V恒壓轉PVDF 膜45 min。5%脫脂牛奶室溫封閉30 min,1×TBST洗膜3次,每次5 min。內參GAPDH和SM22α抗體分別按照1∶5 000 和1∶1 000 稀釋。室溫孵育2 h,1×TBST 洗3 次后,辣根過氧化物酶標記的羊抗兔二抗室溫孵育30 min,1×TBST 洗3 次后進行顯影。通過Image J 軟件進行半定量分析。
1.3 統計學方法 應用SPSS 22.0 軟件進行數據處理,Graphpad Prism 8.0 軟件作圖。符合正態分布的計量數據以均數±標準差(±s)表示,2 組間均數比較采用獨立樣本t檢驗,多組間均數比較采用單因素方差分析,組間多重比較采用LSD-t法。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠死亡情況 納入24只大鼠,最終死亡3只大鼠,模型組死亡1只,迷走神經刺激組死亡2只。
2.2 各組大鼠新生內膜增厚程度的變化 HE染色結果顯示,假手術組、模型組和迷走神經刺激組的內膜與中膜厚度比分別為(5.27±2.41)%、(211.87±12.47)%和(127.00±19.78)%,組間比較差異有統計學意義(F=175.734,P<0.05)。與假手術組相比較,模型組大鼠新生內膜厚度增加;與模型組相比,迷走神經刺激組新生內膜增厚程度減小,見圖1。

Fig.1 Comparison of neointimal thickness in the injured carotid artery between the three groups of rats(HE staining)圖1 各組大鼠頸總動脈損傷處血管新生內膜厚度比較(HE染色)
2.3 各組大鼠c-kit+在血管壁中分布及數量變化 免疫組織化學染色顯示,假手術組無新生內膜形成,ckit+細胞主要分布于血管壁外膜及中外膜交界處;模型組新生內膜及外膜中均有c-kit+細胞分布,見圖2。模型組和迷走神經刺激組新生內膜中的c-kit+平均光密度值分別為0.057±0.010 和0.019±0.001。與模型組相比,迷走神經刺激組新生內膜中c-kit+細胞表達數量減少(t=6.184,P<0.05)。
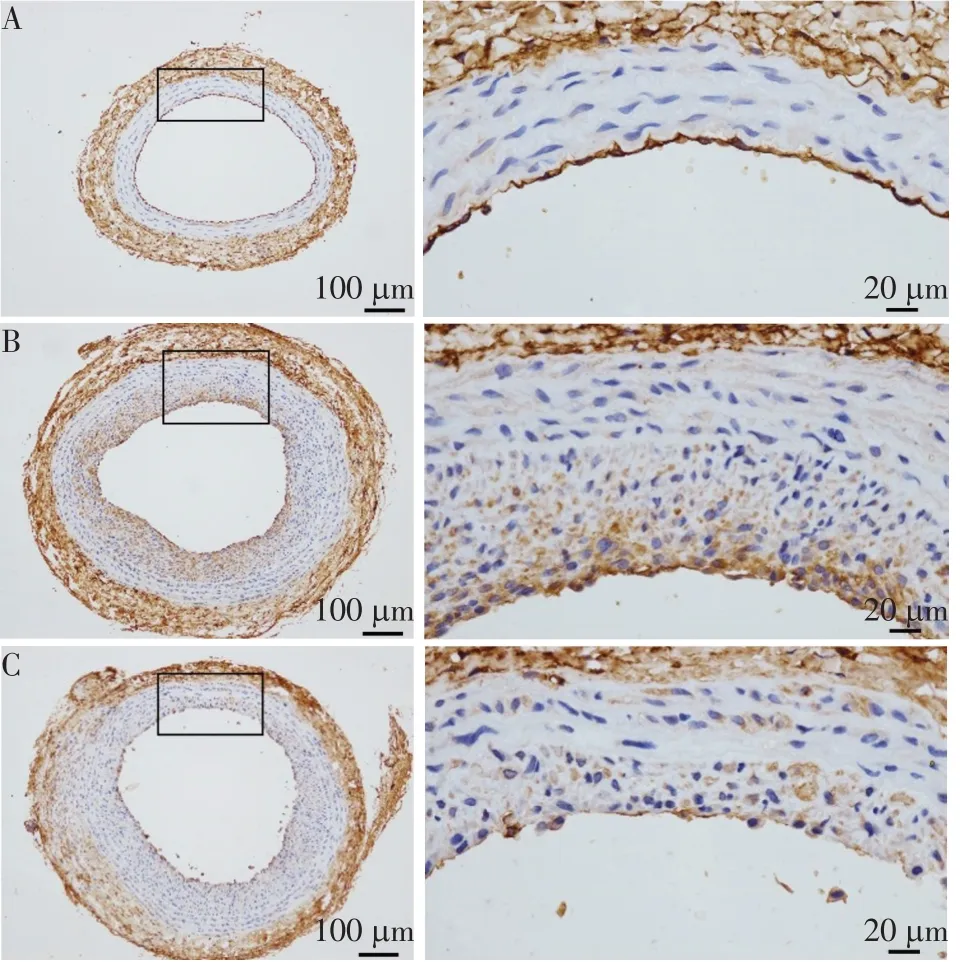
Fig.2 Expression of c-kit+in the injured carotid artery between the three groups of rats(DAB staining)圖2 各組大鼠頸總動脈損傷處c-kit+細胞(DAB染色)
2.4 各組大鼠血清中炎性因子TNF-α 和IL-6 的水平變化 與假手術組比較,模型組大鼠血清中TNF-α和IL-6 的水平均升高;與模型組比較,迷走神經刺激后TNF-α和IL-6水平均降低,見表1。
Tab.1 The serum levels of TNF-α and IL-6 in the three groups表1 各組血清TNF-α和IL-6水平(ng/L,±s)
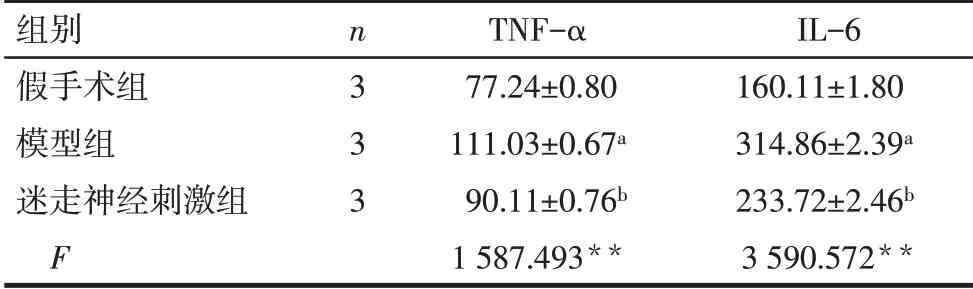
Tab.1 The serum levels of TNF-α and IL-6 in the three groups表1 各組血清TNF-α和IL-6水平(ng/L,±s)
**P<0.01;a與假手術組比較,b與模型組比較,P<0.05。
組別假手術組模型組迷走神經刺激組F n3 3 3 TNF-α 77.24±0.80 111.03±0.67a 90.11±0.76b 1 587.493**IL-6 160.11±1.80 314.86±2.39a 233.72±2.46b 3 590.572**
2.5 篩選后c-kit+細胞純度分析及α7nAChR在細胞中的表達 免疫熒光染色顯示,篩選后的血管壁外膜細胞大多數均表達c-kit(圖3A),c-kit+細胞占比達89%,α7nAChR在c-kit+細胞胞質內表達(圖3B)。
2.6 各組c-kit+細胞遷移能力變化 Transwell 實驗表明,對照組、1×10-8mol/L Ach 組、1×10-5mol/L Ach組和1×10-5mol/L Ach+α7nAChR 拮抗劑組細胞遷移數目(單位:個/視野)分別為102±7、66±4、57±4 和83±8,組間比較差異有統計學意義(F=28.929,P<0.05)。與對照組比較,Ach各組c-kit+細胞遷移能力均降低,且以1×10-5mol/L Ach 抑制c-kit+細胞遷移效果最明顯,給予α7nAChR 拮抗劑處理后,細胞遷移能力較1×10-5mol/L Ach組升高,見圖4。
2.7 各組c-kit+細胞分化能力的變化 Western blot結果顯示,ACh 處理后,SM22α 的表達量高于對照組,給予α7nAChR 拮抗劑處理后,SM22α 的表達量較1×10-5mol/L ACh 組降低(F=354.144,P<0.05),見圖5。
3 討論
PCI 是目前臨床上治療冠心病的一個重要手段[7]。然而,術后再狹窄問題嚴重影響療效[8]。自主神經系統由交感神經和副交感神經(迷走神經)組成,兩者相互拮抗,在維持血管的結構、功能方面發揮重要作用[9]。迷走神經張力降低是各種心血管疾病的共同特點,電刺激迷走神經已在心力衰竭等心血管疾病治療中發揮重要作用[10]。目前在臨床上,神經電刺激憑借安全、經濟、不良反應少等優勢成為一種新的物理治療手段[11]。本研究發現電刺激迷走神經可減輕血管損傷后的狹窄程度。

Fig.3 Characteristics of c-kit+cells and α7nAChR detected by immunofluorescence staining圖3 免疫熒光鑒定c-kit+細胞和α7nAChR表達特征
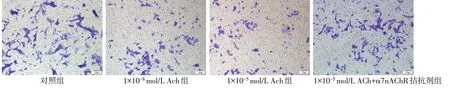
Fig.4 Changes of c-kit+cell migration in each groups(crystal violet staining,×100)圖4 各組c-kit+細胞遷移能力變化(結晶紫染色,×100)

Fig.5 The expression levels of SM22α detected by Western blot assay in different groups圖5 Western blot檢測各組細胞SM22α表達情況
目前研究表明,PCI 術后由于動脈損傷導致的平滑肌細胞增殖及新內膜形成是血管再狹窄的重要因素之一[12-13]。已有研究發現,在血管壁內(特別是外膜和中膜與外膜交界處)存在著能分化成平滑肌細胞的血管壁干細胞,這些細胞在受到損傷刺激時可向內皮下層遷移、增殖,并合成大量細胞外基質,導致新內膜形成[14-16]。c-kit+細胞是一種重要的血管壁干細胞,在血管受到損傷刺激時,可向內皮下層遷移,參與新生內膜形成[17-18]。本研究應用免疫組織化學染色分析發現,迷走神經刺激組的新生內膜中c-kit+細胞數量較模型組減少,表明電刺激迷走神經抑制c-kit+細胞向新生內膜遷移,進而減輕新生內膜厚度。體外分離純化的原代c-kit+細胞,給予迷走神經遞質Ach處理后,細胞遷移能力下降,這一結論與體內動物實驗吻合。大量研究表明,Ach 可作用于α7nAChR 受體依賴的信號途徑激活抗炎系統[19-21]。為進一步研究Ach 抑制c-kit+細胞遷移的機制,本研究利用α7nAChR 拮抗劑探討Ach 對ckit+細胞遷移的影響是否也與α7nAChR 有關。首先證實c-kit+細胞能夠表達α7nAChR,并發現Ach+α 7nAChR 拮抗劑組的c-kit+細胞遷移數較Ach 組增多,表明Ach 可作用于α7nAChR 受體抑制c-kit+細胞的遷移。本研究中的迷走神經刺激組血清中炎性因子TNF-α和IL-6的表達明顯低于模型組,進一步證實電刺激迷走神經促進Ach 釋放,而Ach 可進一步與α7nAChR 結合,從而達到激活抗炎系統[22],抑制血管損傷后新生內膜形成。
有研究表明,小鼠股動脈損傷后,血管壁外膜處的Sca-1+干細胞從外膜遷移至內膜,參與血管重塑,并在到達內膜前發生向平滑肌細胞的轉分化現象[14]。本研究體外觀察Ach 對c-kit+細胞向平滑肌細胞分化的影響,發現Ach促進c-kit+細胞向平滑肌細胞分化,同時給予α7nAChR 拮抗劑能抑制c-kit+細胞向平滑肌細胞的分化。這一結果表明,Ach 是通過與α7nAChR結合而促進c-kit+細胞向平滑肌細胞分化的。結合Ach 能夠直接抑制c-kit+細胞遷移的作用,筆者推測,電刺激迷走神經使得c-kit+細胞遷移至新內膜的數量減少可能與Ach促進血管壁ckit+細胞在到達新生內膜之前已分化為收縮型平滑肌細胞有關。
綜上所述,電刺激迷走神經可通過抑制c-kit+細胞向血管損傷新生內膜遷移而減輕PCI術后內膜增生的不良癥狀。其作用機制與Ach 結合α7nAChR激活抗炎系統、促進其向平滑肌細胞分化有關。但本研究的局限在于體內動物實驗中僅觀察了動脈損傷時c-kit+細胞在血管壁的分布,未對外膜c-kit+細胞向新內膜遷移給予示蹤標記,也未對體內給予Ach 與電刺激迷走神經效果的比較;且機制方面僅檢測了α7nAChR 這一種Ach 的受體,未檢測Ach 的另外一種受體(M 型受體)是否也參與其中。此外,今后仍需進一步對血管損傷后電刺激迷走神經對c-kit+細胞遷移和分化的信號通路的研究,為電刺激迷走神經應用于PCI 術后再狹窄提供新的理論基礎。

