光信號對茶樹葉片類黃酮合成調節機制的研究進展
閭怡清,金晶,胡美娟,葉紅燕,葉儉慧*,梁月榮
1.浙江大學茶葉研究所,浙江 杭州 310058;2.浙江省農業技術推廣中心,浙江 杭州 310000;3.浙江華茗園茶業有限公司,浙江 永康 321300
類黃酮化合物是茶樹(Camellia sinensis)重要的次生代謝產物,具有抗氧化、抗炎等多種生理功效[1-2],是茶葉重要的品質和功能成分。此外,類黃酮化合物參與茶樹的生長發育和逆境脅迫[3-4],其生物合成受到光照、溫度、水分等外界環境條件以及生物脅迫的影響[5-8]。光照是植物生長的必要環境因子,為茶樹光合作用提供能量,同時參與調節茶樹生長發育和次生代謝。研究表明,茶樹類黃酮生物合成受到光照強度和光質的影響[5,9]。
1 茶葉中主要的類黃酮物質
類黃酮化合物占茶樹幼嫩新梢干物質的15%~30%[10]。類黃酮是以2-苯基苯并吡喃為基本結構的一類物質,其基本骨架如圖1-A 所示。黃烷醇(圖1-B)、黃酮醇(圖1-C)和花青素(圖1-D)及其衍生物是茶樹主要的類黃酮物質。黃烷醇類化合物又稱兒茶素類化合物,是茶樹主要的類黃酮物質,占茶多酚總量的70%~80%[11],主要包括兒茶素(C)、表兒茶素(EC)、沒食子兒茶素(GC)、表沒食子兒茶素(EGC)、兒茶素沒食子酸酯(CG)、表兒茶素沒食子酸酯(ECG)、沒食子兒茶素沒食子酸酯(GCG)、表沒食子兒茶素沒食子酸酯(EGCG)8種單體。茶葉中,黃酮醇類化合物是含量僅次于兒茶素類化合物的類黃酮物質,約占多酚總量的13%[11]。根據苷元部分,黃酮醇類化合物可分為山奈酚苷、槲皮素苷、楊梅素苷三大類;根據糖基部分,可分為單糖苷、雙糖苷、三糖苷三大類。花色苷在茶樹葉片中有少量分布,一般占茶樹葉片干物質的0.01%左右。但在紫化茶樹品種中,花色苷含量可達到葉片干重的0.5%~1.0%[12]。茶葉中花色苷主要有矢車菊素苷、飛燕草素苷和天竺葵素苷三大類。
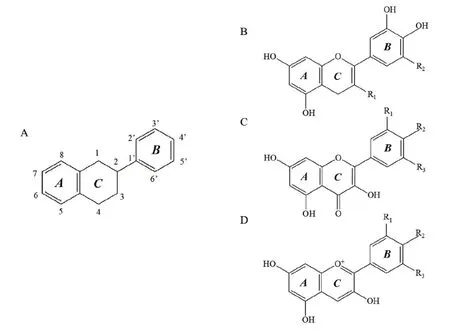
圖1 類黃酮物質的分子結構示意圖
2 類黃酮生物合成途徑及調控
植物體內的類黃酮生物合成途徑主要包括苯丙烷途徑和類黃酮合成途徑(圖2)。碳水化合物經莽草酸途徑轉化為苯丙氨酸,進入苯丙烷途徑,生成香豆酰輔酶A,再經查爾酮合成酶(CHS)催化,進入類黃酮合成通路。在類黃酮合成途徑的下游,分支生成黃烷醇、黃酮醇苷及花色苷等[13]。其中,糖基化是類黃酮化合物的重要終反應之一,而類黃酮糖基轉移酶(UFGT)是重要的催化酶。

圖2 類黃酮物質的生物合成途徑
轉錄因子(Transcription factor)調節目的基因在特定的時間、空間,以特定的強度進行表達,具有調節目標基因轉錄水平的作用。類黃酮物質的生物合成亦受到轉錄因子的調控。MYBs、bHLHs和WD40s是調節類黃酮生物合成最重要的3 個轉錄因子家族。已從茶樹中克隆得到Cs-MYB4a 轉錄因子,該轉錄因子能對結構基因CsC4H、Cs4CL、CsCHS、CsLAR及CsANR2的轉錄起到負調節作用[14]。Zhao 等[15]發現CsMYB12和CsbZⅠP1,CsMYB4 和CsMYB7 均 能 與CsFLS和CsUGT78A14的啟動子區域發生互作。在煙草驗證體系中,CsMYB5a 和CsMYB5b 能促進原花青素在煙草中的積累[16-17]。除MYB 轉錄因子以外,研究表明CsbHLH62、CsWRKY57like 分別能與CsDFR、CsLAR、CCoAOMT基因啟動子區域發生互作,進而參與茶樹甲基化EGCG 的合成調控[18-19]。MYB-bHLH-WD40 復合體(MBW 復合體)參與類黃酮生物合成通路下游結構基因的轉錄調控,如CsMYB85 與CsWD40、CsTT8s、Cs-GLs相互作用形成MBW復合物,調節原花青素的合成[20]。CsMYB196(CsMYB5b)與CsMYB184(CsMYB1)分別與CsWD40、CsTT8a 形成MBW三元復合物,調節CsANR的轉錄[17,20]。Liu 等[21]報道CsWD40 可 與bHLH 轉 錄 因 子CsGL3 和CsTT8,以及MYB 轉錄因子CsAN2 和CsMYB5e發生互作,形成MBW 復合物進而調節花色苷和原花青素的積累。 CsMYB1 能與CsGL3 和CsWD40形成MBW復合物進而促進兒茶素合成基因 的 轉 錄,如CsANS、CsANR和CsSCPL1A[22]。此外,共表達分析法是篩選獲得參與類黃酮合成調控候選轉錄因子的重要方法[23-24]。
3 光照強度對茶樹類黃酮合成的影響
強光照促進茶樹葉片類黃酮物質的生物合成,尤其是黃酮醇苷類和花色苷的積累[25-26]。茶樹類黃酮合成相關基因啟動子序列含有多種光響應元件,如G-box、ACE、GT1-motif、Box 4、Sp1、TCT-motif等,這是茶樹類黃酮合成易受到光照條件影響的重要原因。黑網遮陰能有效降低茶樹生長環境的光照強度,從而減少茶樹葉片苦澀味物質的合成。黑網覆蓋遮陰能有效下調茶樹苯丙烷途徑結構基因的表達水平, 例如CsPAL、CsC4H、Cs4CL、CsCHS、CsF3H、CsF3'H,CsF3'5'H、CsDFR、CsANS、CsANR1、CsFLS和CsUFGT[7,15,27]。此外,類黃酮合成相關轉錄因子MYBs 的表達,如MYB12,亦受到光信號的調節[20,28]。不同類黃酮物質對光照強度的響應存在差異,黃酮醇苷類物質相較于兒茶素類物質更容易受到光照的影響[15]。在相同遮陰條件下,龍井43、中茗192、望海1 號、景寧1 號和中黃2 號的黃酮醇苷類物質降幅大于兒茶素類化合物[21]。Wang 等[7]亦發現經遮陰處理后茶樹葉片的黃酮醇苷類物質的降幅較其他類黃酮化合物大,而不同兒茶素類化合物亦對光照存在差異響應。研究表明EC、EGC對遮陰處理響應迅速[29]。由于茶樹葉片EGCG、ECG 的含量經遮陰處理的降幅較小[28-30],具體表現為遮陰后酯型兒茶素占比增加[28]。不同茶樹品種對黑網遮陰處理存在響應差異。研究表明,玉綠新梢的茶多酚含量在遮陰后期不再降低,而毛頭種新梢的茶多酚含量在遮陰后期仍有明顯減少[31]。黑網覆蓋遮陰能普遍減少不同茶樹品種主要苦澀味物質的合成和積累,這一原理已廣泛應用于抹茶產品的田間栽培管理[32]。同時,覆蓋遮陰還能顯著提高茶葉葉綠素含量和氨基酸含量,使茶葉色澤更綠,滋味更鮮爽,改善茶葉口感,提升抹茶品質。在實際生產中,一般采用90%~95%遮陽度的黑色遮陽網覆蓋20 d 左右[33-34],能有效改變茶葉的內質成分[29,35-36]。然而,由于遮陰顯著降低茶樹生長的光照強度,延緩乃至抑制了茶樹新梢生育,同時大幅度降低了茶樹成熟葉片的光合效率,這對單位時間內或單位面積的鮮葉產量有所影響。因此,可以通過補充大量肥料來減少遮陰對茶樹生長的影響。遮陽網的使用和損耗、有機肥的大量施用和茶樹生長量的減少,這些因素提高了抹茶生產的成本,不利于抹茶相關產業的進一步擴張。
4 光質對茶樹類黃酮生物合成的影響
太陽光由紫外光區段(400 nm以下)、可見光區段(400~710 nm)和紅外光區段(710~1 000 nm)組成,其中可見光區段由17%藍光(400~495nm)、44%綠光(495~570 nm)、30%黃光(570~590 nm)和9%紅光(590~710 nm)組成。研究表明,茶樹類黃酮生物合成對不同的光質具有差異響應。在密閉環境中,低照度(紫外照度<1 μmol/m2·s)或短時間(30 min 以內)的UVB 輻照能促進茶樹葉片兒茶素類化合物的積累,而過量的UVB輻照會減少兒茶素類化合物的含量[37]。UVB 處理能夠降低茶樹葉片兒茶素化合物的含量[38],增加黃酮醇苷類和花色苷的含量[15,38-39]。研究表明,紫外光在芽葉花色苷和黃酮醇苷的積累中起主要作用[40-41]。UVB 處理能促進苯丙烷途徑CsPAL、Cs4CL、CsC4H的表達上調[38],能誘導CsMYB4轉錄進而抑制類黃酮合成途徑CsLAR、CsANR、CsFLS的表達,使得花色苷生物合成加強,具體表現為花色苷含量顯著增加,兒茶素類化合物含量下降[39]。除結構基因以外,類黃酮合成相關轉錄因子亦能響應UVB輻照。經UVB輻照后茶樹葉片CsCPCa、CsCPCb、CsMYBL2b表達水平下調[20],其中擬南芥突變體中已證明CsCPCa的過表達可積累更多的花色苷。UVB 輻照還能促進轉錄因子CsBZⅠP1和CsMYB12形成復合體,進而促進CsFLS和CsUGT78A14轉錄,提高黃酮醇苷類化合物的含量[15]。
茶樹類黃酮合成相關基因表達水平和酶活力受到不同可見光波段的影響。陳思肜[42]對茶樹進行紅光、藍光補光處理,發現茶樹中兒茶素類化合物對有色光補光的響應與其補光強度和補光時間有關。張澤岑等[43]報道經黃色薄膜處理后茶樹葉片的花色苷含量增加。王加真等[44]發現100%的紅光能促進茶樹多酚含量的積累。Zheng等[24]發現夜間采用藍光補光可以促進茶樹葉片花青素和兒茶素的積累,藍綠光補光能增加主要兒茶素類化合物的含量,且藍光的效果要優于藍綠混合光。紅藍光配比對茶樹葉片的類黃酮含量影響不大[45],而夜間進行紅藍光混合光補光,在一定程度內能增加茶樹葉片多酚含量[46]。李智[40]發現藍紫光能夠影響F3H、DFR 的酶活力,而紅橙光主要影響CHⅠ、ANS 的酶活力,但光質對CHS、ANR的酶活力無明顯作用。有研究報道高強度藍紫光能提高F3H 的酶活力,而低強度藍紫光能提高ANR的酶活力[40]。
5 光信號轉導對茶樹類黃酮生物合成的調節作用
植物通過光信號轉導系統響應外界光環境,并進而調節自身生長代謝。光受體是植物對光環境的重要感知器,主要包括UVB 光受體(UVR8)、光敏色素(PHYs)、向光素受體(PHOTs)和隱花色素(CRYs)。光受體在接受光信號后,啟動植物光形態建成和其他生理代謝過程中,光信號元件,如COP1、PⅠFs、SPAs、HY5等,也參與其中。UVR8 是植物感知UVB 的光受體[47],與植物類黃酮合成密切相關[28,48-49]。在UVB處理下,UVR8蛋白能與COP1發生相互作用促進HY5 的積累,進而調控下游UVB 靶基因的轉錄[50-51]。HY5可與靶基因啟動子區域的G box元件發生互作[52],還可以促進自身轉錄[53]。在擬南芥hy5 突變體中已證明CsHY5 能夠響應UVB 促進類黃酮的生物合成,體現在CsHY5 能與CsDFRa、CsFLS、CsLARa基因的啟動子區域發生互作[38]。HY5 還通過誘導介導類黃酮合成途徑的轉錄因子的轉錄啟動并影響類黃酮的合成積累。Lin等[38]研究發現當UVB被濾除后,參與調控茶樹類黃酮合成的CsHY5、CsMYB12、CsMYB75轉錄因子表達量下調,酵母雙雜交技術證明了茶樹CsHY5 與CsMYB12蛋白之間存在互作。在擬南芥中已證實HY5與MYB12之間發生互作從而調節類黃酮的生物合成[54]。此外,在被子植物中向光素受體家族被分為PHOT1和PHOT2兩大分支,是植物感知藍光信號的光受體。在茶樹中,已鑒定到Cs-PHOT1a、CsPHOT1b和CsPHOT2[55]等光受體。隱花色素也是植物中重要的藍光受體,其對應的CsCRY1和CsCRY2基因亦在茶樹中被鑒定和克隆。藍光能夠誘導CsCRY1和CsCRY2基因表達水平的顯著上調[56]。此外,CsCRYs的表達具有組織特異性:根>葉>花>莖[56]。Tai 等[28]采用遮陰處理茶樹葉片,發現CsCRY1和CsCRY2的轉錄水平與CsCHSs和CsFLS呈負相關。關于光信號轉導對茶樹類黃酮合成,特別是花色苷和黃酮醇苷生物合成的分子作用機制,仍有待深入研究。
6 結語
光是調節茶樹生長發育和次生代謝的重要環境因子。類黃酮是茶樹重要的次生代謝產物,與茶葉的滋味品質和生理活性密切相關,同時還參與茶樹對外界環境的響應。基于光信號對茶樹類黃酮生物合成的作用機制,科研工作者們開展了大量通過覆蓋遮陰和LED 燈補光等技術改善茶葉品質的研究工作。覆蓋遮陰已廣泛應用于抹茶生產,能有效降低茶葉的苦澀味物質,改善茶葉的口感。近年來,光信號介導的類黃酮生物合成調控相關研究在眾多園藝植物中已有報道。而關于光信號轉導對茶樹類黃酮生物合成的分子調節機制仍有待深入研究。明確光照強度、光質和光周期等因素對茶樹類黃酮生物合成的影響和作用機制有助于開發新的栽培措施,為改變茶樹重要滋味成分組成,提升茶葉品質提供科學指導和理論依據。

