腎上腺節細胞神經瘤9例臨床診治分析并文獻復習
魏冉,王毅
(安徽醫科大學第二附屬醫院泌尿外科,安徽 合肥 230000)
0 引言
作為一種起源于交感神經系統的臨床罕見良性腫瘤,節細胞神經瘤(Ganglioneuroma,GN)生長速度緩慢,其發病機制尚不明確,主要分布于交感神經節聚集部位,多見于腹膜后腔和后縱隔,見于腎上腺者較少[1]。AGN起病較為隱匿,無特異的臨床表現,多于體檢時偶爾發現,少數患者因腫瘤體積逐漸增大壓迫毗鄰組織而出現腰腹部酸痛不適等癥狀而就診[2]。該病輔助檢查難以定性,術前常易漏診或誤診,最終診斷需依靠術后病理。本研究通過對2012年1月至2021年5月我院收治的9例AGN患者臨床資料進行回顧性分析,針對其診斷及治療方法進行分析,總結相關文獻并復習,現報道如下。
1 資料與方法
1.1 一般資料
本次研究共收集9例AGN患者,其中男2例,女7例,年齡15~58歲,平均年齡42.3歲。病程3天至2個月,平均病程19.6天,腫瘤位于左側4例,右側5例,9例腫瘤均為單發。所有患者中4例因腹痛就診,其余5例均于體檢時偶然發現;1例合并高血壓,1例既往易心悸出汗,詳見表1。

表1 患者臨床資料
1.2 實驗室檢查
患者術前均行血促腎上腺皮質激素(adrenocortico-tropic-hormone,ACTH)、血皮 質醇、血 管緊張素、血醛固酮、尿香草基杏仁酸及腎素、肝腎功能及電解質測定,其中一例血ACTH值稍高為52.00g/mL(正常值為0至46.00g/mL),另一例血ACTH值高于正常值一倍為98.70g/mL,余檢均無明顯異常。
1.3 影像學檢查
患者均行B超、CT及MRI檢查中的一項或多項。5例患者行B超提示低回聲包塊,1例瘤體內可見高回聲點;9例行CT平掃提示低密度影,CT值25至35HU,增強掃描顯示瘤體呈輕度強化或輕中度延遲強化(見圖1-4),2例可見斑點狀鈣化,1例可見低密度壞死區,1例增強后邊緣輕度強化;1例行MRI檢查,增強掃描提示其強化不明顯,平掃表現為短T1長T2不均勻信號。通過影像學表現,患者術前診斷中,2例診斷該病可能,7例無法明確占位性質,所有患者不除外靜息型嗜鉻細胞瘤可能。
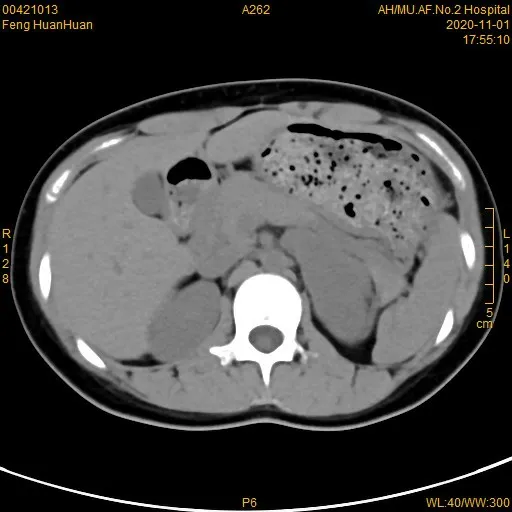
圖1 CT平掃
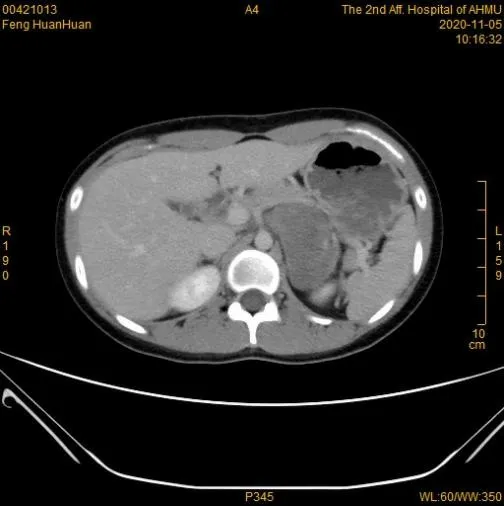
圖4 CT強化期
1.4 治療方法
本次研究9例患者均行腔鏡手術并順利完成,其中4例經后腹腔鏡,5例經腹腔鏡。術中見腫瘤包膜均完整,1例包繞正常腎上腺腺體,無法分離,予完整切除腎上腺及腫塊;1例見腹主動脈旁淋巴結腫大,術中予一并清掃。9例患者術均無法除外嗜鉻細胞瘤可能,圍術期準備均按嗜鉻細胞瘤進行。
2 結果
2.1 圍術期情況
所有患者圍術期血壓均未見顯著變化,均未出現中轉開放、輸血或周圍臟器損。手術時間52~155min,平均101.1min,出血量10~50mL,平均19.4mL。所有患者術后恢復可,未見明顯并發癥發生。術后住院5~9天,平均6.4天。
2.2 病理結果
9例病例術后病理檢查均診斷為AGN(見圖5),最大瘤徑24~80mm,平均54.33mm,切面呈灰白灰黃灰褐色結節樣組織(見圖6),其中3例切面局灶呈囊性,4例合并鈣化,1例合并髓質脂肪瘤,1例除鈣化外伴有出血、壞死、纖維化、玻璃變及骨化。免疫組化結果均提示Vimentin(+)以及S-100(+)。
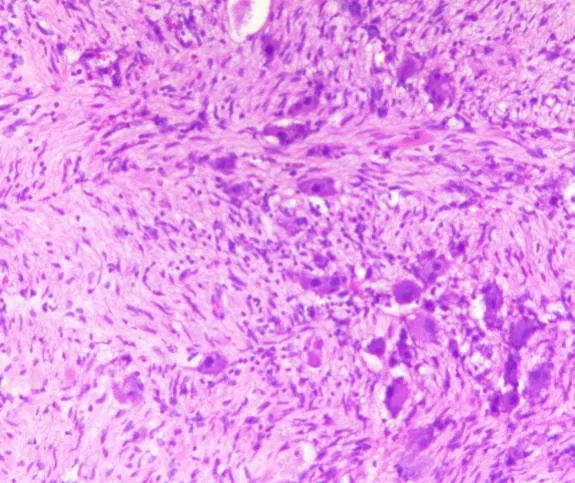
圖5 術后病理200倍HE染色
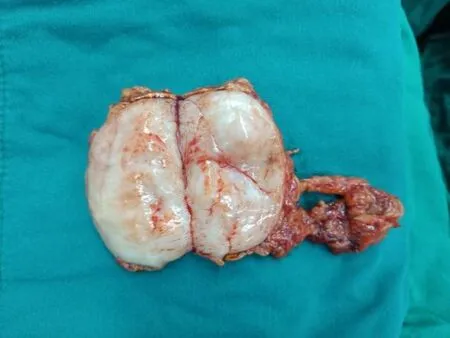
圖6 術后病理大體切面
2.3 隨訪結果
患者術后均予隨訪,隨訪時間5個月至9年,術后均未見并發癥發生,恢復良好,9例患者均未見腫瘤復發或轉移。高血壓患者術后仍需口服降壓藥,心悸出汗患者術后癥狀好轉。所有患者均無腎上腺激素代謝紊亂表現。
3 討論
GN源于構成交感神經系的原始神經嵴細胞,是生長緩慢的臨床罕見良性腫物,多發生于頸部至盆腔脊柱旁交感神經節聚集部位,由神經節細胞、Schwann細胞及神經纖維束構成,以腹膜后和后縱隔最為多見,其次是頸部,發生于腎上腺者較為罕見,文獻報道顯示AGN在腎上腺無功能腫瘤中占2%~12%[3]。當前AGN發病機理尚不明確,有學者認為其可能與基因、激素等有關,既往研究顯示EIF4G1、MSH2等基因在AGN的發展過程中發揮重要作用[4]。AGN可發生于各個年齡段,以成年人多見,文獻報道其多為散發病例,部分文獻報道AGN存在右側優勢,男性發病率稍低于女性[5]。本組AGN患者兒童與成人比例為1:8,右側與左側比例為5:4,男性與女性比例為2:7,與既往文獻報道基本一致。追問病史患者均無相關腫瘤家族史,但Leavitt等[6]既往報道一例家族性病例,因此與遺傳的關系仍需更深入的研究。
AGN一般不分泌兒茶酚胺等腎上腺激素,患者一般無特殊臨床表現,屬無功能性腫瘤,多數于體檢時發現,少部分患者可因瘤體逐步增大,腫瘤推壓周圍組織繼而出現腰背酸痛等非特異性癥狀。Chang等[7]的報道表明,由于AGN可與嗜鉻細胞瘤、腎上腺髓質增生合并出現,因此可出現血壓波動等相應臨床癥狀。此外文獻報道少數AGN可出現分泌兒茶酚胺、睪酮、多巴胺、血管活性腸肽、雄激素等激素分泌活動,并出現男性化、高血壓、多汗、腹瀉等表現[8-9]。本組9例患者中,4例因腹部疼痛不適就診,余均為體檢發現,1例合并高血壓、1例患者易出汗,2例術前內分泌生化實驗室檢查提示ACTH升高。
由于AGN缺乏特異性的臨床癥狀及體征,實驗室檢測也主要用于輔助鑒別診斷,因此目前AGN的術前診斷主要依賴B超、CT及MRI等檢查,但亦缺乏特異性影像學特征。為此我們復習國內外文獻,總結其病理學、影像學規律及其相對特征性影像學表現。AGN具有良性腫瘤的一般特征,如包膜完整、邊緣光滑邊界清。其切面常呈均質凝膠狀,質地韌或柔軟多呈“橡皮樣”,偶見出血壞死或囊變,屬于乏血供腫瘤。由于神經節細胞胞漿豐富且腫瘤內黏液基質比例較大,因此AGN病灶常較柔軟,加之腹膜后間隙較疏松,因而伴隨瘤體逐漸增大腫瘤可沿組織間隙呈嵌入性、鉆縫樣或匍匐樣生長,體積較大者可包繞周圍血管(包括腹腔干、下腔靜脈、門靜脈、腎蒂血管和腹主動脈等),包繞擠周圍組織、血管,但并無侵犯征象[10]。既往研究認為當瘤體最大徑<3 cm,AGN多呈類圓形腫塊且形態規整;當瘤體最大徑為>3 cm時,腫瘤可由于其嵌入性生長特性而呈不規則形,并出現點狀鈣化灶。Dages 等[11]報道提示AGN瘤體內可見散在細點狀鈣化灶,并認為相比粗糙鈣化灶,AGN更好發微鈣化灶,且鈣化灶為粗糙條狀或不規則時提示病灶惡變可能性更大。進一步復習相關文獻后,我們總結以下影像學規律:①AGN瘤體多表現為新月形、偽足狀、類圓形、蠟滴狀或不規則形但邊界清楚的腫塊,部分瘤體可見包繞周圍組織及血管;②B超多表現為實性低回聲或中等回聲均勻腫塊,但瘤體較大時回聲可不均勻,CDFI表現為少許或無彩色血流信號;CT平掃提示瘤體密度均勻并略低于同層肌肉,瘤體較大時可顯示出一定非均質性,衰減值常在21~40Hu之間,并認為非功能性腫瘤CT平掃> 18 HU 時應考慮GN可能[12]; ③B超和CT均可見部分瘤體散在細點狀鈣化;④MR表現為TI加權像呈均勻低或中等信號,T2加權像呈不均勻高信號,部分瘤體內可見由Schwann細胞及神經纖維束構成的線狀或片狀的混雜低信號,其與前者構成的“漩渦征”被認為是AGN的相對影像學特征[13];⑤AGN增強掃描后呈動脈期無強化或輕度強化,門脈期及延遲后逐漸增強,部分病灶可見環形強化,有研究認為延長延遲掃描時間有助于AGN的診斷[14]。
AGN的確診目前仍需病理檢查,大體上腫瘤呈包膜完整、質地軟或韌,切面灰白或黃白色,瘤體呈分葉狀、類圓形或不規則形腫塊,少見出血壞死及囊變。組織學上瘤體內含有較多粘液基質,血管較少,細胞間質疏松水腫。其診斷標準是有異常增生的神經節細胞,含有或不含有神經母細胞。AGN在病理上多分為A、B、C三型[15]:A型神經節細胞較少,主要由神經纖維構成;B型神經節細胞與神經纖維比例相同;C型瘤體內可見神經母細胞,其中A型最多見,C型較少。免疫組化有利于辯識組織來源,并鑒別其他組織來源腫瘤,研究指出在AGN中通常Vim、S100 表達陽性[16],本組9例中病理均符合AGN病理表現。
作為一種緩慢生長并具有潛在惡性進展可能的良性腫瘤,根治性手術切除是AGN目前首選治療方案[17]。既往文獻[18]多依據腫瘤直徑及臨床癥狀決定是否需行手術治療,多數研究認為瘤體最大直徑<3~4cm且不伴臨床癥狀時可隨訪,腫瘤直徑在4~6cm時,手術與隨訪均可,腫瘤直徑>6cm時需積極行手術治療,且對合并有臨床癥狀(如腹痛等)、內分泌檢查異常或影像學懷疑為惡性者,無論腫瘤直徑大小均應行手術治療。有研究認為由于AGN的影像學檢查大多僅起定位作用,難以達到定性診斷,因此對術前難以除外腎上腺惡性腫瘤者均應行手術治療,此外考慮到AGN具有向惡性神經鞘瘤及節細胞神經母細胞瘤和神經母細胞瘤轉變的惡性傾向,并隨著瘤體增大具有推擠包繞周圍組織及管腔的特性,因此對無癥狀的臨床可疑AGN患者可采取更積極的手術態度。鑒于AGN于術前常無法確診,因而圍術期準備與嗜鉻細胞瘤相同。腹腔鏡手術現被認為是治療腎上腺腫瘤的金標準,與其他治療手段相比其具有創傷小、恢復快、視野清晰等優勢。早期研究認為對于直徑>6cm或包繞大血管生長及滋養血管豐富的腫瘤,不推薦使用腔鏡治療[19],但亦有報道顯示對于直徑達17cm的AGN腔鏡手術也取得良好效果[20],因此術前應充分評估腫瘤大小,明確腫瘤邊界及其與血管關系,基于患者綜合病情決定手術方式。AGN大多為良性腫瘤,本組研究所有患者術后隨訪均未見復發或轉移。但亦有文獻報道ANG存在惡變及周圍淋巴結轉移可能[21],因而長期隨診以明確病情變化仍為必需。
綜上所述,AGN是一種臨床罕見的良性腫瘤,一般無特異表現,實驗室及影像學檢查可輔助診斷并具有一定的相對特征,最終確診仍需術后病理,AGN大多預后良好,但仍存在復發或轉移及惡變可能,因此仍需密切復診及隨訪。鑒于本次報道例數較少,所得結論相對局限,因此仍需大樣本多中心數據進行更深入研究。

