大黃花蝦脊蘭內生真菌及土壤真菌的群落特征研究
黃敏, 江標, 高大中, 謝冰, 韋姝羽, 邢韶華
大黃花蝦脊蘭內生真菌及土壤真菌的群落特征研究
黃敏, 江標, 高大中, 謝冰, 韋姝羽, 邢韶華*
北京林業大學生態與自然保護學院, 北京 100083
大黃花蝦脊蘭是列入我國《全國極小種群野生植物拯救保護工程規劃》中亟待拯救的極小種群物種之一。內生真菌及土壤微生物是影響蘭科植物生長繁育的重要因素, 為摸清大黃花蝦脊蘭內生真菌及土壤微生物的群落特征, 促進其種群擴繁, 對采自安徽涇縣大黃花蝦脊蘭開花期和果期的根、根際土、根圍土進行了高通量測序, 對所得序列進行聚類分析、α多樣性分析、β多樣性分析和LEfSe分析, 探究不同時期下大黃花蝦脊蘭的內生真菌和土壤真菌的組成及多樣性變化。結果: 測序得到1127529條有效真菌序列, 通過聚類分析將其劃分為761個OTUs, 分屬于8門、93科、121屬; Venn圖分析發現根和土壤中有24個屬的菌類屬于共有真菌, 植物根存在特有的菌類; 在不同時期大黃花蝦脊蘭的優勢菌群不同, 花期和果期的優勢內生真菌分別為Tulasnellaceae(15.68%)和(56.75%), 優勢土壤真菌分別為(12.19%)和(15.93%); 優勢內生真菌在根、根際土、根圍土的三個不同的水平距離上, 真菌豐度呈梯度性遞減趨勢; 大黃花蝦脊蘭的微生境真菌群落在群落結構和組成上有明顯的季節變化特征。
大黃花蝦脊蘭; 內生真菌; 土壤真菌; 群落結構; 高通量測序
0 前言
大黃花蝦脊蘭(Decne.)是蘭科蝦脊蘭屬植物, 花的形態美觀, 在對12種蘭科蝦脊蘭屬植物的分析與評價中, 其觀賞性得分最高, 生長適宜性僅次于三褶蝦脊蘭()和銀帶蝦脊蘭()[1], 極具觀賞價值和經濟價值。大黃花蝦脊蘭對生境要求苛刻, 種群數量極少, 屬于亟待拯救的極小種群物種[2]。然而該如何拯救?影響該物種種群擴繁的關鍵因素又是什么?目前尚未有明確的答案。早在1903年, Bernard就證實了在自然環境下的蘭科植物種子只有感染了合適的真菌后才能正常萌發生長[3]。近年來, 國內外對蘭科植物的研究日漸增多, 關于蘭科植物內生真菌的研究更是研究熱點。不過, 目前針對大黃花蝦脊蘭的研究僅涉及生態學、組培學[4–5], 而關于其內生真菌的研究還少有報道。最新的研究成果解決了大黃花蝦脊蘭的無菌播種技術問題[5], 但是組培苗往往存在移栽成活率低、生長緩慢、開花延遲甚至不開花等問題[6], 而內生真菌可以顯著提高組培苗的移栽成活率以及鮮重、株高等植株品質[7]。例如, 天麻種子與紫萁小菇等萌發菌伴播技術的研發極大推動了天麻的量產, 提高了天麻的質量[8]。內生真菌還能提高宿主植物對病蟲害的抗脅迫性, 目前已成功應用到多種植物病害的防治研究中。劉艷明等從鐵皮石斛中篩選出34株具有拮抗炭疽菌的內生真菌, 它們對致病菌的抑制率高達85%—95%[9]。此外, 蘭科植物的內生真菌群落并不是一成不變的, 且內生真菌群落結構的變化很可能與寄主植物的物候相關。侯天文等發現蘭科菌根的真菌群落多樣性在生長期達到頂峰, 到果期時則大幅下降[10]。為了較為全面地了解瀕危植物大黃花蝦脊蘭的內生真菌, 本研究通過高通量測序技術, 獲取植物根和土壤的大部分真菌序列, 研究大黃花蝦脊蘭的根部內生真菌和土壤真菌的群落結構和多樣性特點, 對比分析真菌群落在兩個重要生殖生長期之間的變化, 以及優勢內生真菌在水平距離上的分布規律, 對了解大黃花蝦脊蘭與其內生真菌的共生關系具有重要意義, 為該種群的高效擴繁、原地保護和種群再引入提供參考數據。
1 材料與方法
1.1 實驗材料采集及預處理
于2019年4月(花期)和9月(果期), 在安徽省宣城涇縣, 取同一地點大黃花蝦脊蘭的根圍土、根際土、根三類樣品, 考慮到大黃花蝦脊蘭是極小種群物種, 因此在相鄰不超過0.5 m的3個植株上每類樣品各取1份, 每次取樣9份, 共計18份樣品。
大黃花蝦脊蘭所在生境的土層薄, 約10—15 cm。清除土壤表面的枯枝落葉, 挖土壤剖面(從土壤表面挖到巖石表面), 每株植物取3根完整的植株根, 清除根表面明顯的枯落物和大土塊, 置于無菌自封袋中, 放入干冰桶內帶回。本研究將距離根系表面0—1 cm的土壤視為根圍土, 采用抖落的方法, 經2 mm土壤標準篩過篩后存于無菌自封袋中。將距離根表面0.1 mm范圍內的土壤視為根際土, 采用超聲波震蕩的方法將土粒從根表面剝離, 存于無菌自封袋中。土壤樣本中每株植物都盡可能地多取, 每份土壤樣品>5g即可。選取新鮮健康的營養根, 用自來水將根沖洗干凈, 將根剪成2—3 cm長的小段, 再用蒸餾水清洗, 隨后放入0.1%的升汞溶液中浸泡5—8 min, 取出后用蒸餾水沖洗1—2次, 再放入75%的酒精中浸泡20 s左右, 最后用蒸餾水沖4—6次, 晾干后放入無菌EP管。經初步處理后, 將以上樣品移至-80 ℃冰箱中保存。
1.2 真菌基因組DNA提取、擴增及測序
利用DNA提取試劑盒(MN NucleoSpin 96 Soi)對樣品中的DNA進行提取。根據張志東等的研究, 內生真菌多樣性分析中采用ITS1-5F引物對, 可獲得更全面的內生真菌的多樣性數據[11]。因此, PCR擴增采用真菌通用引物ITS1-5F引物對(ITS5: 5’-GGAAGTAAAAGTCGTAACAAGG; ITS2: 5’-GCTGCGTTCTTCATCGATGC-3’)對樣品中真菌的ITS1區域進行擴增, 引物合成和測序由北京百邁客生物科技有限公司進行。PCR反應體系為10 μL體系, 即1 μL DNA模板, 3 μM上游引物, 3 μM下游引物, 5 μL KOD FX Neo Buffer, 4 mM dNTP, 0.2 μL KOD FX Neo, 用ddH2O補足至10 μL。PCR擴增程序為: 95 ℃預變性5 min; 95 ℃變性30 s, 50 ℃退火30 s, 72 ℃延伸40 s, 循環35次; 72 ℃延伸7 min, 最后于4 ℃保溫。在1.8%的瓊脂糖凝膠, 電壓120 V的條件下通過 Solexa PCR(20 μL體系)運行40 min。根據電泳定量結果, 將產物按照質量比1: 1進行混樣。混樣后, 采用OMEGA DNA 純化柱進行過柱純化。在1.8%的瓊脂糖凝膠中, 120 V電壓下電泳40 min后, 切目的片段, 并用Monarch DNA 膠回收試劑盒進行回收, 使用Illumina Hiseq2500 PE250進行雙向測序。
1.3 序列分析
對原始數據進行拼接(FLASH, v1.2.11), 將拼接得到的序列進行質量過濾(Trimmomatic, v0.33), 并去除嵌合體(UCHIME, v8.1), 得到高質量的Tags序列。使用USEARCH(v10.0)軟件對Tags在97%的相似度水平下進行聚類、獲得OTU, 以測序所得的所有序列數的0.005%作為閾值過濾OTU[12], 并基于UNITE(Release8.0)分類學數據庫, 在置信度閾值為0.8的水平下, 通過RDP Classifier(v2.2)軟件對OTU進行分類學注釋。由于本次測序所產生的數據量不一致, 因此需要在隨機抽樣的基礎上進行序列拉平處理。
在Mothur(v.1.30)中使用summary.single指令對各個樣品進行α多樣性指數評估[13], 包括ACE豐富度指數, Chao1豐富度指數, Shannon多樣性指數, 以及Simpson多樣性指數。Chao1和Ace指數分別用于衡量樣品和群落中的真菌種類的多寡。Shannon和Simpson指數用于衡量樣品的真菌多樣性。真菌豐度一定時, 群落中各物種的均勻度越大, 則Shannon指數值越大, Simpson指數值越小, 群落的多樣性越大。相關計算公式如下[14–17]:
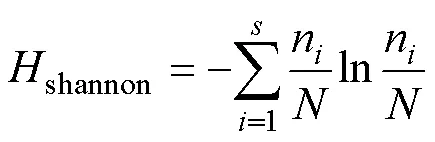
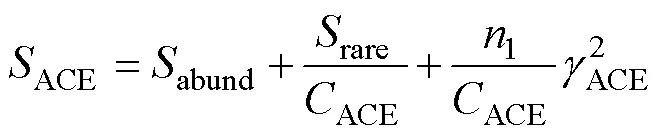
其中,是指實際測量出的OTU數目;n指含有條序列的OTU數目;1指僅包含1條序列的OTU數目;2, 僅包含2條序列的OTU數目;abund指豐富物種數(豐度閾值大于);rare指稀有物種數(豐度閾值小于或等于); γ2ACE指稀有物種變異系數的估算值, 具體計算公式請參考文獻[17]。
基于Binary Jaccard和Bray Curtis距離算法, 通過QIIME軟件中的beta_diversity_through_plots.py計算β多樣性距離矩陣, 利用R語言中的vegan包中的metaMDS()函數和adonis()函數分別進行NMDS分析[18]和PERMANOVA分析, 使用python繪圖展現樣本之間的差異。NMDS分析通過函數將樣品之間的差異程度量化為點與點之間的距離來展現樣品間的差異。PERMANOVA分析的本質是基于統計的方差分析, 依據距離矩陣對總方差進行分解的非參數多元方差分析方法, 可體現不同分組因素對樣品間差異的解釋度, 并使用置換檢驗進行顯著性統計, 以此來尋找造成顯著差異的關鍵因素。
基于QIIME軟件的sumarize_taxa.py實現樣本分類信息的統計, 借助LEfSe在線分析工具實現LEfSe分析, LEfSe分析在樣本內真菌的種屬關系的基礎上結合具有統計學意義的標準檢驗(Kruskal- Wallis檢驗和兩兩Wilcoxon檢驗)和線性判別分析的方法進行特征選擇, 尋找在所有組間具有顯著性差異的物種[19]。
2 結果與分析
根據優質序列的鑒定結果, 我們剔除了數據中的非真菌序列和生物學重復表現不理想的樣本, 僅保留真菌序列與沒有鑒定結果的序列, 最終獲得1127529條優質序列, 聚類分析獲得761個OTUs。其中, 來自根部的真菌序列有453194(占40.19%), 來自土壤的真菌序列有674335(占59.81%)。經分析, 所有樣本中的序列長度主要分布在100 bp—460 bp之間。通過分類學注釋, 得到70%以上的真菌序列在各個分類水平上的分類地位, 包括8門20綱51目93科121屬103種。在所有序列中, 屬于子囊菌門(Ascomycota)真菌的序列占所有序列的49.31%, 擔子菌門(Basidiomycota)真菌則占了19.25%, 其余菌類的分類鑒定結果如圖1, 另有25.65%的序列沒有明確的鑒定結果。
2.1 內生真菌群落特征
在大黃花蝦脊蘭的開花期, 于其根內獲取223194條優質序列。其中, 屬于子囊菌門的真菌序列占12.57%, 屬于擔子菌門的序列占22.32%, 有高達64.81%的序列沒有明確的鑒定結果。在所有序列中, 有15.68%屬于Tulasnellaceae, 1.95%屬于Hydnodontaceae, 1.82%屬于Herpotrichiellaceae, 1.5%屬于, 1.37%屬于Meruliaceae, 其余真菌類群所占比例均小于1%。在這些內生真菌中, Tulasnellaceae的豐度最大, 為該生長時期的優勢內生真菌, 其余的內生真菌占比少。
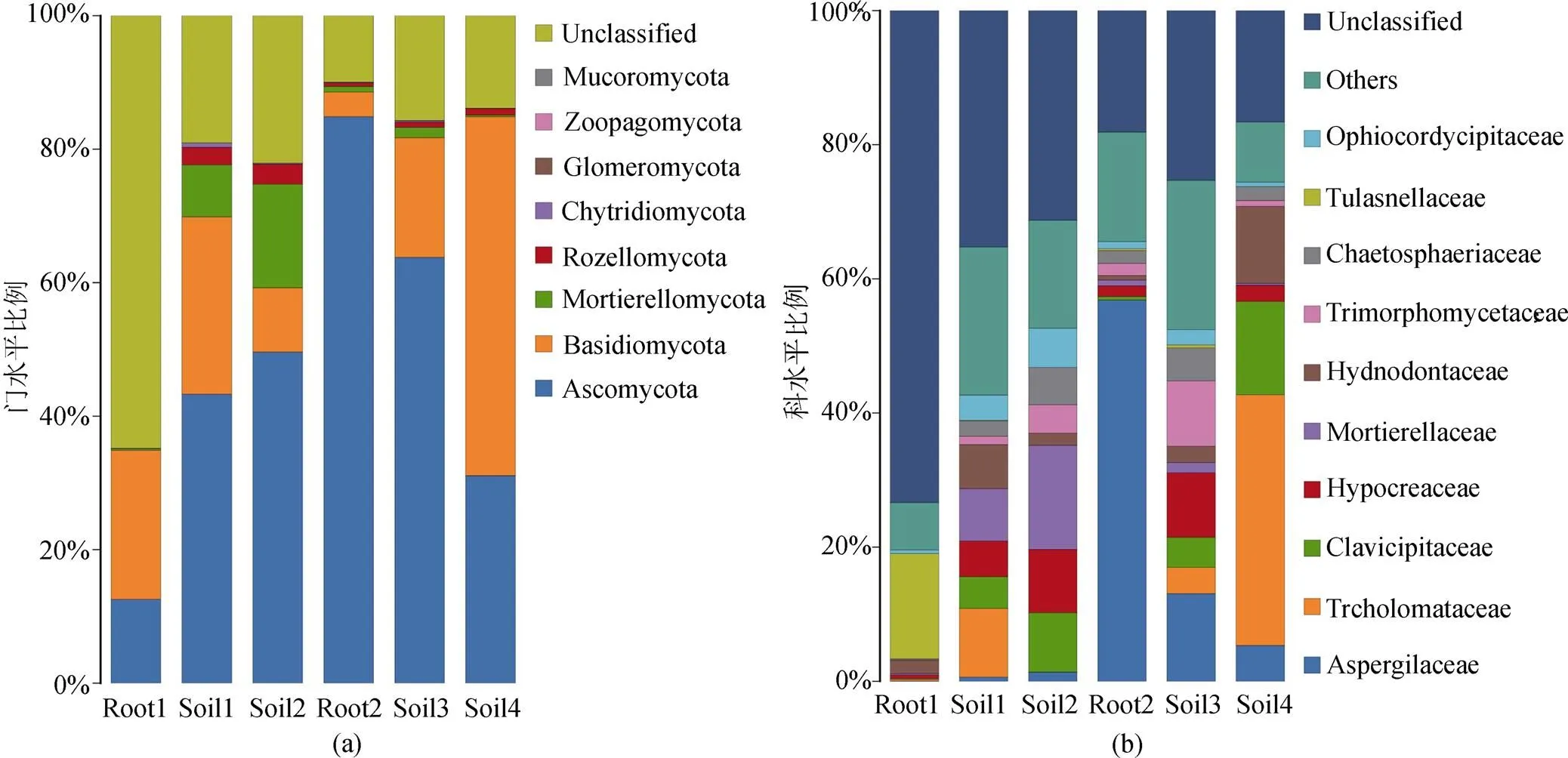
注: 為使視圖效果最佳, 只顯示豐度水平前十的物種; Root1: 花期根; Root2: 果期根; Soil1: 花期根際土; Soil2: 花期根圍土; Soil3: 果期根際土; Soil4: 果期根圍土。
Figure 1 Distribution of species on the level of the Phylum(a) and Family(b)
在大黃花蝦脊蘭的果期, 于其根內獲取1060648條優質序列。為了讓開花和結果時期的數據具有更好的可比性, 從上述序列中隨機抽取230000條序列作為代表序列進行后續分析。在所有序列中, 屬于子囊菌門的真菌序列占84.88%, 擔子菌門的真菌序列占3.66%, 有9.94%的序列沒有明確的鑒定結果。在所有序列中, 有56.75%屬于, 4.53%屬于Didymellaceae, 2.83%屬于Helotiaceae, 1.95%屬于 Chaetosphaeriaceae, 1.78%屬于, 1.59%屬于, 1.11%屬于Leotiaceae, 1.07%Ophiocordycipitaceae, 其余真菌類群所占比例均小于1%。在這些內生真菌中,真菌占所有序列的一半以上, 說明真菌在果期的大黃花蝦脊蘭中占有絕對優勢, 屬于該生長時期的優勢內生真菌。
在logarithmic LDA score為4的基礎上, 通過LEfSe分析, 發現和Tulasnellaceae在兩個生殖生長期的內生真菌和土壤真菌的群落之間具有顯著性差異, 說明這兩類真菌很可能是影響大黃花蝦脊蘭生長發育的關鍵因子之一。
2.2 土壤真菌群落特征
在花期, 從根際土壤中獲得152577條真菌序列。在所有序列中, 有43.29%屬于子囊菌門真菌, 26.57%屬于擔子菌門真菌, 19.04%沒有明確的鑒定結果; 主要真菌類群有(10.21%),(7.81%), Hydnodontaceae(6.57%), Didymella-ceae(5.87%),(5.3%), 其余真菌類群所占比例均小于5%。從根圍土壤中獲取201041條真菌序列。在所有序列中, 有49.63%的序列屬于子囊菌門真菌, 15.51%的序列屬于Mortierellomycota, 22.09%的序列沒有明確的鑒定結果; 主要的真菌類群有(15.51%),(9.43%), Clavici-pitaceae(8.85%), Chaetomiaceae(8.4%), Ophio-cordy-cipi-taceae(5.88%), Chaetosphaeriaceae(5.53%), 其余真菌類群所占比例均小于5%。
在果期, 從根際土壤中獲得205341條真菌序列。在所有序列中, 有66.78%屬于子囊菌門真菌, 17.95%屬于擔子菌門真菌, 15.69%沒有明確的鑒定結果; 主要的真菌類群為Aspergillaceae(13.07%),(9.75%),(9.59%), Helotiaceae (8.72%), 其余真菌類群所占比例均小于5%。從根圍土壤中獲取115376條真菌序列。在所有序列中, 有31.1%屬于子囊菌門真菌, 53.76%屬于擔子菌門真菌, 13.87%沒有明確的鑒定結果; 主要的真菌類群為(37.36%), Clavicipitaceae(13.92%), Hydno-dontaceae(11.49%), Aspergillaceae(5.35%), 其余真菌類群所占比例均小于5%。
2.3 不同時期真菌群落結構的比較
不同生長季節的優勢內生真菌不同: 在大黃花蝦脊蘭的根內, 花期和果期的優勢內生真菌分別為Tulasnellaceae和; 在土壤中, 花期和果期的優勢真菌分別為。此外, 在屬的分類水平上,等24個屬的菌類在所有樣品中均存在, 屬于共有真菌;等7個屬的菌類僅存于果期的植物根及其根圍土中;真菌僅存在花期的植物根及其周圍土壤中;真菌在花期和果期的植物根內均有發現, 但在土壤中沒有發現該真菌, 如圖2所示, Venn圖中顏色越深代表所含菌類的種類越多。
以上結果表明, 受宿主植物的物候影響, 優勢真菌會發生一定程度的改變。
在兩個生殖生長期的真菌群落中, 優勢內生真菌Tulasnellaceae和在根、根際土、根圍土的三個不同的距離上, 真菌豐度呈梯度性遞減的趨勢, 即隨著離大黃花蝦脊蘭距離的增加, 真菌豐度減少, 如圖3。說明根、根際土和根圍土之間的優勢內生真菌在不同的水平距離上存在梯度性差異。
在OTU水平上, 計算各樣品真菌群落的α多樣性指數, 通過獨立樣本T檢驗, 發現兩個生殖生長期的大黃花蝦脊蘭的內生真菌群落的Ace指數、Chao1指數和Shannon指數均顯著低于其土壤真菌群落, 說明內生真菌群落的真菌多樣性和真菌豐富度遠小于土壤真菌群落; 在同一時期的所有樣品中, 根際土的真菌群落的Ace指數、Chao1指數和Shannon指數最大, 說明大黃花蝦脊蘭根表面的真菌種類豐富, 根表面的真菌豐富度要比周圍土壤中的真菌豐富度大, 如表1所示。

注: ⅠRoot: 花期根; ⅡRoot: 果期根; ⅠSoil: 花期土; Ⅱ Soil: 果期土。
Figure 2 Venn diagram showing endophytic fungi and soil fungi in different growing seasons
在OTU水平上, 通過Bray Curtis(考慮真菌豐度和物種有無)距離算法和Binary Jaccard(僅考慮物種有無)距離算法, 對花期和果期的大黃花蝦脊蘭的根、根際土、根圍土的真菌群落進行NMDS分析和PERMANOVA分析, 結果如圖4、5。結果顯示, 每類樣品的真菌群落各自聚在一起, 不同類別樣品的真菌群落互相分開, 且存在一定距離, 表明各類樣品之間的真菌群落結構有一定的差異, 如圖4(a)。除了花期的根際土和根圍土在真菌群落組成上沒有明顯差別之外, 其余樣品的真菌群落組成均有一定差異, 如圖4(b)。其中, 內生真菌之間的距離比土壤真菌之間的距離遠, 說明花期和果期之間內生真菌群落的差異最大, 且果期內生真菌的多樣性遠大于花期。這進一步證明, 大黃花蝦脊蘭的內生真菌群落在一定時間內發生了一定程度的變化, 而這種變化遠大于土壤真菌群落的變化。在兩個生殖生長期中, 大黃花蝦脊蘭的微生境真菌在真菌群落結構(2= 0.223,=0.001)和真菌群落組成(2= 0.287,=0.001)上存在明顯差異, 且這種差異大于生殖生長期內土壤真菌和內生真菌群落之間的差異, 如圖5。這說明大黃花蝦脊蘭的微生境真菌群落在群落結構和組成上存在明顯的季節變化特征。
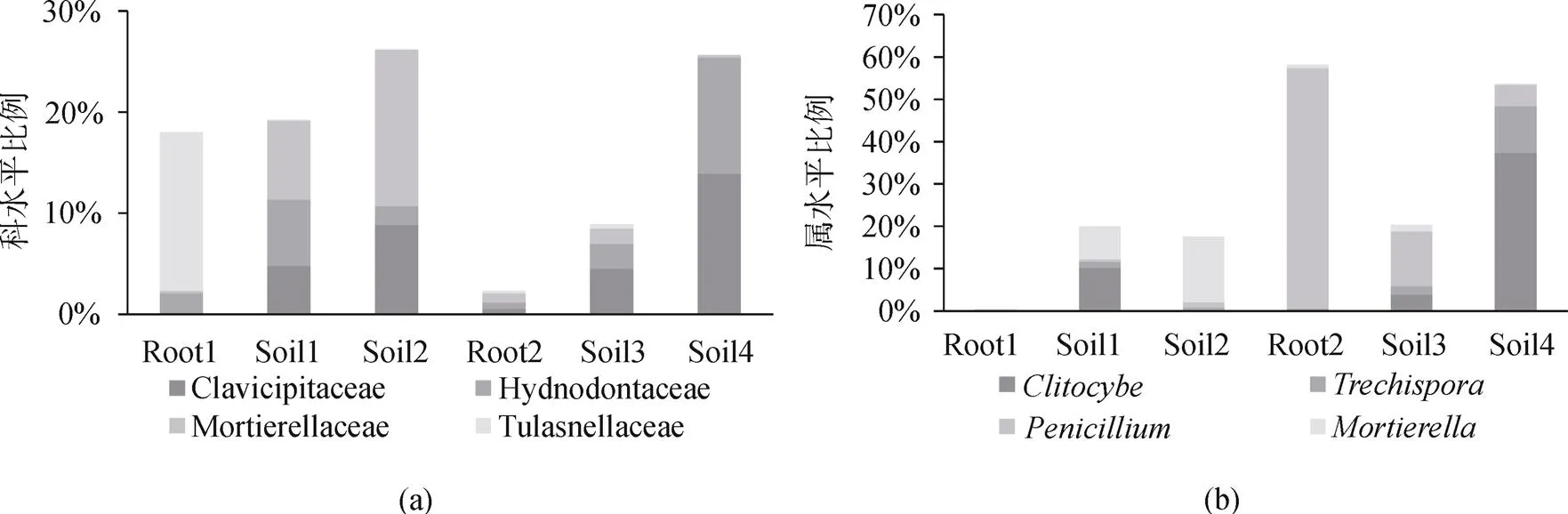
注: 為使視圖效果最佳, 只顯示相對豐度>10%的物種; Root1: 花期根; Root2: 果期根; Soil1: 花期根際土; Soil2: 花期根圍土; Soil3: 果期根際土; Soil4: 果期根圍土。
Figure 3 The dominant fungi of relative abundance of mycorrhizal fungi at different sites of the orchids
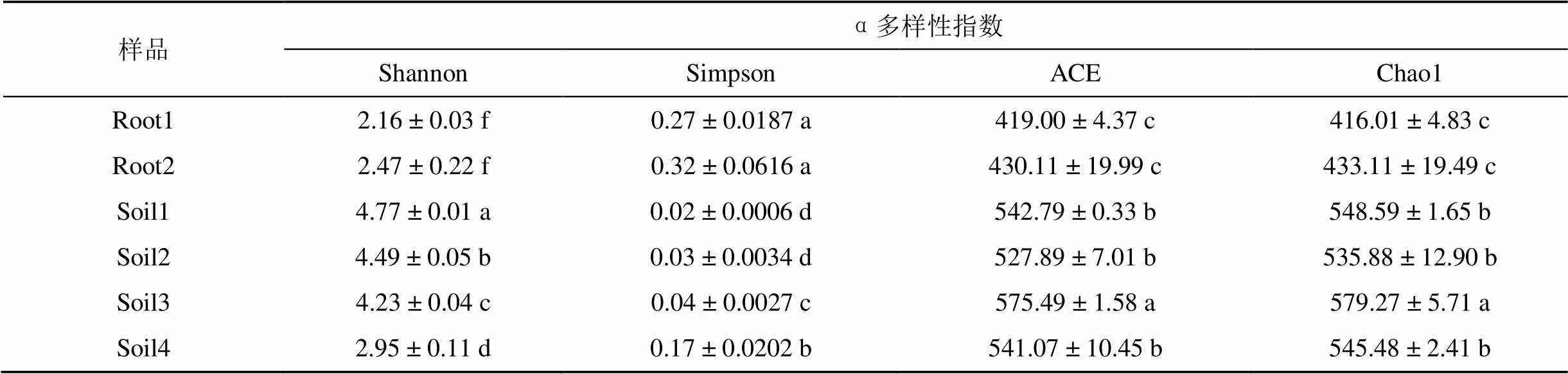
表1 大黃花蝦脊蘭內生真菌和土壤真菌的α多樣性分析
注: 表中數據為數字±標準誤; 同一列中均值統一采用獨立樣本t檢驗進行比較, 同列相同字母表示兩組樣品間沒有顯著性差異(>0.05); Root1: 花期根; Root2: 果期根;Soil1: 花期根際土;Soil2: 花期根圍土;Soil3: 果期根際土; Soil4: 果期根圍土。
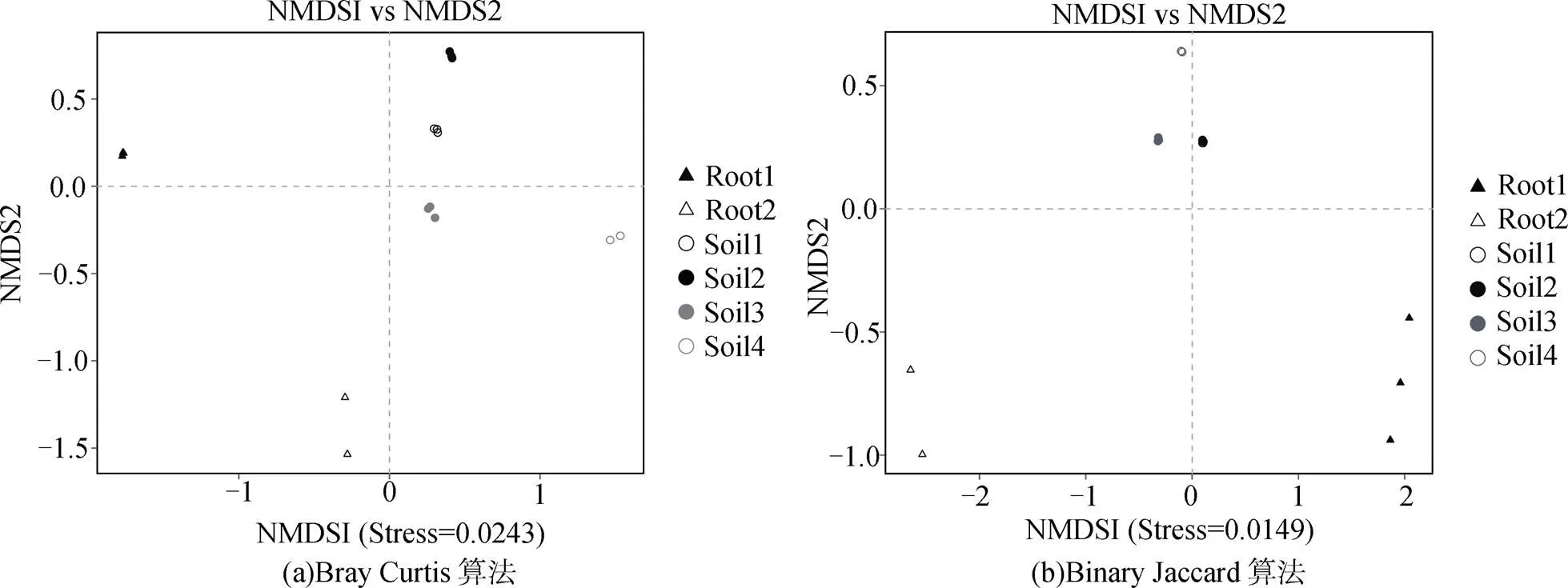
注: Root1: 花期根; Root2: 果期根; Soil1: 花期根際土; Soil2: 花期根圍土; Soil3: 果期根際土; Soil4: 果期根圍土。
Figure 4 The NMDS analysis of fungi in soil and the roots of the orchids
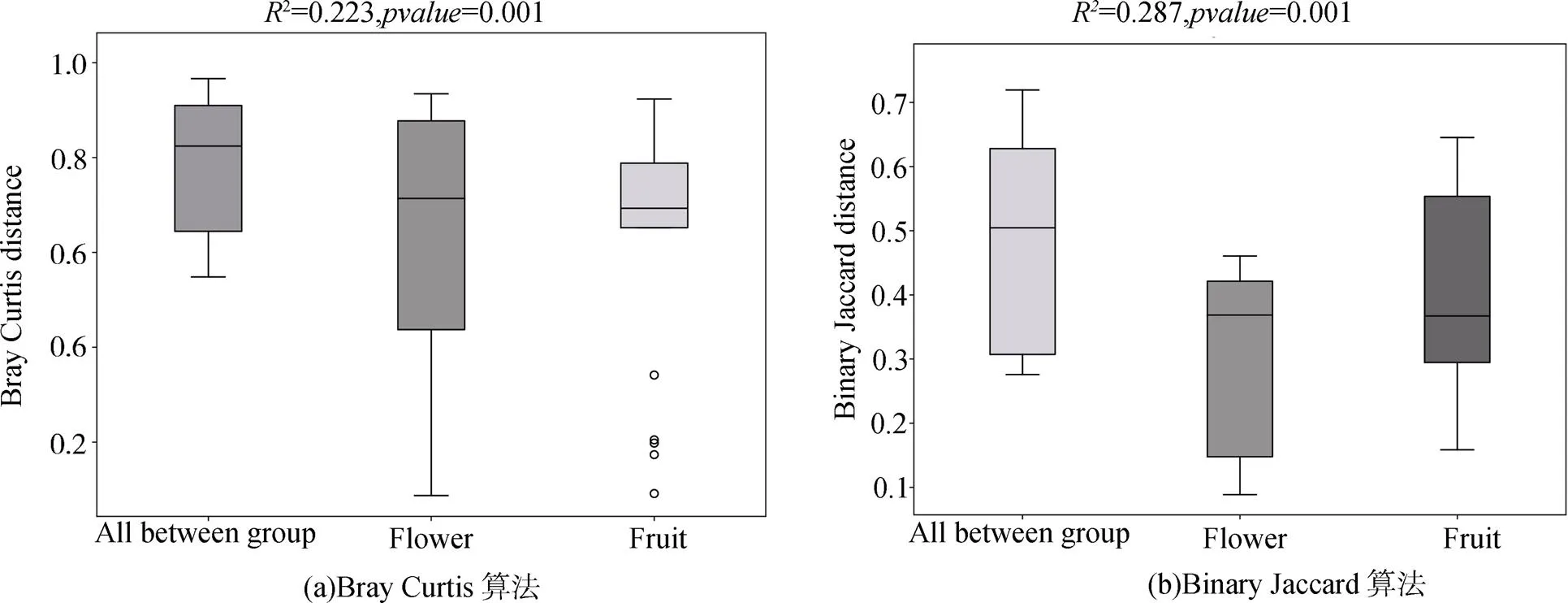
圖5 在開花期和結果期的PERMANOVA分析
Figure 5 PERMANOVA analysis of fungi in flowering and fruiting
3 討論
在花期, 大黃花蝦脊蘭的內生真菌Tula-snellaceae占優勢, 而果期的內生真菌占優勢, 其絕對豐度和相對豐度遠大于花期的優勢內生真菌。這和預期結果一致, 大黃花蝦脊蘭的優勢真菌類群具有階段性變化的特點, 至少在花期和果期這兩個生殖生長期之間, 優勢內生真菌類群發生徹底的轉變。造成這種轉變可能是外在環境因素和植物內在生理生化作用共同促成的結果, 但哪個因素作為主導仍需進一步研究驗證。許國琪等研究表明土壤電導率、空氣CO2濃度以及土壤溫度等環境因子與大部分優勢菌顯著相關[20]。蘭科植物幼苗可與多種真菌共生萌發, 但是進一步發育成成熟植株則會選擇只留下與之共生效益最佳的真菌[21]。這在一定程度上解釋了優勢內生真菌改變的內在原因: 在不同生長時期, 大黃花蝦脊蘭會允許與其共生效益最佳的內生真菌大量增殖, 逐漸替代別的菌類成為優勢種。
根據FUNGuild數據庫[22], Tulasnellaceae是被普遍承認的蘭科菌根真菌, 而作為蘭科菌根真菌則少有報道。且這兩類真菌在兩個生殖生長期之間存在顯著性差異, 推測這兩種菌類是大黃花蝦脊蘭的菌根真菌, 對大黃花蝦脊蘭的生長繁殖起主要作用。但要確定這些真菌是否是大黃花蝦脊蘭的菌根真菌, 還需要確認其在植物根內的形態是否為“菌絲結”, 或進行真菌的分離純化, 再進行真菌回接試驗, 確定其是否對大黃花蝦脊蘭種子的萌發、生長起促進作用。有的植物內生真菌的生態狀態極不穩定, 隨著生活史進程會在不同的功能營養型之間轉換, 采取不同的生存策略來適應環境的變化[23]。相對于內生真菌, 動植物病原菌和木質腐生菌是真菌更常見的生態型[22]。這可能與真菌具有復雜的生活史有關, 當其作為植物內生真菌時能提高植株對各種礦物質元素的吸收進而增大植株生長量, 當植物組織衰敗其作為腐生菌時, 以分解死亡有機物為生。
大黃花蝦脊蘭的內生真菌與土壤真菌共享了至少24個屬(12.8%)的真菌類群, 說明有一部分內生真菌可能來自根際土壤。這可能由于土壤真菌長期與植物根緊密接觸而有機會突破根的表皮進入植物根內定植[24], 但不是所有的真菌都能突破根的表皮進入植物體, 與植物互利共生成為內生真菌, 這可能是本研究中內生真菌多樣性比根際土真菌多樣性低的原因。在花期和果期,作為只存在于植物根內而不存在土壤中的真菌, 可能以菌絲或孢子的形式通過花粉或傳粉昆蟲等載體進入植物體內, 且已有研究表明作為內生真菌對植物的生長有促進作用[25–26], 不排除其作為蘭科植物的內生真菌也具有促進植物生長的能力的可能性, 但目前該菌類作為蘭屬植物的內生真菌還少有報道。
在大黃花蝦脊蘭中, 優勢內生真菌Tulasnella-ceae和在根、根際土、根圍土3個水平距離上, 真菌豐度呈梯度性遞減的趨勢。這可能是植物通過分泌某種真菌自身無法合成的化學物質吸引真菌富集在植物根附近, 這些根際真菌與根內真菌連接形成真菌網絡作為營養輸送“通道”, 由此擴大蘭科植物在土壤中吸收營養的范圍[27]。此外, 還有人發現蘭科植物的菌根真菌主要分布在植物體內及其周圍土壤, 其菌根真菌豐度隨距蘭科植物地理距離增加而下降[28–29], 與本文關于優勢內生真菌在不同距離上呈梯度性變化的觀點一致, 不同的是Mccormick等和Waud等均將距離植株50 cm的范圍作為實驗度量, 表明該梯度規律適用于一定的尺度距離范圍。
在花期和果期之間, 大黃花蝦脊蘭的微生境真菌群落在群落結構和組成上存在明顯差異, 果期的內生真菌多樣性大于花期, 與呂立新等關于內生真菌群落季節動態規律的觀點一致[30]。受不同季節的土壤理化性質的影響, 土壤真菌多樣性和群落組成產生了明顯的變化[31]。內生真菌受溫度、降水等環境因子的影響, 隨著茅蒼術發育進程發生動態變化[32]。推測造成大黃花蝦脊蘭的微生境真菌群落結構發生顯著變化的原因除了植物物候期對應的土壤、溫度和降水等環境因子的改變, 還有不同生殖生長期之間植物內在生理生化的變化。菌根真菌在植物內成功定殖之前, 有一個反復被植物消解而讓蘭科植物獲取營養的過程[33]。在花期的植物根內占優勢的Tulasnellaceae在果期的植物根內仍存在, 但豐度極小。這可能是該真菌在花期定殖之后被蘭科植物反復消化吸收而數量減少, 而后來者提供的營養物質更符合果期蘭科植物的需求, 因而大量定殖。至少在對碳的需求上, 果期的蘭科植物由葉片向生殖器官運輸的14C同化物約為花期的2倍[34]。相對于花期, 果期的蘭科植物需要吸收更多的營養物質用于產生種子, 而花期的優勢內生真菌不能完全滿足這種需求逐漸被植物消化而豐度減小, 果期的優勢內生真菌能產生植物激素, 如赤霉素等促進植物生長, 或進一步擴大植物吸收氮源的范圍, 滿足植物繁育后代的物質需求而大量定殖, 真菌豐度增大[6]。
4 結論
采用生物分子技術對瀕危植物大黃花蝦脊蘭的內生真菌和土壤真菌進行檢測, 較為全面地反映了其微生境真菌的群落組成、結構及分布規律, 為蘭科植物就地保護和遷地保護中涉及的生境評估提供參考。通過分析大黃花蝦脊蘭開花期和果期的根、根際土、根圍土的真菌群落發現受不同生殖生長期的植物生理影響, 大黃花蝦脊蘭的優勢內生真菌隨發育進程發生相應轉變, 再加上外在環境因子的綜合作用, 使得微生境的真菌群落結構和組成發生顯著變化。Tulasnellaceae和分別作為花期和果期的大黃花蝦脊蘭的優勢內生真菌, 在水平距離上, 真菌豐度呈梯度性遞減的特點。與以往的研究相比, 本研究更關注不同生殖生長期對微生境真菌群落動態變化的影響, 以找出對大黃花蝦脊蘭生長發育起關鍵作用的菌類, 為大黃花蝦脊蘭的保護提供更合理的依據。但仍存在一定不足, 如本研究的大黃花蝦脊蘭種群僅采自安徽涇縣同一個地點, 范圍未涉及不同生境下的植物, 不同生境下大黃花蝦脊蘭的真菌群落結構與分布是否有相似特點和規律有待進一步探討。
致謝:感謝北京林業大學公共分析測試中心的張峻琦老師在實驗過程中的指導。
[1] 黃元貞, 劉海平, 馬良, 等. 基于層次分析法評價12種蝦脊蘭屬植物的觀賞性和生長適應性[J]. 福建農林大學學報: 自然科學版, 2018, 47(6): 667–672.
[2] 謝丹, 張成, 張夢華, 等. 湖北單子葉植物新記錄[J]. 西北植物學報, 2017, 37(4): 815–819.
[3] BERNARD N. Recherches expérimentales sur les orchidées[J]. Revue Générale de Botanique, 1904, 16: 405–451.
[4] 張孝然, 蒲真, 黃治昊, 等. 大黃花蝦脊蘭生境特征及生存群落物種生態位分析[J]. 植物科學學報, 2017, 35(6): 799–806.
[5] 劉海平, 陳秀萍, 李珺, 等. 大黃花蝦脊蘭種子特性及無菌播種[J]. 福建農林大學學報: 自然科學版, 2020, 49(1): 29–34.
[6] 伍建榕, 馬煥成. 地生蘭與菌根真菌共生關系研究[M]. 北京: 科學出版社, 2016.
[7] 王亞妮. 蘭科石斛屬植物根部內生真菌多樣性研究及應用[D]. 北京: 北京林業大學, 2013.
[8] 徐錦堂. 我國天麻栽培50年研究歷史的回顧[J]. 食藥用菌, 2013, 21(1): 58–63.
[9] 劉艷明, 黃雅麗, 李婷, 等. 野生與人工栽培鐵皮石斛內生真菌生物多樣性比較及抗炭疽病活性菌株的篩選[J]. 華南農業大學學報, 2020, 41(3): 47–55.
[10] 侯天文, 金輝, 劉紅霞, 等. 四川黃龍溝優勢蘭科植物菌根真菌多樣性及其季節變化[J]. 生態學報, 2010, 30(13): 3424–3432.
[11] 張志東, 朱靜, 唐琦勇, 等. 不同擴增引物對高通量測序分析鹽角草內生真菌多樣性的影響[J]. 微生物學通報, 2020, 47(2): 411–419.
[12] WANGYu, SHENG Huafang, HE Yan, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and Environmental Microbiology, 2012, 78(23): 8264–8271.
[13] KOZICH J J, WESTCOTT S L, BAXTER N T, et al. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied and Environmental Microbiology, 2013, 79(17): 5112–5120.
[14] SHANNON C E. A mathematical theory of communication[J]. The Bell System Technical Journal, 1948, 27(3): 379–423.
[15] SIMPSON E H. Measurement of Diversity[J]. Nature, 1949, 163: 688.
[16] CHAO A. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 1984, 11(4): 265–270.
[17] CHAO A, YANG M C K. Stopping rules and estimation for recapture debugging with unequal failure rates[J]. Biometrika, 1993, 80(1): 193–201.
[18] LOOFT T, JOHNSON T A, ALLEN H K, et al. In-feed antibiotic effects on the swine intestinal microbiome[J]. Proceedings of the National Academy of Sciences, 2012, 109(5): 1691–1696.
[19] SEGATA N, IZARD J, WALDRON L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 2011, 12(6), doi: 10.1186/gb-2011-12-6-r60.
[20] 許國琪, 劉怡萱, 曹鵬熙, 等. 青藏高原不同生態環境下冰川棘豆()內生細菌多樣性研究[J]. 高原科學研究, 2020, 4(1): 20–29.
[21] RASMUSSEN H N. Recent developments in the study of orchid mycorrhiza[J]. Plant and Soil, 2002, 244(1/2): 149–163.
[22] NGUYEN N H, SONG ZW, BATES S T, et al. FUNGuild: an open annotation tool for parsing fungal community datasets by ecological guild[J]. Fungal Ecology, 2016, 20: 241–248.
[23] ARNOLD A E, LUTZONI F. Diversity and host range of foliar fungal endophytes: Are tropical leaves biodiversity hotspots? [J]. Ecology, 2007, 88(3): 541–549.
[24] 周婕, 苗一方, 方楷, 等. 紫莖澤蘭內生真菌及其根際土壤真菌的多樣性研究[J]. 生態科學, 2019, 38(5): 1–7.
[25] 杜疏煬, 楊自強, 韓婷, 等. 促進擬南芥生長的西紅花內生真菌的篩選和研究[J]. 中藥材, 2018, 41(6): 1271–1275.
[26] 張娜莎. 紅景天內生真菌及其對宿主生長發育影響的初步研究[D]. 太原: 山西大學, 2014: 35–43.
[27] 蓋雪鴿, 邢曉科, 郭順星. 蘭科菌根的生態學研究進展[J]. 菌物學報, 2014, 33(04): 753–767.
[28] MCCORMICK M K, TAYLOR D L, WHIGHAM D F, et al. Germination patterns in three terrestrial orchids relate to abundance of mycorrhizal fungi[J]. Journal of Ecology, 2016, 104(3): 744–754.
[29] WAUD M, BUSSCHAERT P, LIEVENS B, et al. Specificity and localized distribution of mycorrhizal fungi in the soil may contribute to co-existence of orchid species[J]. Fungal Ecology, 2016, 20: 155–165.
[30] 呂立新, 王宏偉, 梁雪飛, 等. 不同化學型和季節變化對茅蒼術內生真菌群落多樣性的影響[J]. 生態學報, 2014, 34(24): 7300–7310.
[31] 任玉連, 范方喜, 彭淑嫻, 等. 納帕海沼澤化草甸不同季節土壤真菌群落結構與理化性質的關系[J]. 中國農學通報, 2018, 34(29): 69–75.
[32] 曹益鳴, 陶金華, 江曙, 等. 茅蒼術內生真菌生物多樣性與生態分布研究[J]. 南京中醫藥大學學報, 2010, 26(2): 137–139.
[33] 范黎, 郭順星, 肖培根. 密花石斛等六種蘭科植物菌根的顯微結構研究[J]. 植物學通報, 2000, 17(1): 73–79.
[34] 潘瑞熾, 葉慶生. 國蘭生理[M]. 北京: 科學出版社, 2006.
Community characteristics of endophytic fungi and soil fungi in the
HUANG Min, JIANG Biao, GAO Dazhong, XIE Bing, WEI Shuyu, XING Shaohua*
School of Ecology and Nature Conservation, Beijing Forestry University, Beijing 100083, China
is one of the rare and endangered plant species which has been identified as an extremely small population in the national-level. Endophytic fungi and soil microorganisms are important factors affecting the growth and breeding of Orchidaceae. In order to find out the community characteristics of endophytic fungi and soil microorganisms associated with, and to promote its breeding and propagation, the high-throughput sequencing was performed on the roots, rhizoplane soil and rhizosphere soil ofcollected from Jingxian County, Anhui Province in flowering and fruiting. We performed Cluster analysis, Alpha diversity analysis, Beta diversity analysis and LEfSe analysis on the obtained sequences to explore the composition and diversity of endophytic fungi and soil fungi in different periods. The results showed that a total of 1127529 valid sequences of fungi were obtained by high-throughput sequencing, which divided into 761 OTUs by cluster analysis, belonging to 8 Phyla, 93 families and 121 genera. Venn diagram analysis showed that 24 genera of fungi in the root and soil were common fungi, whileonly in the root of plants. The fungi ofhad different dominant groups in different periods, with Tulasnellaceae (15.68%) and(56.75%) being dominant in the flowering and fruiting period; the dominant soil fungi were(12.19%) and(15.93%) respectively. The abundance of the dominant endophytic fungi showed a ladder-type decreasing tendency at three different horizontal distance from the root to rhizoplane soil and to rhizosphere soil. The community structure and composition of the microflora fungi community ofhad noticeable seasonal variation in characteristics.
; endophytic fungi; soil fungi; community structure; high throughput sequencing
10.14108/j.cnki.1008-8873.2022.04.014
Q939.5
A
1008-8873(2022)04-111-09
2020-08-03;
2020-09-02
國家林業和草原局野生動植物保護與自然保護區管理司委托項目; 北京市大學生科學研究與創業行動計劃項目(S201910022098)
黃敏(1998—), 女, 廣西梧州人, 碩士研究生, 主要研究生物多樣性保護與利用, E-mail: 623629892@qq.com
通信作者:邢韶華, 男, 博士, 副教授, 主要從事生物多樣性保護與利用和自然保護區規劃研究, E-mail: steelboy78@163.com
黃敏, 江標, 高大中,等. 大黃花蝦脊蘭內生真菌及土壤真菌的群落特征研究[J]. 生態科學, 2022, 41(4): 111–119.
HUANG Min, JIANG Biao, GAO Dazhong, et al. Community characteristics of endophytic fungi and soil fungi in the[J]. Ecological Science, 2022, 41(4): 112–119.

