基于定量磨玻璃樣陰影特征的肺癌預后分析研究
吳一鵬 吳顯寧 徐美青
肺癌是世界范圍內嚴重危害人類健康與壽命預期的惡性疾病,每年的發病率逐年升高且位居首位[1]。我國2020年肺癌新發病例數及死亡病例數依舊在各類惡性腫瘤中位列第一,新發病例81.6萬例,其中男性53.9萬,女性27.6萬例;死亡病例71.5萬例,其中男性47.2萬例,女性27.3萬例[2]。隨著醫學影像學技術的進步及人們健康意識的增強,低劑量計算機斷層掃描(low dose computed tomography,LDCT)得以在肺癌的早期篩查與治療中廣泛應用,越來越多的磨玻璃樣陰影(ground-glass opacity,GGO)被發現。磨玻璃樣陰影不僅可見于良性疾病,而且更多的為肺腺癌的早期表現[3]。目前對于GGO型肺腺癌的主要手術方式為亞肺葉切除術及肺葉切除術,而對于具體術式的選擇,目前尚無統一定論。在國外的一些回顧性研究[4-5]中,對于直徑在20 mm或更小的I期非小細胞肺癌,與肺葉切除術相比,亞肺葉切除術可以在不損害生存的情況下最大程度的保留肺功能。因此,針對CT篩查提示的GGO病變,通過CT圖像對術前病理診斷及手術范圍的確定顯得尤為重要。
而隨著影像學技術的發展,通過定量分析CT的影像學結果對GGO的侵襲性及良惡性逐漸得到廣泛應用。目前對于GGO的影像學定量分析指標目前尚無統一標準,在多項定量分析指標中,實性成分占腫瘤比率(consolidation tumor ratio,CTR)為一項常用的影像學表征參數,其定義是肺窗中實性成分大小與結節總大小的比值[6]。根據多項研究結果,CTR對于早期以GGO為表現的肺腺癌的診斷有著良好的診斷作用[7-9],但對于CTR與患者術后生存率及淋巴結有無轉移的研究相對較少。本研究通過對接受肺切除手術的112例患者的回顧性研究分析,從而探討CT定量分析在GGO惡性程度及生存預后的預測意義。
1 資料與方法
1.1 一般資料 選取2014年12月至2019年10月于安徽醫科大學附屬省立醫院胸外科行肺切除手術且術后有明確病理診斷的112例患者,患者術前均接受胸部LDCT、實驗室檢查,并行腦部MRI,腹腔B超、骨掃描等檢查排除遠處轉移可能。其中男性53例,女性59例,年齡27~78歲,平均(52.11±12.22)歲。根據CTR值將納入患者分為A組(CTR≤0.25)17例,B組(0.25

表1 4組CTR范圍患者臨床與影像學資料比較
1.2 納入及排除標準 納入標準:術前CT篩查掃描發現單發結節,同時術前未接受放化療;淋巴結術前影像學評估為N0,術前患者未接受穿刺活檢等有創淋巴結檢查方法;手術方式為肺葉切除或亞肺葉切除。排除標準:①術前CT檢查提示多發結節;②術前檢查提示有淋巴結或遠處器官轉移;③術前行活檢已明確病變病理類型的患者;④未行手術或臨床資料不完整。
1.3 方法 ①臨床資料:所收集患者臨床資料均來自于安徽醫科大學附屬省立醫院病案室,所有納入患者隨訪3~69個月,平均隨訪(35.91±1.91)月。統計患者的年齡、性別、吸煙史,手術方式,病理類型,術后TNM分期、總生存期(overall survival,OS)及無復發生存期(relapse free survival,RFS)。其中總生存率為自患者手術后至患者死亡時間或隨訪截止時間,無復發生存期為自患者手術后至疾病復發或截止隨訪時間。②CT掃描方法:采用Simens Somatom Sensation 64層螺旋CT機,行CT掃描時囑患者取仰臥位,同時雙臂向上,頭先進,并在吸氣末屏氣用5 mm層面的薄層CT機進行掃描。范圍包含從胸廓入口到肺底部。調整機器參數,將肺窗窗寬設置為1 500~2 000 HU(hounsfied units, HU),窗位設置為-700~-600 HU,縱隔窗窗寬設置為350~400 HU,窗位設置為35~50 HU。所有圖像均在此參數標準下獲得。③CT圖像分析:所有CT掃描采集數據均由2位高年資的影像科醫師及1位高年資的胸外科醫師在未知患者臨床資料的情況下共同閱片產生,其中有爭議的GGO由第三位具有15年影像經驗的高年資影像科醫師閱片并得出結果。將肺內呈不規則模糊密度增高,且未掩蓋其中的血管及支氣管影的局灶性病變歸為GGO,通過醫學影像存檔和通訊系統(picture archiving and communication systems, PACS)對收集的GGO影像資料進行分析,收集GGO最大徑、GGO中實性成分最大徑。見圖1。
其中關于GGO的最大徑,定義為在上述規定肺窗之下,找到最大界面,并在此界面下量取的最長直徑,而對于GGO實性成分最大徑,同樣在上述界面下量取其中實性成分的最大直徑。CTR定義為GGO實性成分最大徑與GGO的最大徑之比。④病理結果分析:所有病理標本均來源于胸腔鏡或開胸手術,所有標本均通過甲醛固定、切片包埋、HE染色,由2位高年資病理科醫師給出結果,診斷分歧時經由病理科討論達成統一結果。按照2011年版IASLC肺腺癌分類標準予以分類[10]。

注:白線表示GGO最大徑,黑線表示實GGO實性成分最大徑,GGO實性成分最大徑與GGO最大徑之比為CTR。

2 結果
2.1 4組GGO患者臨床及影像資料比較 4組患者CTR范圍的病理類型、復發情況及淋巴結轉移比較,差異均有統計學意義(P<0.05)。4組患者手術方式的選擇差異有統計學意義(P<0.001)。根據病理結果的浸潤程度,將四組患者分為浸潤組及非浸潤組。不同病程類型侵襲程度差異有統計學意義(P<0.05)。見圖2、表2。
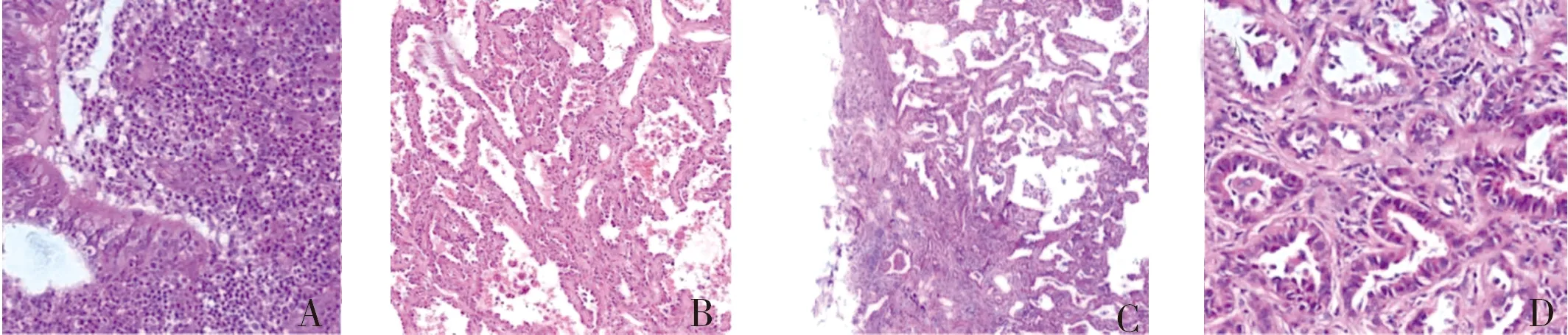
注:A為炎性假瘤,B為原位腺癌,C為微浸潤性腺癌,D為浸潤性腺癌。
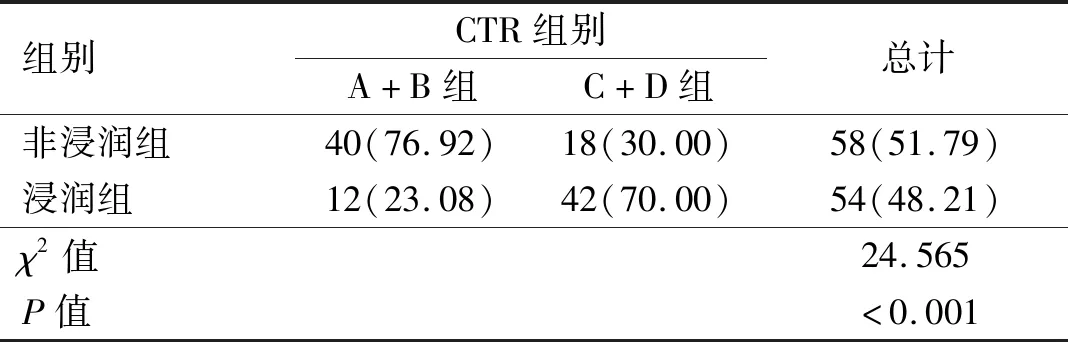
表2 A、B組與C、D組間侵襲性差異分析[例(%)]
2.2 GGO生存的Cox回歸分析 將年齡、性別、手術方式、GGO最大徑、GGO實性成分最大徑、CTR、吸煙史及淋巴結轉移情況納入GGO患者的RFS的單因素分析,其中因變量設置為RFS,其中有復發=1,無復發=0。自變量中男性=1,女性=0;肺葉切除術=1,亞肺葉切除術=0;有吸煙史=1,無吸煙史=0;淋巴結轉移陽性=1,陰性=0;其余為連續變量。將其中GGO實性成分最大徑、CTR、吸煙史及淋巴結轉移四項指標納入多因素分析。CTR(HR=1.972; 95%CI:1.482~3.214;P<0.001)及淋巴結轉移(HR=4.177; 95%CI:1.359~12.837;P<0.001)是影響GGO生存的獨立影響因素。見表3。

表3 GGO患者生存的單因素及多因素Cox回歸分析
2.3 GGO侵襲性的logistic分析 單因素分析中,所有GGO的侵襲性在CTR、GGO最大徑、GGO實性成分最大徑方面,差異有統計學意義(P<0.05)。將以上因素納入多因素logistic分析,其中GGO的侵襲性為因變量,浸潤組=1,非浸潤組=0。自變量中男性=1,女性=0;有吸煙史=1,無吸煙史=0;其余為連續變量。根據SPSS軟件計算結果顯示CTR為GGO侵襲程度的獨立危險因素。見表4。
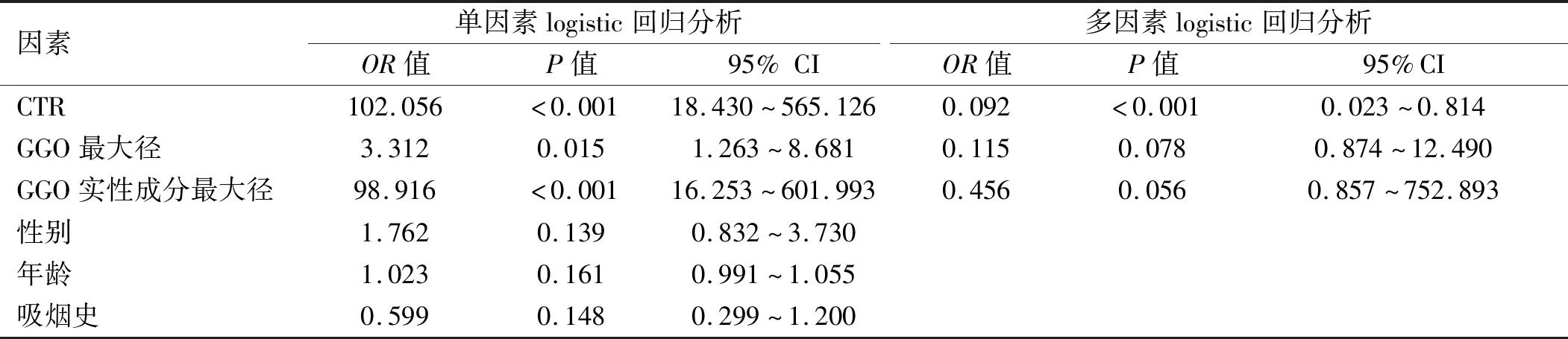
表4 GGO侵襲性的單因素及多因素logistic回歸分析
2.4 生存分析 以CTR分組OS與RFS見圖3、4所示。總體上隨著CTR的增加患者的OS于RFS呈現逐級降低趨勢(P<0.05)。通過log-rank檢驗,證明A、B組與C、D組的OS與RFS,差異有統計學意義。見表5、6。
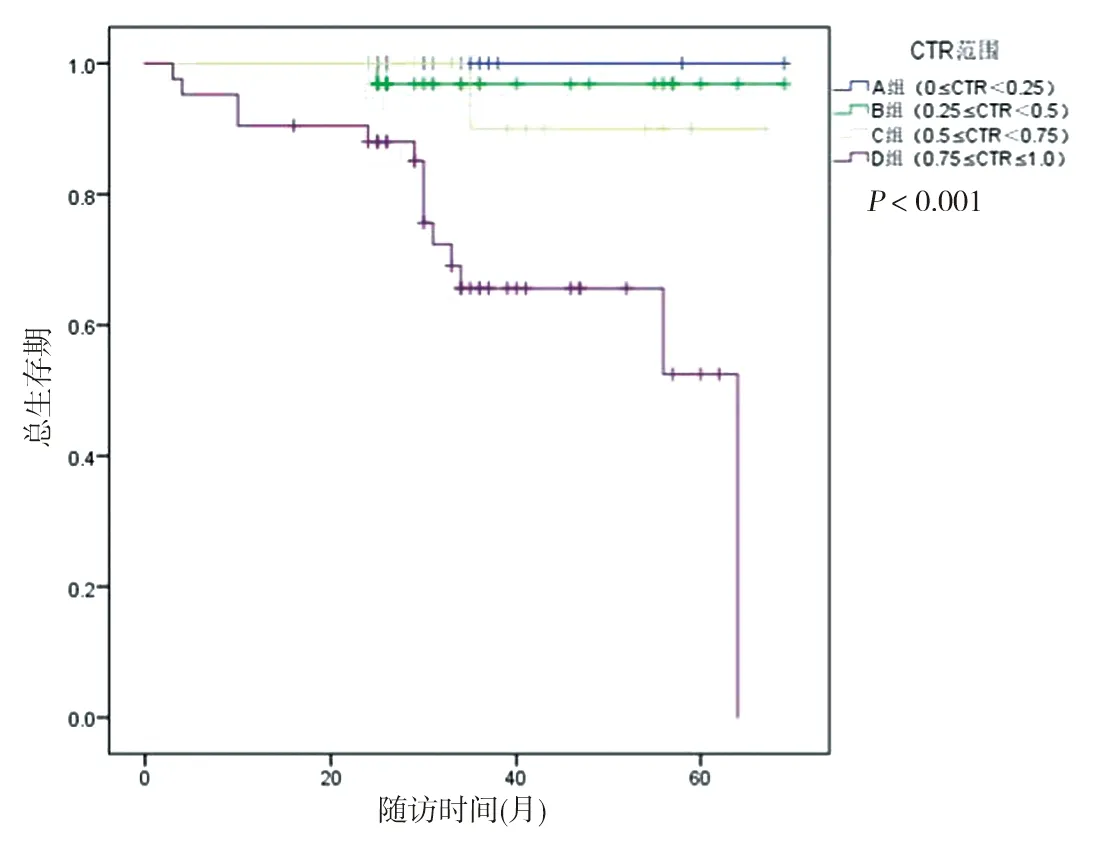
圖3 不同CTR患者的總生存率

圖4 不同CTR患者的無復發生存率

表5 A/B組與C/D組無復發生存率log-rank檢驗

表6 A/B組與C/D組總生存率log-rank檢驗
2.5 CTR的診斷價值 以術后病理結果為金標準,通過繪制CTR、GGO實性成分最大徑、GGO最大徑的影像學指標預測GGO侵襲程度及淋巴結轉移的ROC曲線,見圖5、6。其中CTR對GGO侵襲程度及淋巴結轉移預測的AUC分別為0.841和0.884,對應的最佳截斷值分別為0.603和0.733。CTR的AUC值均為最大,提示CTR對于GGO侵襲程度及淋巴結轉移的預測均有良好的診斷價值。見表7、8。
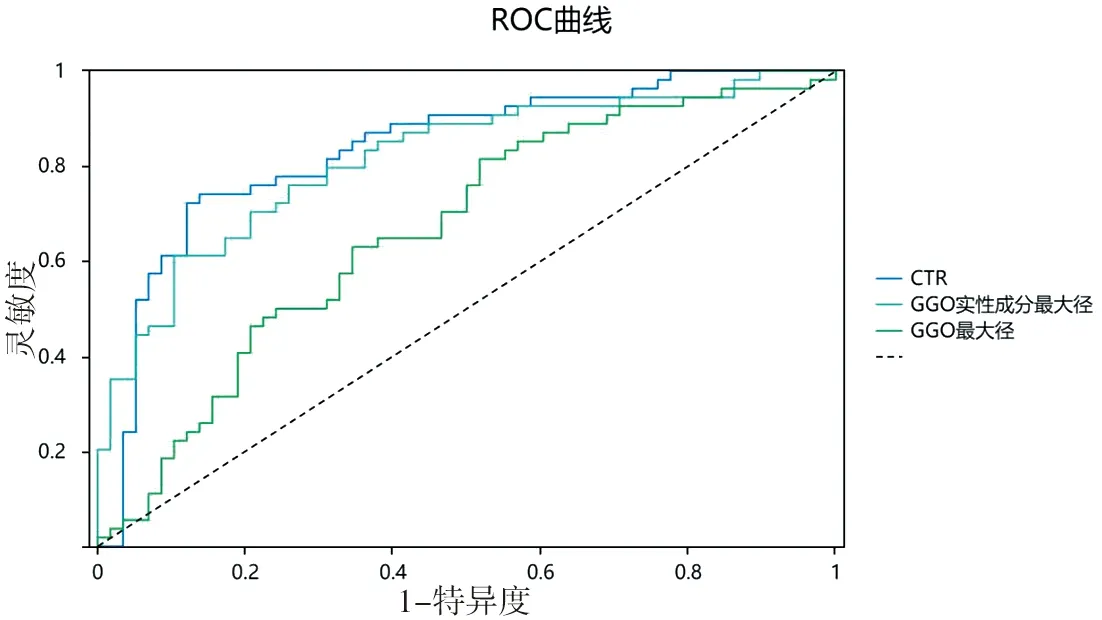
圖5 不同CT參數對GGO良惡性預測的ROC曲線
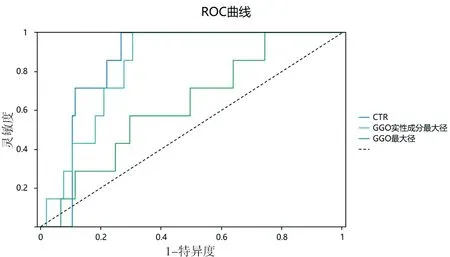
圖6 不同CT參數對GGO淋巴結轉移預測的ROC曲線
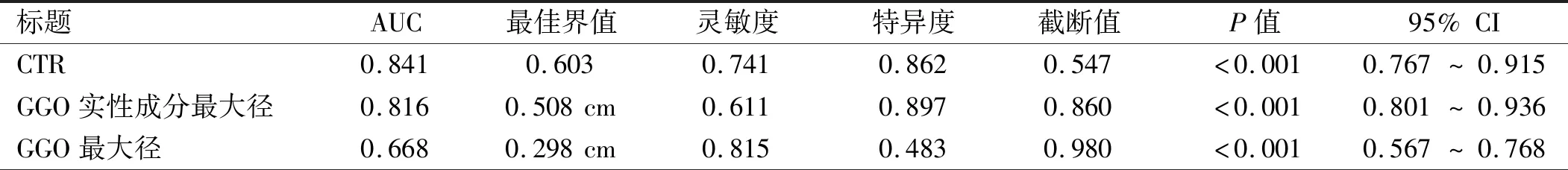
表7 不同CT參數對GGO良惡性預測的ROC曲線AUC匯總
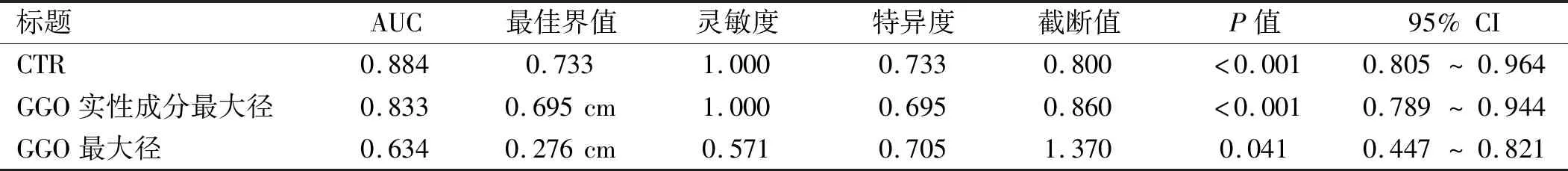
表8 不同CT參數對GGO淋巴結轉移預測的ROC曲線AUC匯總
3 討論
隨著對肺癌高危人群CT篩查的開展,大量的GGO得以被篩查發現。大量的學者及臨床工作者認為,對于實性成分占比高的亞實性GGO及純實性GGO患者應該積極行手術干預[11]。目前針對GGO的管理策略,比較知名的有美國Fleischner學會[12]于2017年推出的肺結節管理指南以及2020年美國國立綜合癌癥網絡(National Comprehensive Cancer Network, NCCN)制定的肺癌篩查指南[13]。然而不同指南對于GGO的干預策略仍存在一些差異。針對CT篩查提示的GGO病變,其術前診斷及手術范圍的確定仍主要依據臨床工作者的經驗判斷。近年來,CT的影像學定量指標在臨床病理診斷中發揮重要作用,這些定量指標對明確GGO的性質有重要參考價值。其中,由于CTR通過量化分析準確反映GGO病變中的實性成分占比,因此被認為與GGO的病理惡性程度具有顯著相關性。本研究發現,CTR的大小于GGO的惡性程度及預后具有密切相關性。
在本項研究中,通過Kaplan-Meier分析,對4組患者的OS及RFS進行統計,并對A/B組與C/D組進行log-rank檢驗,結果提示A/B組與C/D組的OS與RFS存在顯著差異(P<0.05)。通過對GGO患者RFS的單因素及多因素分析,證實CTR與淋巴結轉移為GGO預后的獨立預后因素。淋巴結轉移作為肺癌轉移的一條重要途徑,準確掌握淋巴結有無發生轉移對肺癌的精準治療具有重要意義。在本研究中,淋巴結轉移作為患者預后的獨立影響因素,與術后生存密切相關。張嬌等[14]的研究表明,N分期越高,患者的生存預期越差,生存時間越短。本研究結果與其相似。
根據術后病理浸潤程度,通過對GGO侵襲性的單因素及多因素logistics回歸分析,證實CTR為GGO侵襲程度的獨立危險因素。呂全喜等[15]的研究表明,CTR對早期肺癌的影像學診斷具有良好效果,且與病理學侵襲性具有良好的相關性。結合本研究結果中CTR可以作為預測GGO患者術后生存的獨立影響因素,提示可以將CTR作為一項術前評價指標,從而為臨床工作者的治療方案的精準化制定提供幫助。
通過繪制ROC曲線,證實CTR對GGO的侵襲性及淋巴結轉移的預測效果最佳。其對應最佳截斷值與對應的AUC分別為0.603、0.841與0.733、0.884。根據相關文獻[16-17]報道,當CTR大于0.504時,GGO表現為較強的侵襲性。在本次回顧性分析中,CTR對于判斷GGO侵襲性的最佳截斷值為0.603,這表明當CTR>0.603時,GGO更傾向于惡性病變,此時應做到R0切除。由于肺腺癌的陽性轉移淋巴結在病理學檢查時仍表現為正常大小,術前通過CT掃描明確淋巴結轉移的情況仍然是個難點。在Shao等[8]的一項433例患者的回顧性研究表明,CTR是GGO淋巴結轉移的獨立危險因素,并明確CTR對GGO的淋巴結轉移的臨界值為0.795。這與本次回顧性分析中的最佳截斷值0.733相似。以CTR這一臨床上可視且易獲得的量化指標可以為GGO的手術治療方式的選擇提供參考。雖然有研究表明對GGO行亞肺葉切除具有良好的預后[19],但淋巴結轉移的出現則會導致接受亞肺葉切除的患者無復發生存率降低[20]。因此,對于選擇CTR>0.733的GGO病變的手術方式的,淋巴結清掃是必要的。目前關于CTR與GGO病理類型及術后生存的相關性,特別是關于CTR截斷值選擇問題,國內外研究仍較少。綜上所述,當CTR值大于0.603及0.733時,GGO的侵襲程度及淋巴結轉移顯著增加,此時應選擇合適的外科干預方式。
同時,本研究依然存在一定的局限性。首先,由于本研究為單中心回顧性研究,存在樣本量較小及選擇性偏倚等問題。其次,由于隨訪時間較短,盡管在近期預后,但遠期預后仍有待更深入的研究加以證實。

