IgA、IgM與吉蘭巴雷綜合征患兒預后的相關性
陳 玲,孫素真,張梅杰,唐洪俠,劉 康,岳 玲
(河北省兒童醫院1.神經康復科;2.神經內科,河北 石家莊 050000)
吉蘭巴雷綜合征主要分為急性炎性脫髓鞘性多發性神經根神經病(脫髓鞘型)和急性運動軸索型神經病(軸索型),其癥狀多不典型[1]。臨床中若診斷、治療不及時可能會使吉蘭巴雷綜合征患兒遺留運動障礙,為其自身、家庭及社會帶來沉重的負擔[2]。免疫球蛋白(immunoglobulin,Ig)是機體免疫系統的重要組成成分,血清Ig濃度的增減與血腦屏障的通透性有關[3]。研究表明,神經系統發生感染時,其血液中IgA、IgM等免疫球蛋白含量均有不同程度的變化[4]。吉蘭巴雷綜合征與血清IgA、IgM水平的相關性有待進一步探究,因此,本研究通過探討不同類型吉蘭巴雷綜合征患兒血清IgA、IgM表達水平與其預后的關系,以期為臨床治療方案的選取及不良預后的早期預測提供參考依據。
1研究對象與方法
1.1研究對象
選取2017年6月至2019年8月在河北省兒童醫院就診的60例初次診斷且未經治療的吉蘭巴雷綜合征患兒作為研究對象,根據分類標準將其分為脫髓鞘型組(30例)與軸索型組(30例),其中脫髓鞘型組患兒年齡6~13歲,平均(9.46±3.03)歲,男15例,女15例;軸索型組患兒年齡6~12歲,平均(9.18±2.69)歲,男17例,女13例。選取同期在我院兒童保健科健康體檢的兒童20例作為對照組,年齡6~13歲,平均(9.24±3.12)歲,男12例,女8例。
1.2病例納入排除標準
納入標準:符合吉蘭巴雷綜合征國際診斷及分類標準[5];病例資料齊全者;經本院臨床研究倫理委員會批準,所有研究對象家長均知情同意并自愿參加;未使用神經藥物治療者。排除標準:伴有其他神經疾病者;伴有嚴重心、肝、腎功能不全者;伴有其它血液系統、自身免疫疾病及重度感染者。
查閱門診及住院病歷,收集患兒臨床資料,包括發病年齡、性別、腹瀉、起病方式、面癱、呼吸衰竭等。
1.3治療方法
采集健康兒童體檢時及患兒入院第二天晨起空腹肘靜脈血樣,3 000r/min離心15min后收集血清,置于-80℃保存待測。
1.3.1血清IgA、IgM測定
采用AU5800全自動生化分析儀,借助免疫散射比濁法檢測血清IgA、IgM水平,操作步驟嚴格按照儀器使用說明書進行。血清IgA、IgM的正常參考值范圍,IgA:0.7~4.0g/L;IgM:0.4~2.3g/L。檢測值在正常值范圍內為陰性,反之則為陽性。
1.3.2隨訪
吉蘭巴雷綜合征患兒出院6個月內以電話等方式隨訪,收集患兒臨床恢復狀況,其中臨床緩慢恢復(即預后不良)指患兒6個月時仍不能獨立行走(Hughes運動功能評級≥3級);臨床快速恢復(即預后良好)指患兒癥狀在1個月內改善(Hughes運動功能評級≥2級)[6]。Hughes運動功能評級共6級,6級:死亡;5級:需輔助通氣治療;4級:只能在座椅上活動或躺在床上;3級:借助助行器或拐杖可行走5m;2級:可獨立行走5m;1級:輕微癥狀和體征,可跑動;0級:肢體運動正常[7]。最終預后不良患兒17例,其中脫髓鞘型6例,軸索型11例。
1.4統計學方法

2結果
2.1脫髓鞘型組與軸索型組患兒臨床特征比較
脫髓鞘型組與軸索型組患兒性別、發病年齡、起病方式及呼吸道感染、腹瀉、面癱、呼吸衰竭比例比較,差異均無統計學意義(P>0.05),見表1。
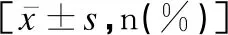
表1 脫髓鞘型組與軸索型組患兒臨床特征比較
2.2脫髓鞘型組、軸索型組及對照組血清IgA、IgM陽性率比較
軸索型組血清IgA、IgM陽性率均高于對照組(χ2值分別為23.558、10.526),脫髓鞘型組血清IgA陽性率高于對照組(χ2=9.780),脫髓鞘型組血清IgA、IgM陽性率均低于軸索型組(χ2值分別為4.800、5.455),差異均有統計學意義(P<0.05),見表2。
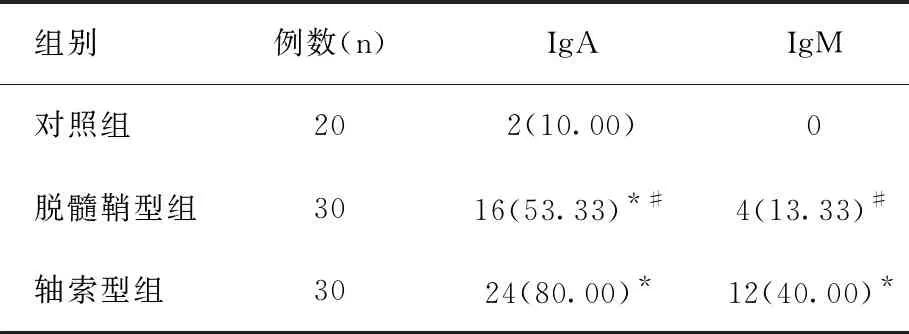
表2 脫髓鞘型組、軸索型組及對照組血清IgA、IgM陽性率比較[n(%)]
2.3脫髓鞘型組血清IgA、IgM水平與患兒預后的相關性
血清IgA、IgM水平與脫髓鞘型吉蘭巴雷綜合征患兒預后有關(rs值分別為0.468、0.539,P<0.05),見表3、表4。

表3 脫髓鞘型組血清IgA水平與患兒預后的相關性[n(%)]
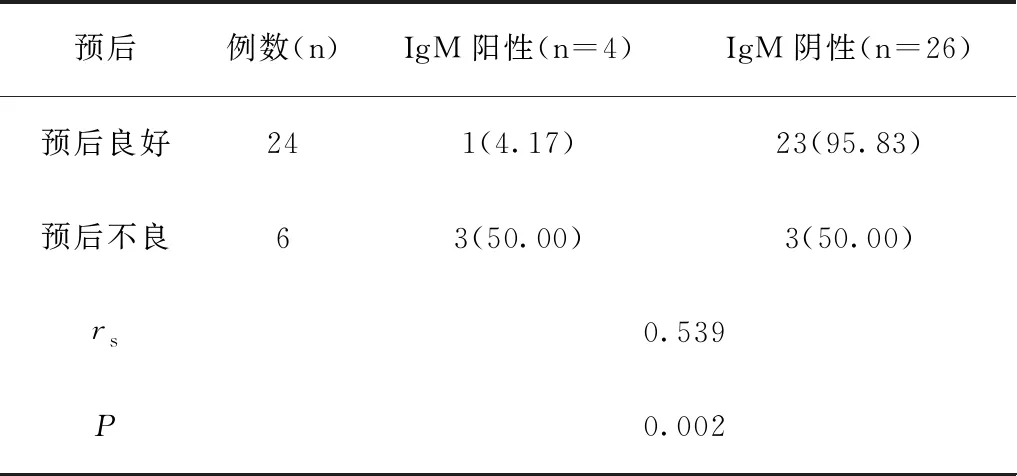
表4 脫髓鞘型組血清IgM水平與患兒預后的相關性[n(%)]
2.4軸索型組血清IgA、IgM水平與患兒預后的相關性
血清IgA、IgM水平與軸索型吉蘭巴雷綜合征患兒預后有關(rs值分別為0.380、0.791,P<0.05),且預后不良的軸索型吉蘭巴雷綜合征患兒中IgA、IgM陽性比例較高,見表5、表6。

表6 軸索型組血清IgM水平與患兒預后的相關性[n(%)]
2.5影響吉蘭巴雷綜合征患兒預后的多因素Logistic回歸分析
將吉蘭巴雷綜合征患兒是否發生不良預后作為因變量,以脫髓鞘型、軸索型、IgA陽性、IgM陽性為自變量進行Logistic回歸分析,結果顯示軸索型、IgA陽性、IgM陽性是影響吉蘭巴雷綜合征患兒發生不良預后的獨立危險因素(P<0.05),見表7。
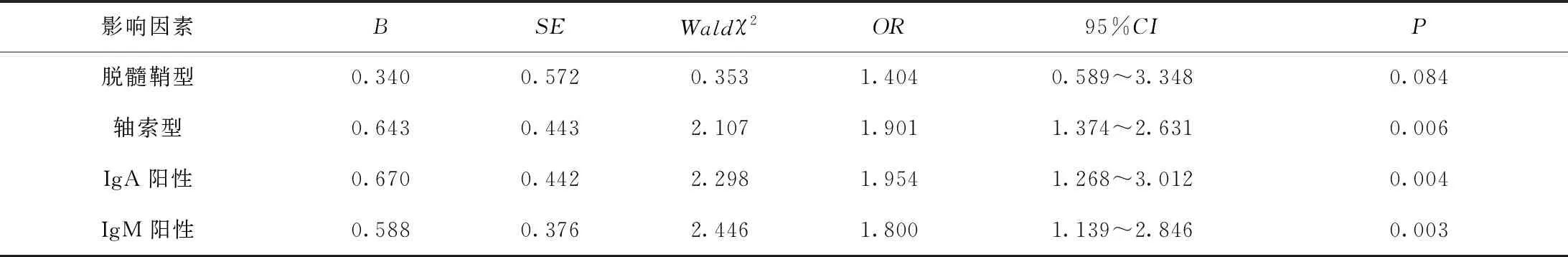
表7 影響吉蘭巴雷綜合征患兒預后的多因素Logistic回歸分析
3討論
3.1概述
吉蘭巴雷綜合征是一種免疫介導的自身免疫性疾病,其發病機制尚不十分明確[8]。吉蘭巴雷綜合征的主要病理特點是周圍神經組織炎性細胞浸潤,患者周圍神經會出現不同程度的脫髓鞘和軸索變性[9]。吉蘭巴雷綜合征是一種危及生命的疾病,患者常見死因有肺部感染、心臟猝死、呼吸衰竭、自主神經功能障礙[10]。因此,探究與吉蘭巴雷綜合征有關的生物學及臨床預測指標,可能對個體化治療方案和護理方案的選取及改善預后有重要意義。
3.2 IgA、IgM與吉蘭巴雷綜合征的關系
Ig是免疫細胞受到抗原物質刺激后產生的一種重要免疫分子,不僅有良好的抗體活性,而且能通過與抗體結合發揮細胞免疫效應,激活體液免疫應答[11]。正常機體內IgA、IgM等免疫球蛋白水平較低,一旦機體遭受感染,其水平明顯升高[12]。吉蘭巴雷綜合征的觸發因素一般為病原體感染后的異常免疫反應,因此推測IgA、IgM等免疫球蛋白可能參與了吉蘭巴雷綜合征的發病過程。本研究結果顯示,軸索型患兒血清IgA、IgM陽性率均高于健康兒童,脫髓鞘型患兒血清IgA陽性率高于健康兒童,脫髓鞘型患兒血清IgA、IgM陽性率均低于軸索型患兒(P<0.05)。劉樂等[13]研究結果顯示,中樞神經系統感染后患者腦脊液IgA、IgM水平明顯升高,與本研究結果中患兒血清IgA、IgM表達趨勢一致。方春艷等[14]研究結果中顱內感染患兒血清及腦脊液IgA、IgM水平升高,且細菌感染患兒IgA、IgM水平高于病毒感染患兒。Sudo等[15]的研究結果顯示,IgA、IgM可用于神經病變患者的免疫治療。據此,本研究推測吉蘭巴雷綜合征患兒發生病原體感染后,在病理狀態下其血清IgA、IgM合成量升高,進而清除病原體;或通過血腦屏障,嵌入受損部位的神經細胞膜上,保護神經細胞膜上ATP酶的活性(Ca2+-ATP酶、Na+-K+-ATP酶),進而調節離子失衡、髓鞘再生和軸突生長,減輕神經細胞的損害,最終參與神經重塑。而本研究中脫髓鞘型患兒血清IgM陽性率與健康兒童比較無明顯差異,可能與脫髓鞘型吉蘭巴雷綜合征患兒樞神經系統病變及血腦屏障受損相對較輕有關。張惠雅等[16]研究結果顯示,IgM水平是原發性IgA腎病預后不良的獨立危險因素。而本研究結果中血清IgA、IgM水平與脫髓鞘型及軸索型吉蘭巴雷綜合征患兒預后均有關,且軸索型、IgA陽性、IgM陽性是影響吉蘭巴雷綜合征患兒發生不良預后的獨立危險因素。提示IgA、IgM可能參與了吉蘭巴雷綜合征的發病過程,并對其預后有一定的預測價值,IgA、IgM可作為預測預后不良的輔助指標。進一步提示臨床中應重視IgA陽性、IgM陽性及軸索型的吉蘭巴雷綜合征患兒,為其制定個體化的治療和護理方案,幫助患兒及家長評估未來病程,改善預后。
3.3小結
綜上所述,IgA陽性、IgM陽性可能對脫髓鞘型及軸索型吉蘭巴雷綜合征患兒預后不良有重要的預測價值。臨床上應密切監測吉蘭巴雷綜合征患兒血清IgA、IgM水平的變化,同時對軸索型患兒予以高度重視,及時制定合理、有效的治療措施,以降低不良預后的發生率。但血清IgA、IgM在脫髓鞘型及軸索型吉蘭巴雷綜合征患兒預后中的實際臨床應用價值,還需加大樣本量進一步驗證,且IgA、IgM影響患兒病情進展的具體作用機制也需進一步深入探索。

