腦卒中后運動功能障礙與連接半球間同位腦區的胼胝體結構損傷相關
郭苗,徐國軍,余秋蓉,王鶴瑋,尹大志,孫莉敏,寧瑞鵬,劉凡,范明霞*
單側皮質下病變導致腦卒中出現對側肢體偏癱,尤其是上肢及手的運動功能障礙會嚴重影響患者的生活自理水平[1]。越來越多的研究證實單側皮質下腦卒中運動功能的恢復與受損半球功能活動的正常化和跨半球活動的重新平衡有關[2-3]。因此,了解腦卒中偏癱患者半球間功能和結構變化與臨床運動行為學改變的關系,將有助于更深入理解腦卒中半球間失衡的作用機理,以期更好地指導臨床中康復治療工作。
神經影像學早期研究發現,左右大腦半球相同起源的神經元具有極其穩定的自發活動同步性[4]。Stark等[5]在大腦中選取112 個區域(左右對稱,各56個),證實了雙側大腦半球間同位區域功能連接較其他連接模式(雙側半球間異位腦區、健側半球內及患側半球內)連接強度更大。本課題組曾采用體素鏡像同倫功能連接(voxel-mirrored homotopic connectivity,VMHC)研究初步發現,單側皮質下腦卒中在全腦水平上存在著廣泛的同位腦區功能連接降低,涉及雙側感覺運動區、前額葉、顳葉、頂葉、小腦等區域[6]。有研究也揭示腦卒中偏癱患者的感覺運動網絡內的同位腦區功能連接與上肢運動功能最為相關[3,7]。近期有研究進一步發現,腦卒中患者雙側初級運動皮質(primary motor cortex,M1)的功能連接和其經胼胝體的M1-M1 神經纖維束的微結構變化均與上肢運動功能障礙的嚴重程度有關[8-9]。運動功能恢復良好的腦卒中患者的病灶側M1 至病灶對側M1 的有效功能連接也依賴于雙側M1 潛在解剖結構連接的完整性[10]。不過,現有研究只關注了某一腦區(例如M1)經胼胝體神經纖維束微結構的改變。對于其他更多半球間同位腦區的功能活動是否受到與其對應相連的經胼胝體纖維束微結構損傷的影響,及其與運動行為學功能損傷的關系均不清楚。
神經科學研究認為,腦結構是功能連接的基礎,尤其是當存在結構連接時,結構完整性與功能連接的強度具有高度一致性[11]。腦卒中后半球間功能連接所對應的結構基礎會發生什么變化?這是本研究感興趣并想要回答的問題。本研究嘗試基于高分辨經胼胝體纖維束模板(trancallosal tract template,TCATT),對比分析一組單側皮質下腦卒中和健康對照組的半球間連通大腦皮質多個同位腦區的經胼胝體纖維束微結構改變。本研究推測:(1)與腦卒中導致半球間多個同位腦區功能連接異常相似,該組患者多個同位皮質腦區經胼胝體纖維束微結構連接可能也會出現普遍異常改變;(2)皮質下腦卒中患者的胼胝體異常改變可能源于運動通路上皮質脊髓束損傷所導致的繼發性變性損傷;(3)除了雙側M1 經胼胝體的解剖連接微結構變化與運動行為學表現具有相關性之外,其他同位腦區可能也具有類似關系。本研究擬揭示單側卒中病變導致半球間同位腦區功能連接失衡的結構基礎變化及其與運動功能障礙的關系,將有助于更加全面理解腦卒中偏癱患者半球間結構變化在腦重塑的全局整合效應中的作用。
1 材料與方法
1.1 受試者信息
本研究為一項前瞻性、探索性的橫斷面觀察研究。卒中組招募于2020 年7 月至2022 年1 月間在復旦大學附屬華山醫院康復科治療的皮質下腦卒中患者。納入標準:(1)首次發病皮質下單側腦梗死或腦出血,病灶主要位于內囊或基底節區;(2)發病時間≥3 個月;(3)存在上肢或手功能運動障礙;(4)所有患者無明顯認知功能障礙,所有患者認知功能量表評測均≥27 分;(5)年齡在35~70 歲之間;(6)愛丁堡利手問卷確認為右利手。排除標準:(1) MRI 掃描禁忌證或幽閉恐懼癥;(2)意識不清、癲癇、失語;(3)酒精、藥物濫用或神經精神病史等;(4)參與任何實驗性康復或藥物研究。另外,篩選入組43 名年齡相匹配的右利手健康受試者。納入標準包括:(1)年齡在40~70 歲之間;(2)頭顱常規MRI 掃描未見異常病灶;(3)無明顯認知功能障礙。排除標準同卒中組。
本實驗研究經過復旦大學附屬華山醫院和華東師范大學倫理委員會批準(批準文號:HR 393-2020),所有受試者在入組本課題研究時以及做磁共振掃描前均已簽署知情同意書。華山醫院康復醫學科的一名醫生在MRI 掃描當天評定腦卒中患者上肢運動功能評分(Fugl-Meyer Assessment of Upper Extremity,FM-UE)。Fugl-Meyer 評估表是腦卒中臨床和科研療效評判中應用最為廣泛的運動學評估方法。其中上肢運動包含33 個評估項目,上肢運動功能評分總分為66 分,各單項評分全部完成為2 分,部分完成為1 分,不能完成為0 分。醫生根據受試者最后的評分對其運動障礙嚴重程度進行評定[12]。
1.2 磁共振數據采集
本研究中磁共振數據采集于上海市磁共振重點實驗室(華東師范大學)的西門子Trio 3.0 T 磁共振成像掃描儀。數據采集前為受試者戴上一次性防噪聲耳塞。為了固定頭部并減少頭動,用海綿墊固定受試者頭部,同時告知受試者在影像數據采集過程中,盡量身體放松并保持頭部靜止不動。
所采集的磁共振數據包括:高分辨T1WI結構像,常規T2WI結構像,彌散張量成像。具體掃描序列和參數如下:(1) T1WI采用快速梯度回波序列,進行矢狀位三維成像,TR 2530 ms,TE 2.34 ms,FOV 240 mm×240 mm,采集層數192 層,層厚1 mm,層間距0.5 mm,翻轉角7°,采集矩陣256×256。(2) T2WI采用快速自旋回波序列進行橫斷位成像,TR 6000 ms,TE 93 ms,FOV 220 mm×220 mm,采集層數30 層,層厚5 mm,無層間距,采集矩陣320×320。(3) DTI采用單激發平面回波序列進行橫斷位成像,TR 6100 ms,TE 110 ms,FOV 256 mm×256 mm,采集層數40 層,層厚3 mm,無層間距,翻轉角90°,采集矩陣128×128,累加次數average=2,彌散梯度方向30 個,b 為1000 s/mm2,采用并行采集技術(2倍)加快成像速度。
1.3 數據處理
1.3.1 數據預處理
本研究使用FSL (http://fsl.fmrib.ox.ac.uk/fsl)和PANDA (http://www.nitrc.org/projects/panda)軟件包進行DTI數據的處理。預處理流程包括:(1)數據格式轉換,檢查圖像質量;(2)渦流和頭動校正圖像,BET工具去除非腦組織;(3)利用dtifit工具擬合計算彌散指標各向異性分數(fractional anisotropy,FA)值;(4)之后使用flirt 線性配準工具將FA 圖像經3D-T1WI 圖像配準至MNI (Montreal Neurological Institute)標準空間,并使用6 mm半高全寬的高斯核對圖像進行空間平滑。
FA 值反映白質神經纖維束的完整性,介于0~1之間,FA值越大表明白質纖維束完整和神經傳導暢通,如果出現軸突和髓鞘損傷,則FA值下降[13]。
1.3.2 32 對經胼胝體的同位皮質腦區的解剖連接微結構計算
為了識別經胼胝體的同位皮質腦區的解剖連接微結構,本研究采用了以往研究提出的TCATT 進行后續分析,TCATT 選自人類連接組計劃(http://www.humanconnectomeproject.org)中100 名健康受試者的高分辨率的擴散光譜成像數據,從自動解剖標記分區中確定左右半球32 對同位腦區,對左右半球間經胼胝體白質通路進行概率性纖維束追蹤,共得到32 對同位通路[14]。這32 條通路包含的同位腦區有:感覺運動區(初級運動皮質、背側運動前區、腹側運動前區、初級感覺運動區、輔助運動區、輔助運動前區),前額葉(額下回三角部、額下回蓋部、額下回眶部、額中回、額上回、外側眶回、內側額回、嗅皮層、內側眶前回、眶前回、直回、內側眶回),頂葉(緣上回、頂下小葉、角回、頂上小葉、中央旁小葉),顳葉(顳上回、顳中回、顳下回)和枕葉(楔葉、枕上回、枕中回、距狀裂、舌回、枕下回)。首先,將該模板包含同位腦區的32 條神經纖維束配準到MNI 空間模板;隨后,沿MNI 模板的軸向方向以長和寬都為8 mm 的平行平面識別出胼胝體,并制作成二值化模板(CCmask);接著,由CCmask 獲取32 個位于胼胝體上中矢狀面區域的感興趣區(region of interest,ROI);最后將這32 個ROI 配準到每個受試者的FA 值圖像上,提取胼胝體纖維中矢狀面區域相應位置的FA 值。以M1 為例,圖1 展示雙側M1 經胼胝體神經束的中矢狀面區域。
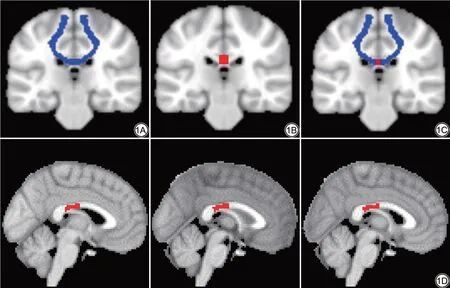
圖1 雙側M1 經胼胝體神經束的中矢狀面區域。1A:MNI 空間模板中雙側M1 經胼胝體的纖維束;1B:沿MNI 模板軸向方向的平面制作出胼胝體二值化模板(CCmask);1C:雙側M1 經胼胝體的纖維束與CCmask 進行重疊;1D:雙側M1經胼胝體纖維束在胼胝體中矢狀面區域的感興趣區。Fig. 1 The middle sagittal area of bilateral M1 through the corpus callosum. 1A: The fiber of corpus callosum connecting bilateral M1 in MNI space; 1B: The corpus callosum binarization template (CCmask) is made along the plane in the axial direction of MNI template; 1C: The fiber connecting bilateral M1 overlapped with CCmask; 1D: Region of interest(ROI) of bilateral M1 transcallosal fibers in the midsagittal region of the corpus callosum.
1.3.3 CST結構損傷指標計算
基于約翰·霍普金斯大學白質纖維束圖譜確定雙側CST,計算CST 的FA。FA 比率(FA ratio,rFA)為病灶側FA與病灶對側FA之間的比值(rFA=FAipsilesional/FAcontralesional)。應用rFA對雙側CST微結構改變和損傷程度情況進行定量評價,rFA越低,表明病灶同側CST各向異性分數降低越明顯,即CST 完整性損傷越嚴重[15]。腦卒中患者組中位于左側和右側病灶的人數分別為19 例和15 例,為了避免大腦半球不對稱造成的差異,按照與卒中組中左/右側病灶相同的比例,隨機選擇24 名健康受試者的大腦左側對應病人的病灶側,大腦右側對應病人的病灶對側;另19 名相反,右側對應病人的病灶側,左側對應病人的病灶對側。
1.3.4 統計學分析
采用SPSS 22.0 統計軟件進行分析。計量資料采用(±s)表示,組間比較采用雙樣本t檢驗,計數資料采用卡方檢驗。組間差異檢驗采用雙樣本t檢驗,檢驗對象為卒中組與健康對照組之間CST 的rFA 值,以及兩組間同位腦區經胼胝體神經纖維束的FA 值,以P<0.05 (FDR 校正)為差異具有統計學意義。年齡、性別和卒中后病程作為協變量,利用Pearson 偏相關性分析同位腦區的32條經胼胝體神經纖維束的微結構損傷指標FA 值與FM-UE 的相關性,rFA (CST)與FM-UE 的相關性,以及rFA (CST)與同位腦區經胼胝體的神經纖維束的FA 值的相關性,統計閾值P<0.05表示存在相關性。
2 結果
2.1 人口學信息分析
根據數據納入標準,共納入77 例受試者,其中,卒中組34 例[男27 例,年齡(52.6±10.2)歲],健康對照組43 例[男21 例,年齡(56.0±9.6)歲]。兩組在年齡上差異無統計學意義(t=1.599,P=0.114),性別上差異有統計學意義(χ2=2.928,P=0.005),由于健康對照組與卒中組的性別不完全匹配,在隨后的統計分析中將性別視為協變量。卒中組病程大于3 個月[(11.9±7.9)個月]。腦卒中患者組中病灶主要位置在皮質下的基底節、放射冠和丘腦,位于左側和右側病灶的人數分別為19例和15例。上肢運動FM-UE總分為66分,評分越高代表上肢運動功能越好,而卒中組FM-UE 為(16.6±11)分,均小于39 分,上肢運動功能障礙屬于中重度水平[16]。卒中組的臨床資料信息詳見表1。
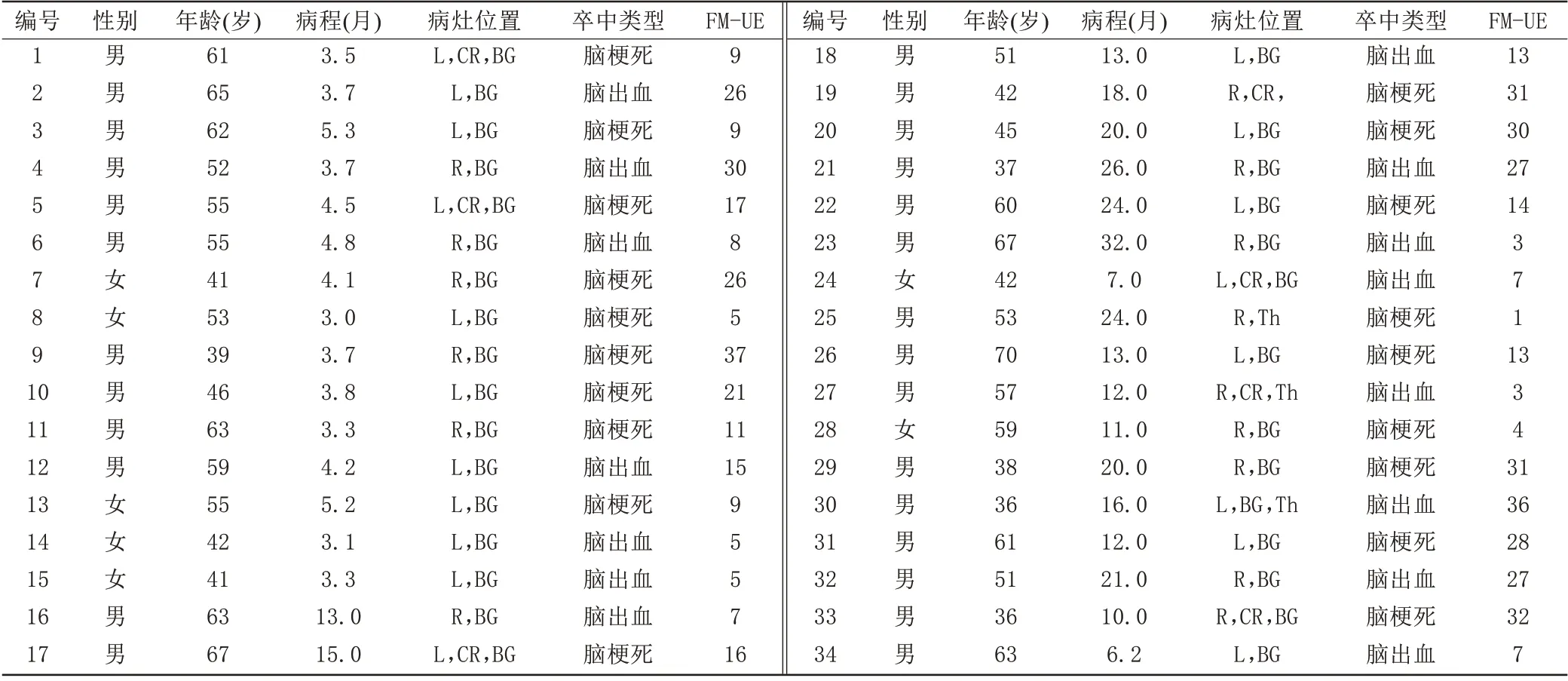
表1 卒中組的臨床資料信息Tab.1 Clinical prop?erties of the stroke patients
2.2 經胼胝體纖維束和CST 的結構完整性的組間比較
與健康對照組相比,卒中組半球間同位腦區的32條經胼胝體神經纖維束在中矢狀面區域的FA值均有不同程度的降低,差異有統計學意義的有29 條(P<0.05,FDR 校正)。其中,6 條屬于感覺運動區(初級運動皮質、背側運動前區、腹側運動前區、初級感覺運動區、輔助運動區、輔助運動前區),10 條屬于前額葉(額下回三角部、額下回蓋部、額下回眶部、額中回、額上回、外側眶回、內側額回、嗅皮層、內側眶前回、眶前回),4 條屬于頂葉(緣上回、頂下小葉、角回、頂上小葉),3 條屬于顳葉(顳上回、顳中回、顳下回)以及枕葉的6條(楔葉、枕上回、枕中回、距狀裂、舌回、枕下回)。而差異不顯著的3 條屬于內側眶回、中央旁小葉和直回的纖維束(P>0.05,FDR 校正),如表2 和圖2所示。與健康對照組比較,腦卒中患者組病灶側CST的FA值和rFA (CST)顯著降低(分別為t=-12.461,P<0.001;t=-10.855,P<0.001)。病灶對側CST的FA值在兩組之間差異無統計學意義(P>0.05),詳見表3。
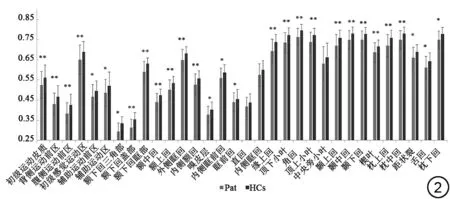
圖2 卒中組(Pat)與正常對照組(HCs)的32 對同位腦區經胼胝體神經纖維束在中矢狀面區域FA 值的組間比較。經過FDR 校正(**:閾值為P<0.01;*:閾值為P<0.05),其中差異有統計學意義的有連接29對同位腦區的纖維束,包括感覺運動皮質(初級運動皮質、背側運動前區、腹側運動前區、初級感覺運動區、輔助運動前區、輔助運動區),前額葉(額下回三角部、額下回蓋部、額下回眶部、額中回、額上回、外側眶回、內側額回、嗅皮層、內側眶前回、眶前回),頂葉(緣上回、頂下小葉、角回、頂上小葉),顳葉(顳上回、顳中回、顳下回),枕葉(楔葉、枕上回、枕中回、距狀裂、舌回、枕下回)。連接3 對同位腦區的經胼胝體纖維束差異無統計學意義,包括直回、內側眶回、中央旁小葉。Fig.2 Comparison of FA values of 32 transcallosal tracts in the midsagittal plane between stroke group and healthy control group.After FDR correction(**: threshold of P<0.01, *: threshold of P<0.05). Significant differences were found in the fibers connecting 29 pairs of homogeneous brain regions,including sensorimotor area (M1, PMd, PMv, S1, preSMA, SMA),prefrontal lobe (IFG. triangularis, IFG. opercularis, IFG. orbitalis, middle frontal, superior frontal, lateral orbital, medial orbitofrontal, anterior orbital), parietal lobe (supramarginal gyrus, inferior parietal, angular,superior parietal), temporal lobe (superior temporal, middle temporal,inferior temporal), occipital lobe (cuneus, superior occipital, middle occipital, calcarine, lingual, inferior occipital); the other three transcallosal tracts connecting bilateral homogeneous areas showed no significant differences,including gyrus rectus,medical orbital,paracentral lobule.
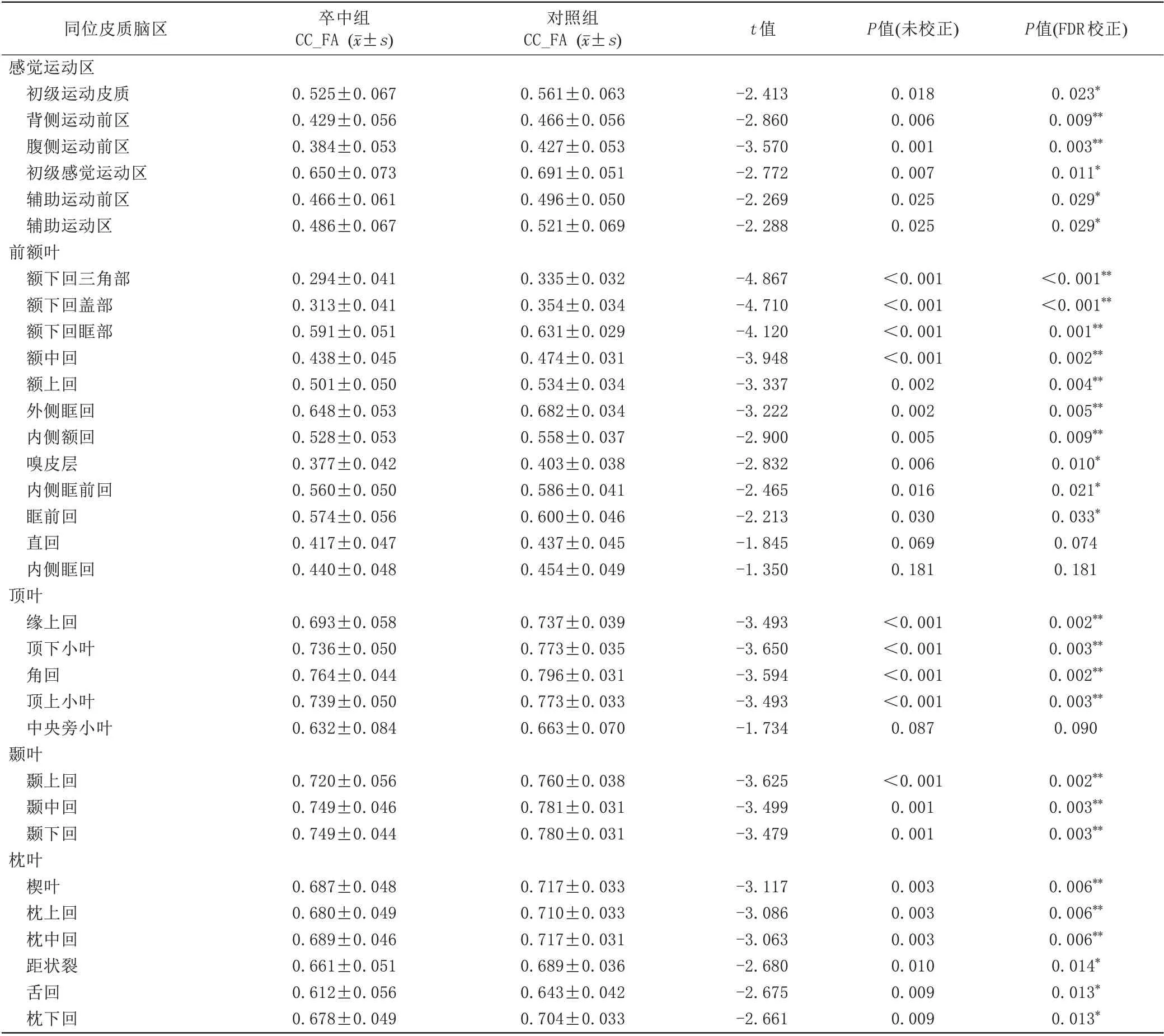
表2 同位腦區經胼胝體神經纖維束在中矢狀面區域FA值的組間比較Tab.2 Comparison of FA values in the midsagittal slice of trancallosal tracts in homologous cortical brain regions between the Pat and HCs

表3 卒中組和健康對照組CST的rFA比較Tab.3 Comparison of ratio FA of CST between Pat and HCs
2.3 腦卒中組經胼胝體纖維束和CST 的結構完整性與運動學評分的關系
以性別、病程和rFA (CST)為協變量,對組間差異有統計學意義的29對同位腦區的經胼胝體神經纖維束在中矢狀面區域的FA 值與上肢FMA 評分做偏相關性分析,研究發現9對同位腦區的纖維束通路與上肢運動功能評分均呈正相關(P<0.05),詳見表4。此外,腦卒中組rFA (CST)與上肢FMA 評分呈顯著正相關(r=0.596,P=0.0004)。
2.4 同位腦區經胼胝體纖維束結構完整性與rFA(CST)的相關性
控制協變量性別和病程,利用Pearson偏相關性分析發現,卒中組這29條經胼胝體神經纖維束在中矢狀面區域的FA值與rFA (CST)均存在正相關(P<0.05),詳見表4。健康對照組中未發現此相關性(P>0.05)。
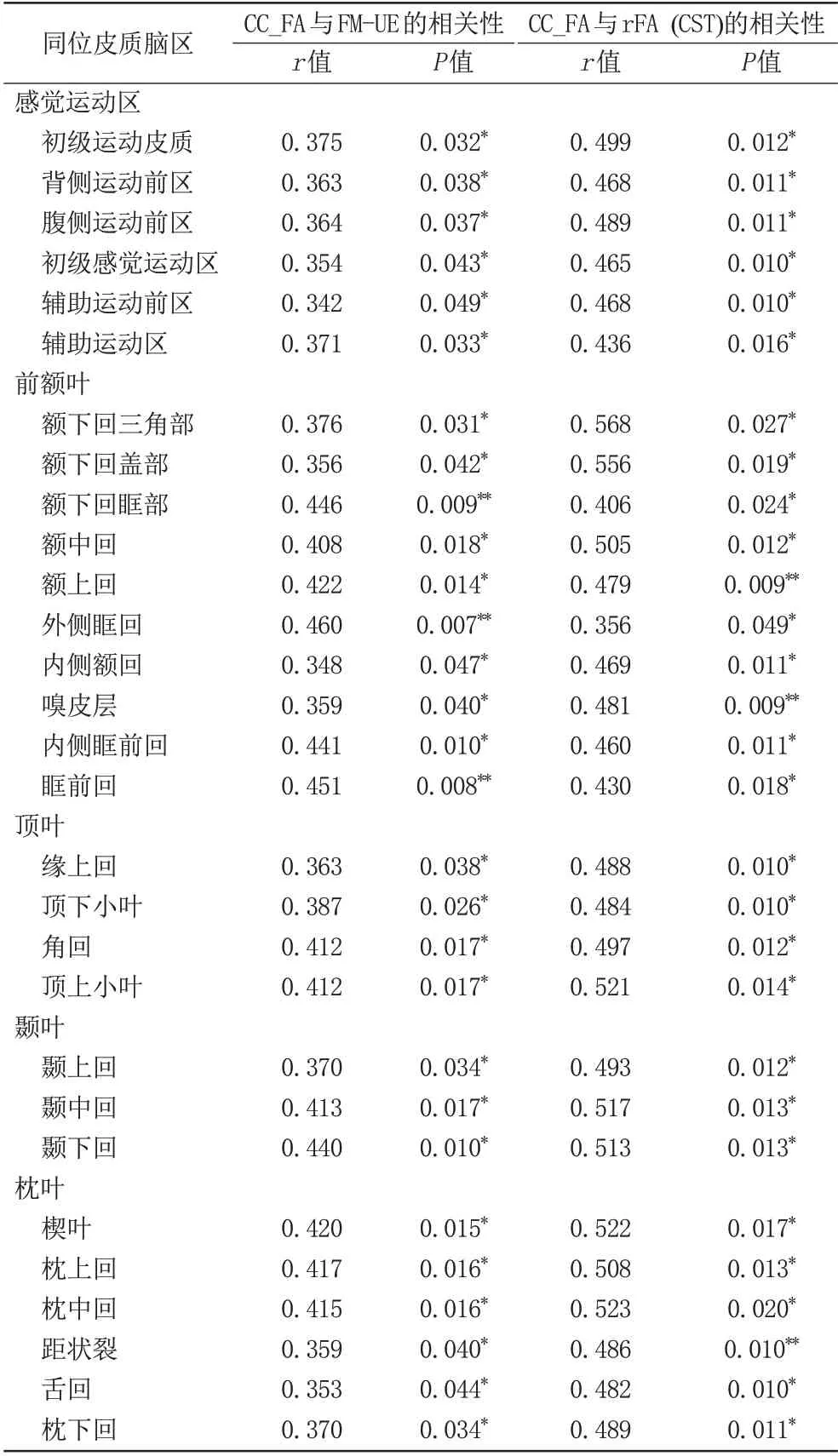
表4 同位腦區經胼胝體神經纖維束在中矢狀面區域FA值與上肢FMA評分、rFA(CST)的相關性Tab.4 Correlation between FA values in the midsagittal slice of trancallosal tract in homologous cortical brain regions and FM-UE,rFA(CST)
3 討論
本研究利用TCATT 探究了單側皮質下腦卒中的半球間同位腦區經胼胝體纖維束微結構受損與病灶同側CST 損傷以及上肢運動功能障礙的關系。研究結果發現,與健康對照組比較,卒中組經胼胝體通向雙側同位腦區(包括感覺運動區、前額葉、頂葉、顳葉和枕葉)的29 條神經纖維束在中矢狀面區域的FA 值顯著下降,并與rFA (CST)及上肢運動功能評分均存在顯著正相關。本研究結果揭示了半球間同位腦區的經胼胝體神經纖維束微結構連接廣泛受損與病灶同側CST損傷密切相關,同位腦區的經胼胝體纖維束結構的完整性或許可作為評估單側皮質下腦卒中上肢運動功能障礙嚴重程度的參考指標。
3.1 利用TCATT 分析腦卒中半球間同位腦區結構連接變化
由于技術限制,以往對經胼胝體纖維束成像往往只能對胼胝體通向大腦整體腦葉進行纖維追蹤成像,即把通向眶部、額葉、頂葉、枕葉和顳葉的經胼胝體纖維束劃分為5至8個相應通道[17]。目前Archer等[14]利用更高分辨率的DTI圖像、更大規模的人腦計劃大隊列數據和更先進的后處理算法,建成通向大腦半球間同位腦區的32 條精細高分辨經胼胝體纖維束模板。TCATT 創建的初衷是研究與胼胝體相關的神經變性型疾病,但也為研究其他神經和精神疾病的胼胝體精細微結構異常奠定了方法學基礎。
本研究率先將TCATT模板應用于腦卒中的研究,探究單側皮質下卒中病變導致半球間同位腦區的結構連接變化及其與運動功能障礙的關系。靜息態功能磁共振成像研究證實正常健康人的絕大多數腦功能網絡表現為雙側對稱[3,5,7]。采用VMHC研究發現,腦卒中后在全腦水平上存在著廣泛的同位腦區功能連接降低,且軀體感覺運動網絡的同位腦區功能連接與上肢運動功能障礙密切相關[3,6,8]。實際上,基于全腦和ROI水平的功能連接分析均發現,除了感覺運動網絡是易遭受卒中病變攻擊損傷的核心網絡以外,腦卒中偏癱患者的非感覺運動腦區(例如額葉、頂葉和顳葉)的異常功能活動也很常見[18-19]。然而同位腦區功能連接異常的結構基礎和微結構損傷與運動功能損傷的關系尚不清楚。運用針對感覺運動區的經胼胝體纖維束高分辨率模板能夠以感覺運動區的半球間對稱性亞區(包括雙側M1、PMd、PMv、S1、SMA 和preSMA)為ROI 進行概率性纖維束追蹤[20-21],可以獲得連接雙側感覺運動區的經胼胝體結構,但對于經胼胝體通往其他非感覺運動同位腦區纖維束的微結構變化知之尚少,尤其是額葉、頂葉和顳葉等同位腦區進行更為精細分區的情況。因此,利用經胼胝體通往大腦半球間所有同位腦區的32 條纖維束精細模板,將有助于全面弄清楚腦卒中導致的相關同位腦區功能活動異常所對應的結構變化及其與運動損傷之間的關系。
3.2 單側皮質下腦卒中半球間同位腦區結構連接變化與臨床運動功能障礙的關系
本研究采用TCATT分析發現,患者組半球間感覺運動腦區的經胼胝體纖維束的FA 值均顯著下降,且與CST 損傷嚴重程度均存在正相關。與以往研究一致,該研究結果進一步證實其經胼胝體神經纖維束微結構連接受損與病灶同側CST 繼發性損傷有關[15,19,22]。本課題組成員曾采用其他白質微結構分析方法研究類似皮質下腦卒中,結果顯示受累的CST的微結構損傷不僅局限在卒中病灶附近,其繼發的順行性和逆行性神經變性會累及CST全程,原發灶上方(逆行性)很多通往大腦皮質的白質通路的FA 值均顯著降低,涉及病灶同側額內側回、中央前回、顳上回、輔助運動區和對側中央后回[13,23-24]。正如研究預期,本組患者的其他同位皮質腦區(前額葉、頂葉、顳葉和枕葉)經胼胝體纖維束微結構連接也出現了普遍異常改變。皮質下腦卒中可導致白質纖維束軸索損傷和髓鞘降解,以往研究揭示內囊或基底節區卒中后兩類神經纖維束存在逆行性病變:一類是從感覺運動皮質下行到脊髓的皮質脊髓束;另一類是源于丘腦核團形成的5個并行的基底節-丘腦-皮質回路,每個回路涉及到特定的大腦皮質,包括運動皮質、軀體感覺皮質、輔助運動區、扣帶運動區和顳上回[24-25]。跨突觸軸突變性理論認為,皮質下卒中皮質脊髓束損傷對相鄰的纖維束產生神經元跨突觸效應,腦卒中導致的突觸丟失可導致相關神經纖維相連接的皮質發生神經元凋零和萎縮,神經影像學上表現為皮質厚度降低,繼發性退化和代謝受損從而干擾半球間的神經元連接[26]。目前普遍贊成的觀點是,受損皮質脊髓束通過跨突觸軸突變性會影響腦卒中患者雙側M1的結構連接,CST的結構性損傷以及大腦半球間運動皮質之間的結構連接是影響皮質下腦卒中上肢運動功能恢復的關鍵因素[8,27-28]。
腦卒中后半球間相互作用失衡模型表明大腦半球間的白質結構通路失連接與廣泛性功能連接中斷相關,該模型強調了經胼胝體連接對運動恢復的重要作用[2,29]。Stewart 等[16]研究發現慢性腦卒中胼胝體上的運動和感覺區域FA 均降低,并且與上肢運動功能水平呈正相關。Li等[9]在急性期腦卒中的縱向研究中發現,患者雙側初級運動皮質(M1-M1)功能連接以及經胼胝體M1-M1 纖維束的FA 值在治療前下降,治療后均有增高并與運動功能恢復一致,表明經胼胝體束結構的完整性是影響腦卒中恢復的重要因素。單側腦梗死動物模型研究也證實,在發病最初幾天實驗鼠腦雙側的初級運動皮質間功能連接顯著減低,并與M1-M1之間經胼胝體的錳傳遞減低具有相關性[30]。本研究擴展了關于同位腦區經胼胝體結構連接的研究,發現本組腦卒中患者大腦半球間同位腦區經胼胝體結構連接普遍受損并均與上肢運動功能障礙的嚴重程度相關,而不僅僅局限在與雙側感覺運動同位腦區的結構連接。由此可見,除了皮質脊髓束的結構性損傷是影響皮質下腦卒中上肢運動功能恢復的關鍵因素,本研究結果表明其他同位腦區經胼胝體纖維的結構連接損傷也同樣會影響腦卒中后的運動功能恢復。
目前神經調控技術改善腦卒中運動功能障礙的理論基礎大多基于“半球間競爭模型”,這一模型認為神經功能障礙與損傷后大腦半球間興奮性失衡相關[31]。“代償模型”這種功能重塑模式認為殘存未受損的腦網絡替代了受損部分網絡的功能。最新提出的“雙相平衡恢復模型”融合以上兩種理論,將大腦半球間平衡和功能恢復與病變所保留的結構基礎聯系起來,并提出了結構保留度的大小(如運動區、皮質脊髓束的保留度)決定半球間競爭模型和代償模型哪一種占優勢[32]。對于損傷較重、患側大腦結構保留較少者,健側功能代償尤為重要[33-34]。腦卒中導致的腦結構損傷進入慢性期通常具有不可逆性,難以恢復。已有不少研究證實處于該期腦卒中患者大腦半球間同位腦區功能活動異常與運動功能嚴重程度同樣密切相關[7-8,26]。因此,對于慢性期較嚴重的偏癱患者,重視并設法改善相關腦區功能活動或許是臨床康復值得努力嘗試之處[11,35]。
3.3 局限性
本研究存在主要不足之處:(1)本研究入組的研究對象是一組慢性期中重度上肢運動功能障礙患者,所得研究結論對于處于其他時期(例如急性期)的卒中嚴重程度不同(例如輕度)的患者不一定適用。另外,了解腦卒中后皮質脊髓束和同位腦區經胼胝體纖維束隨時間的退化或重塑過程,后續還應開展包括從卒中早期就進行的動態跟蹤以及干預前后的研究。(2)基于全腦體素水平的VMHC 分析結果顯示,除了大腦皮質,腦卒中患者皮質下及小腦中也存在同位腦區功能變化。本研究所采用的經胼胝體纖維束模板只能觀測半球間大腦皮質同位腦區的經胼胝體結構連接。下一步研究可考慮選擇高分辨皮質下結構和小腦結構模板探究半球間同位腦區皮質下和小腦的結構連接,以期更加全面深入地了解腦卒中全腦水平的同位腦區結構異常狀況。
本研究利用TCATT 探討了一組單側皮質下腦卒中患者同位腦區經胼胝體纖維束微結構異常與運動功能障礙的關系。研究結果進一步證實皮質下腦卒中的胼胝體微結構受損與病灶同側CST 損傷密切相關;大腦半球間同位腦區經胼胝體結構連接普遍受損均與上肢運動功能障礙的嚴重程度相關,則暗示繼發性跨半球結構連接損傷對皮質下腦卒中運動功能障礙具有同樣重要的影響作用。
作者利益沖突聲明:全體作者均聲明無利益沖突。

