柱前衍生HPLC法測定硫酸阿米卡星及其制劑中基因毒性雜質肼的研究
姚永青 杜斌
(1 鄭州大學,鄭州 450001;2 河南省食品藥品檢驗所,鄭州 450018)
硫酸阿米卡星為半合成氨基糖苷類抗生素[1-2],1957年HamaoUmezawa發現,1972年日本Bristol公司研究成功,我國1981年開始生產。硫酸阿米卡星屬靜止期殺菌劑,適用于銅綠假單胞菌等敏感革蘭陰性桿菌與葡萄球菌屬(甲氧西林敏感株)所致嚴重感染,尤其適用于治療革蘭陰性桿菌對卡那霉素、慶大霉素或妥布霉素耐藥菌株所致的嚴重感染,其制劑為注射劑,為國家基本藥物目錄收載品種,在臨床中應用廣泛。
基因毒性雜質是指對DNA具有直接或間接的破壞性,產生基因突變或體內誘變,而具有致癌可能或者傾向的雜質,其毒性很強,常常在很低的含量或濃度水平下,即可對人體造成遺傳物質的損傷,進而導致基因突變促使腫瘤的發生[3-4]。阿米卡星為卡那霉素等經硅烷化、酯化、酰化、水解、肼解反應后純化制得,在酰化產物水解液的肼解反應中使用了水合肼,肼具有基因毒性結構,是一種已知的基因毒性雜質,具有潛在的致癌性,肼主要通過代謝活化生成碳正離子和碳氧自由基等活性較強的中間體,與DNA發生烷基化反應或導致DNA其他病變[5-6]。ICH M7指出肼在體內和體外均具有致突變性和遺傳毒性,肼被IARC(國際癌癥研究機構)列為2B類,對人類可能致癌,EPA(環境保護局)認為肼是B2類致癌物或人類可能的致癌物質。
本研究選取國內硫酸阿米卡星原料及制劑和參比制劑,參考相關文獻[7-9]建立柱前衍生HPLC法對硫酸阿米卡星及其制劑中的肼進行檢測,同時可為其他藥物中肼的控制提供參考。
1 儀器與試藥
1.1 儀器與試劑
1260高效液相色譜儀(Agilent);XPE205電子天平(Mettler Toledo儀器上海有限公司)。
甲酸、苯甲醛、甲醇及乙腈均為色譜純,水為Mill-Q去離子水。
1.2 樣品
硫酸肼(批號W06E026,質量分數99.0%)購自Alfa Aesar公司。硫酸阿米卡星6批次,來自國內3家企業(A、B、C);國內硫酸阿米卡星注射液9批次,規格2 mL:200 mg,來自國內3家企業(D、E、F);國內注射用硫酸阿米卡星8批次,規格200 mg,來自國內3家生產企業(E、G、H);硫酸阿米卡星注射液和注射用硫酸阿米卡星參比制劑各1批次,均購自日本Nichiiko Pharmaceutical Co.Ltd。
2 試驗方法
2.1 色譜條件
色譜柱:Agilent Zobax Eclipse XDB-C18色譜柱(2.1 mm×150 mm,5 μm );流動相A為0.1%甲酸溶液,流動相B為乙腈,按表1進行線性梯度洗脫;流速1.0 mL/min;DAD紫外檢測器,檢測波長為300 nm,柱溫為25℃,進樣量20 μL。
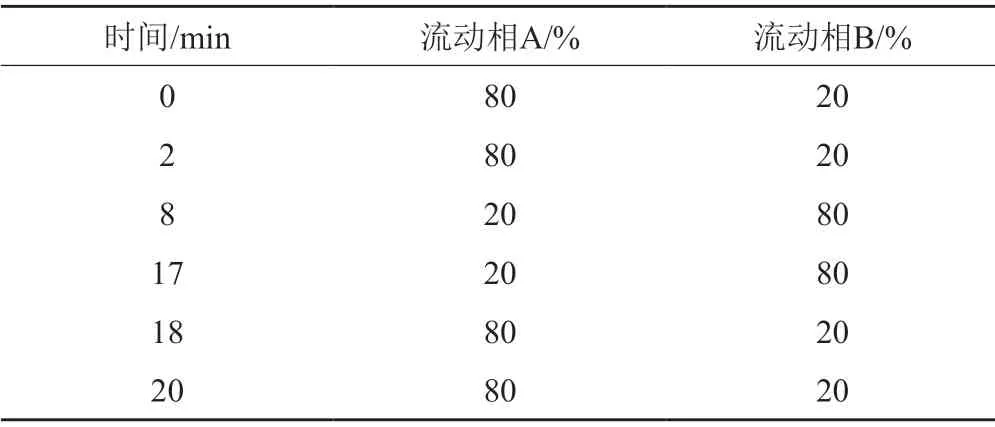
表1 線性梯度洗脫程序Tab.1 Linear gradient elution program
2.2 溶液的配制
2.2.1 苯甲醛溶液
取苯甲醛5 mL,用甲醇稀釋至100 mL,即得。
2.2.2 空白溶液
精密量取水1 mL,置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,振搖1 h,濾過,即得。
2.2.3 空白輔料溶液
精密稱取處方量輔料,置20 mL量瓶中,用水溶解并稀釋至刻度,搖勻,濾過。精密量取續濾液1 mL,置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,振搖1 h,濾過,即得。
2.2.4 肼系列標準溶液
精密稱取硫酸肼0.1030 g,置100 mL容量瓶中,用水溶解并稀釋至刻度,搖勻,作為肼貯備液。精密量取該貯備液,分別加水逐級稀釋并制成濃度為0.5022、1.2554、2.5109、5.0217和12.5543 μg/mL的系列標準樣品溶液。分別精密量取各濃度的標準樣品溶液1 mL,分別置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,振搖1 h,濾過,即得。
2.2.5 供試品溶液
取硫酸阿米卡星、注射用硫酸阿米卡星約0.28 g,精密稱定,置20 mL容量瓶中,用水溶解并稀釋至刻度,搖勻,濾過,分別作為硫酸阿米卡星與注射用硫酸阿米卡星樣品溶液;取硫酸阿米卡星注射液過濾即為硫酸阿米卡星注射液的樣品溶液。精密量取各樣品溶液的續濾液1 mL,置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,振搖1 h,濾過,即得。
3 試驗結果
3.1 專屬性
分別精密量取“2.2.2”和“2.2.3”項下的溶液,注入液相色譜儀,記錄色譜圖,結果空白溶劑和空白輔料均不干擾肼的測定,見圖1A與圖1B。
3.2 線性與范圍
精密量取“2.2.4”項下的肼系列標準溶液,注入液相色譜儀,記錄色譜圖,以峰面積Y為縱坐標,肼濃度X(μg/mL)為橫坐標進行線性回歸,得線性回歸方程Y=100.67X+10.778(r=0.9994),表明肼在0.5022~12.5543 μg/mL濃度范圍內與峰面積的線性關系良好,典型色譜圖見圖1C。
3.3 準確度
取硫酸阿米卡星(A企業,批號RA0078A)、注射用硫酸阿米卡星(E企業,批號1905244)、硫酸阿米卡星注射液(F企業,批號181202011)按“2.2.5”方法制備樣品溶液,分別精密量取樣品溶液1 mL,各9份,分別精密加入“2.2.4”項下1.2554 μg/mL的溶液1 mL、2.5109 μg/mL的溶液1 mL、2.5109 μg/mL的溶液1.5 mL,各3份,分別置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水,振搖1 h,濾過。取續濾液注入液相色譜儀,記錄色譜圖。用“3.2”項下線性回歸方程計算樣品中肼的含量并計算回收率。結果硫酸阿米卡星、注射用硫酸阿米卡星與硫酸阿米卡星注射液中肼的平均回收率分別為94.8%、94.1%和94.3%,RSD(n=9)分別為5.1%、5.8%和4.0%,表明該方法回收率良好,見表2。

表2 回收率試驗結果Tab.2 Results of the recovery tests
3.4 重復性
取硫酸阿米卡星(B企業,批號YA1903024)、注射用硫酸阿米卡星(H企業,批號1903031)、硫酸阿米卡星注射液(F企業,批號181202011)按“2.2.5”方法制備供試品溶液,各6份,取續濾液進樣分析。用“3.2”項下線性回歸方程計算,結果硫酸阿米卡星、注射用硫酸阿米卡星與硫酸阿米卡星注射液中肼含量(mg/kg)的RSD分別為3.9%、3.4%和2.6%。結果表明該方法的重復性良好。
3.5 精密度
精密量取“2.2.4”項下2.5109 μg/mL肼標準溶液,重復進樣6次,結果肼的峰面積RSD為1.2%,表明儀器精密度良好。
3.6 檢測限與定量限
分別精密量取“2.2.4”項下0.5022 μg/mL肼標準樣品溶液1 mL,分別置50 mL和100 mL容量瓶中,用水溶解并稀釋至刻度,搖勻,濾過,分別作為檢測限溶液和定量限溶液。分別精密量取檢測限溶液和定量限溶液1 mL,置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,振搖1 h,濾過。取續濾液進樣分析,以信噪比(S/N)為3:1計,檢測限為0.1 ng,最低檢測濃度為0.05 μg/g(供試品溶液濃度為0.1 g/mL);以信噪比(S/N)為10:1計,定量限為0.2 ng,最低定量濃度為0.1 μg/g(供試品溶液濃度為0.1 g/mL)。
3.7 溶液穩定性
精密量取“2.2.4”項下2.5109 μg/mL肼標準溶液,分別于0、2、4、8、10、12、18和24 h內進樣,結果肼峰面積的RSD為0.6%,表明肼對照品溶液在24 h內穩定。
3.8 耐用性
3.8.1 衍生化反應溫度
精密量取5份2.5109 μg/mL的肼標準樣品溶液,各1 mL,分別置10 mL離心管中,精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,反應溫度分別為25℃、28℃、30℃、32℃和35℃,振搖1 h,濾過,取續濾液進樣分析,結果肼的峰面積RSD為0.9%。
3.8.2 衍生化試劑濃度
精密量取3份2.5109 μg/mL的肼標準樣品溶液,各1 mL,分別置10 mL離心管中,分別精密加4.8%、5.0%和5.2%苯甲醛甲醇溶液1 mL,振搖1 min,再精密加水5 mL,振搖1 h,濾過,取續濾液進樣分析,結果肼的峰面積RSD為1.2%。
3.8.3 衍生化反應時間
精密量取3份2.5109 μg/mL的肼標準樣品溶液,各1 mL,分別置10 mL離心管中,分別精密加苯甲醛溶液1 mL,振搖1 min,再精密加水5 mL,分別振搖55、60和65min,濾過,取續濾液進樣分析,結果肼的峰面積RSD為0.8%。
3.8.4 小結
試驗表明,衍生化反應溫度、反應濃度和反應時間的微小變化均不影響測定結果,衍生化反應方法耐用性良好。
3.9 樣品測定
取硫酸阿米卡星、注射用硫酸阿米卡星、硫酸阿米卡星注射液,分別按“2.2.5”方法制備供試品溶液,取續濾液進樣分析。用“3.2”項下線性回歸方程計算樣品中肼的含量。結果國內企業硫酸阿米卡星、注射用硫酸阿米卡星、硫酸阿米卡星注射液中的肼分別為未檢出~1.8 μg/g、未檢出~0.2 μg/g、未檢出~3.1 μg/g;日本Nichiiko公司的參比制劑中均未檢出肼,結果見表3。
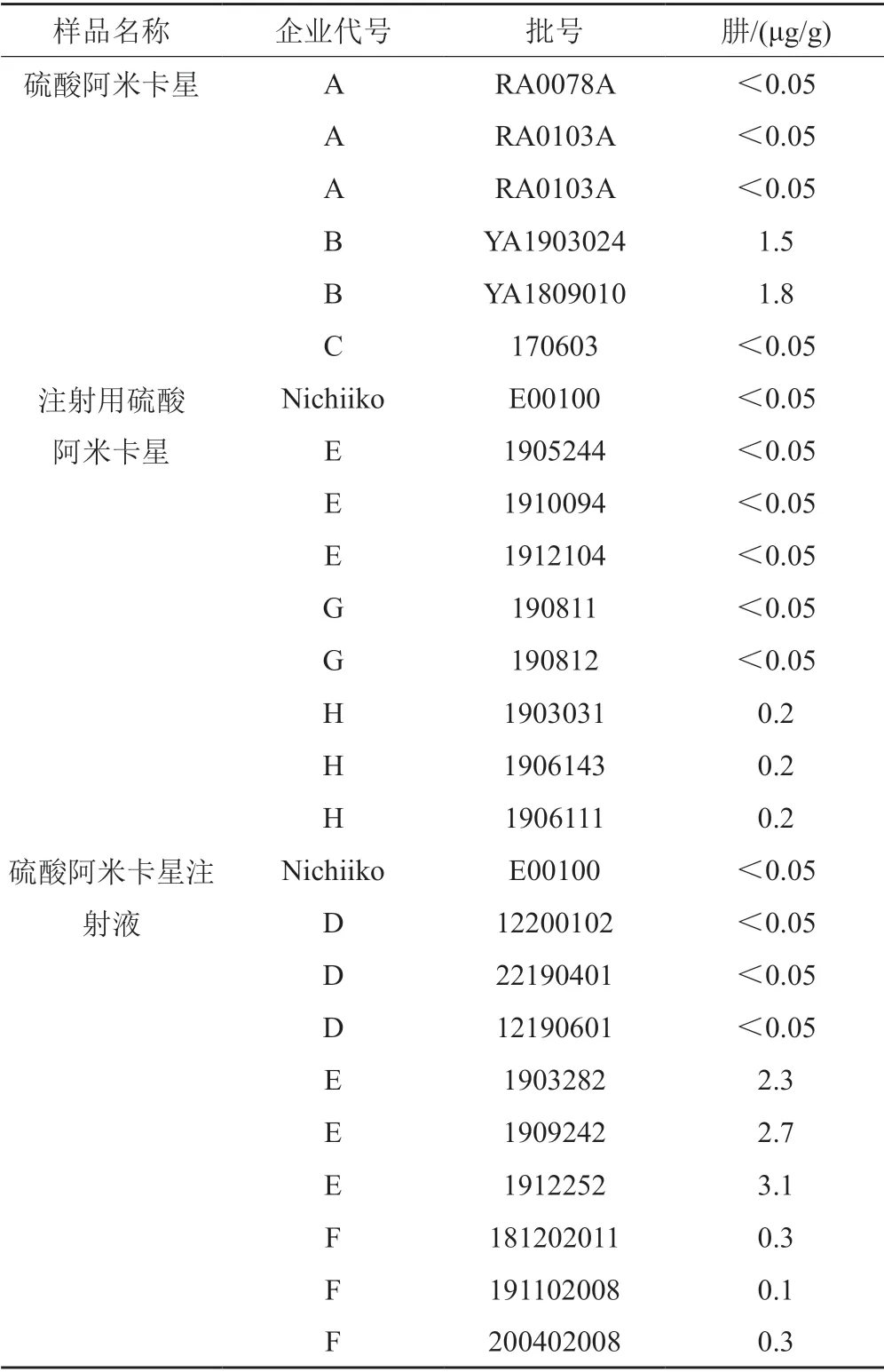
表3 樣品測定結果Tab.3 Results of the sample determination
4 討論
4.1 柱前衍生HPLC方法的建立
肼極性大,相對分子質量低,無發色團,無法直接采用液相色譜法進行檢測,同時藥物及其雜質導致樣品基質復雜,因此直接定量肼較為困難。而苯甲醛具有高的反應性,可以與活性較低的肼發生衍生化反應,其衍生產物具有較強的紫外吸收,能滿足靈敏度的要求,因此苯甲醛衍生化法較適合測定肼[10]。
4.2 衍生化時間的確定
試驗發現,由于不同的企業輔料不同,結果部分企業供試品溶液衍生化15 min時,溶液渾濁。對衍生化時間進行考察,發現供試品溶液衍生化1 h,溶液澄清。對該方法進行驗證,結果專屬性、回收率等均良好,因此確定衍生化時間為1 h。
4.3 原料及制劑中的肼
ICH M7指出肼的每日可接受攝入量為39 μg,硫酸阿米卡星最大日服用劑量為1.5 g,因此肼的限度可定為26 μg/g。本次試驗檢測的參比制劑均未檢出肼,國內企業硫酸阿米卡星、注射用硫酸阿米卡星、硫酸阿米卡星注射液中的肼分別為未檢出~1.8 μg/g、未檢出~0.2 μg/g、未檢出~3.1 μg/g。表明國內外硫酸阿米卡星及其注射劑中的肼均符合ICH M7的要求;同時該方法可為其他制劑中的肼的控制提供參考。