雙對苯醌的抗氧化活性分析及其固體發酵條件優化
胡彥麗,潘利利,閆淑珍,陳雙林*
(南京師范大學生命科學學院,江蘇 南京 210023)
天然的抗氧化活性物質主要包括黃酮類、多酚類、維生素類和多糖等,真菌產生的抗氧化活性物質則主要有醌類、酚類、多糖類、三萜類、對聯三苯類等。苯醌是結構最簡單的醌類化合物,廣泛存在于生物體內,主要包括對苯醌和鄰苯醌兩大類,而天然存在的苯醌化合物多為對苯醌及其衍生物。苯醌由于其特殊的分子結構,可以參與生物系統中電子和質子的轉移過程,具有作為抗氧化劑的潛力。覃陸慧等在探討楊桃根苯醌(benzoquinone ofL.root,BACR)對治療糖尿病小鼠的效果及相關機制時發現,給予BACR后,糖尿病小鼠肝臟的丙二醛含量明顯下降,超氧化物歧化酶和谷胱甘肽過氧化物酶含量明顯升高,表明BACR能有效減輕氧化應激帶來的損傷。Okamoto等在研究一種苯醌類化合物6-(10-羥基癸基)-2,3-二甲氧基-5-甲基-1,4-苯醌時指出,它能抑制大鼠肝和大腦微粒體中由亞鐵離子引發的脂質過氧化。此外,輔酶Q作為一種常見的苯醌類抗氧化劑,可通過直接清除自由基使膜磷脂和膜蛋白免受過氧化。Xu Qiao等最先從瓶生頂孢霉()CA022菌株固體發酵中提取分離和鑒定出雙對苯醌(2,7-dihydroxy-3,6,9-trimethyl-9-xanthene-1,4,5,8-tetraone,DTXT)(圖1),這是一種新的苯醌化合物,因而,其生物活性尚未被研究和揭示,并且前期發酵研究獲得的DTXT產量也比較低,都將限制其未來可能的應用。本研究借鑒已知苯醌類化合物具有抗氧化活性的線索,首先探索瓶生頂孢霉CA022菌株固體發酵所產生的DTXT的抗氧化活性。在證明DTXT具有良好抗氧化活性的基礎上,通過單因素試驗和響應面試驗優化固體發酵條件提高其產量。
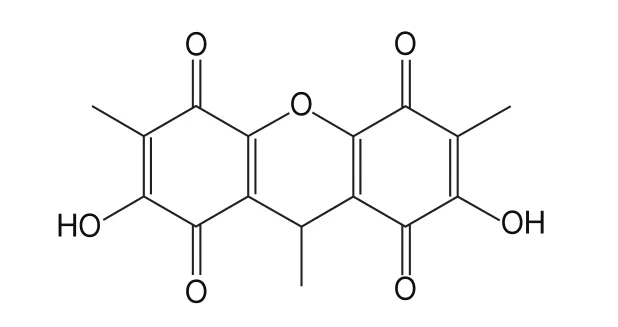
圖1 DTXT結構式Fig.1 Structural formula of DTXT
1 材料與方法
1.1 材料與試劑
供試菌株為瓶生頂孢霉CA022(CGMCC No10816),由本實驗室分離于采自浙江安吉的竹黃()子實體。
初始液體種子培養基:葡萄糖20 g、硝酸鈉3 g、KHPO1 g、MgSOg7HO 0.5 g,加無菌蒸餾水定容至1 000 mL。
固體發酵培養基:100 g大米,裝入17 cmh35 cmh5 cm的食用菌栽培袋中,加水淹沒浸泡12 h后瀝干水分,扎帶封口。121 ℃滅菌20 min,24 h后進行第2次滅菌。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美國Sigma公司;甲醇(色譜級) 美國天地有限公司;其他試劑均為國產分析純;所用水為超純水。
1.2 儀器與設備
SpectraMax M2多孔酶標儀 美國分子儀器(上海)有限公司;RE-52AA旋轉蒸發儀 上海亞榮生化儀器廠;1220高效液相色譜(high performance liquid chromatography,HPLC)儀 美國Agilent公司;X-30R離心機 美國Beckman公司;DHG-9123A電熱恒溫鼓風干燥箱 上海精宏實驗設備有限公司。
1.3 方法
1.3.1 菌種培養和固體發酵
在無菌環境下,挑取瓶生頂孢霉CA022菌株的少許菌絲于馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養皿中,置于28 ℃恒溫培養箱中培養3~5 d。培養結束后,向培養皿中加入約10 mL無菌水,進行孢子的沖洗并稀釋至10,用涂布棒涂布于PDA平板上,將其置于28 ℃恒溫培養箱中培養3 d。待PDA平板上長出單菌落后,挑取單個菌落轉接至新的PDA平板,培養3 d后,挑取顏色較深的單個菌株作為固體發酵的出發菌株,并用無菌水制成1h10個/mL的孢子懸液。向每個液體種子培養基(50 mL)中接入1 mL孢子懸液,28 ℃、130 r/min培養5 d,然后將種子液接于裝有100 g固體發酵培養基的食用菌袋,混勻鋪平,置于28 ℃恒溫培養箱中發酵。每天觀察并混動發酵料,防止發酵料板結影響DTXT產量。
1.3.2 DTXT的提取和純化
參照陳雙林等的方法進行提取和純化,將獲得含目標產物的晶體通過HPLC檢測,并將得到的檢測圖譜與實驗室標準品圖譜進行比較,以判斷是否為DTXT及其純度。將所得純度為95%以上的DTXT樣品用于體外抗氧化實驗。
1.3.3 還原力(總抗氧化活性)的測定
參照王炬等的方法并作改進。抗氧化物質會使反應體系中的Fe還原成Fe,在700 nm波長處吸光度的變化反映出還原能力的高低,吸光度越高說明還原能力越強。稱取適量的DTXT樣品用無水乙醇制成20、40、60、80、100、150 μg/mL和200 μg/mL溶液。分別取1 mL上述待測溶液,依次加入1 mL磷酸鹽緩沖液(0.2 mol/L,pH 6.6)和1 mL 1%鐵氰化鉀溶液,混勻后于50 ℃水浴反應20 min,迅速冷卻后,再加入1 mL 10%三氯乙酸溶液混勻,3 000 r/min離心10 min后取上清液2.5 mL,加去離子水2.5 mL和0.1% FeCl溶液0.5 mL,搖勻后常溫反應10 min,于700 nm波長處測定吸光度。以VC、VE、2,6-二叔丁基-4-甲基苯酚(butylated hydroxy toluene,BHT)和蘆丁為陽性對照,無水乙醇為空白對照,每個處理重復3 次。
1.3.4 超氧陰離子自由基清除率的測定
參照Dong Weixue等的方法并作改進。分別取1 mL不同質量濃度的DTXT乙醇溶液(同1.3.3節),各加入0.05 mol/L Tris-HCl緩沖液4.5 mL和25 mmol/L鄰苯三酚溶液0.4 mL,25 ℃水浴反應5 min,迅速加入1 mL 8 mmol/L HCl溶液終止反應,在波長299 nm處測定樣品溶液的吸光度。對照同1.3.3節,每個處理重復3 次。超氧陰離子自由基清除率計算如式(1)所示:
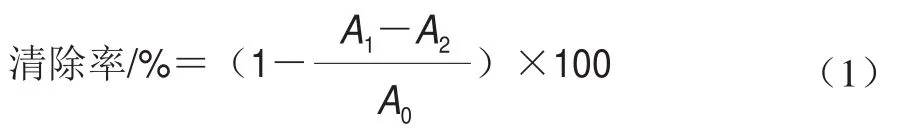
式中:為樣品溶液+Tris-HCl緩沖液+鄰苯三酚溶液+HCl溶液;為樣品溶液+Tris-HCl緩沖液+無水乙醇+HCl溶液;為無水乙醇+Tris-HCl緩沖液+鄰苯三酚溶液+HCl溶液。
1.3.5 羥自由基清除率的測定
參照李曉英等的方法并作改進。分別取1 mL不同質量濃度的DTXT乙醇溶液(質量濃度同1.3.3節),依次加入1 mL 10 mmol/L FeSO溶液和1 mL 10 mmol/L水楊酸溶液,混勻后加入1 mL 8.8 mmol/L HO溶液,37 ℃水浴反應30 min后終止反應,于510 nm波長處測定吸光度。對照同1.3.3節,每個處理重復3 次。羥自由基清除率計算如式(2)所示:
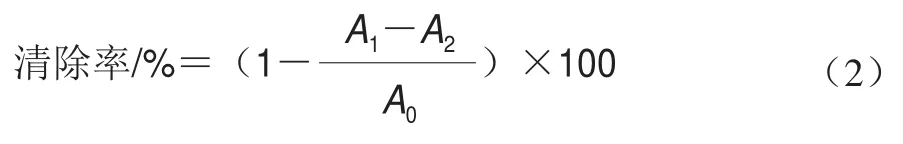
式中:為樣品溶液+FeSO溶液+水楊酸溶液+HO溶液;為樣品溶液+FeSO溶液+水楊酸溶液+無水乙醇;為無水乙醇+FeSO溶液+水楊酸溶液+HO溶液。
1.3.6 DPPH自由基清除率的測定
參照Song Zhu等的方法并作改進。分別取2 mL不同質量濃度DTXT乙醇溶液(同1.3.3節),各加入2 mL 0.2 mmol/L的DPPH溶液,混勻后避光靜置30 min,在517 nm波長處測定吸光度。對照同1.3.3節,每個處理重復3 次。DPPH自由基清除率計算如式(3)所示:
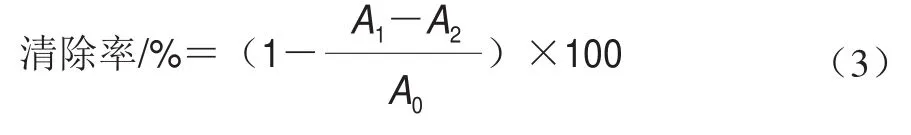
式中:為樣品溶液+DPPH溶液;為樣品溶液+無水乙醇;為無水乙醇+DPPH溶液。
1.3.7 DTXT產量的測定和產率曲線的建立
標準曲線的繪制:用甲醇配制62.5、125、250、375 μg/mL和500 μg/mL的DTXT溶液。采用HPLC檢測法(波長254 nm,柱溫30 ℃,進樣量10 μL),以樣品的峰面積(mAugs)和質量濃度(μg/mL)進行線性回歸,得到DTXT的標準曲線回歸方程:=14.855+612.80(=0.998 3)。
產量測定:發酵完成后,取出發酵料置于55 ℃烘箱烘干,100 目粉碎過篩,每袋取5 g。用乙酸乙酯浸提直至無色,合并浸提液。旋轉蒸發有機溶劑至旋干,加入5 mL色譜甲醇,經超聲充分振蕩后,用有機濾膜過濾,經HPLC分析檢測DTXT的吸收峰面積,由標準曲線計算出DTXT產量。
產率曲線的建立:分別于固體發酵的7、8、9、10、11、12、13、14、15、16、17 d和18 d進行取樣測定DTXT產量,確定最佳發酵時間。
1.3.8 單因素試驗
基于1.3.1節固體發酵的方法與步驟,保持其他條件不變,將初始液態種子培養基中的葡萄糖分別替換為葡萄糖、果糖、麥芽糖、蔗糖、乳糖和可溶性淀粉,質量濃度設置為10、15、20、25、30 g/L,搖床培養結束后將50 mL種子液加入100 g大米培養基中,使其碳源質量分數分別為0.5%、0.75%、1.0%、1.25%和1.5%(以大米質量計,下同);供試氮源為硝酸鈉、硝酸鉀、氯化銨、硫酸銨、尿素和蛋白胨,質量分數分別為0.1%、0.125%、0.15%、0.175%和0.2%;供試微量元素為MgSOg7HO、ZnSOg7HO、FeSOg7HO、MnSOg7HO和HBO,質量分數分別為0.015%、0.020%、0.025%、0.030%和0.035%;供試維生素為VB、VB、VB、VB、VB和VB,含量分別為5、25、50、75 μg/100 g和100 μg/100 g。以上每個處理均重復3 次。其中維生素在配制成1 mg/mL的母液后,用無菌的0.22 μm濾膜過濾除菌,待培養基滅菌冷卻后按需加入。
1.3.9 響應面試驗
基于單因素試驗結果,以篩選出的最佳碳源、氮源、微量元素和維生素為自變量,DTXT產量為響應值,采用Design-Expert 12.0的中心組合設計法,進行響應面分析試驗,試驗因素及水平設計見表1。
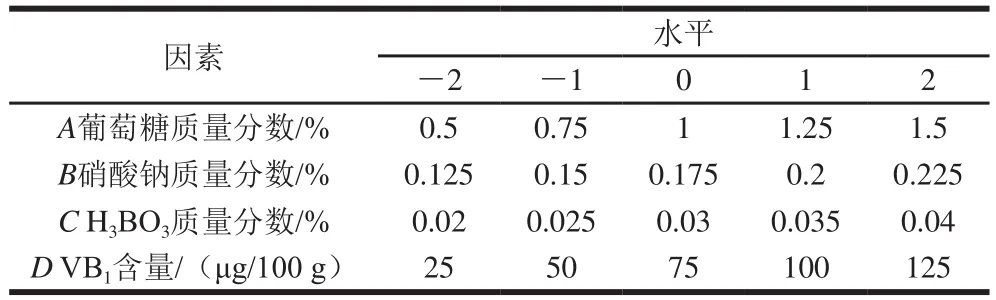
表1 響應面試驗因素及水平Table 1 Coded levels and corresponding actual levels of independent variables used for response surface methodology
1.4 數據統計分析

2 結果與分析
2.1 DTXT的提取和純化
將獲得含目標產物的晶體通過HPLC檢測,得到檢測圖譜(圖2)。在相同的檢測條件下,待測樣品中主要物質的出峰時間為6.538 min(圖2A),與本實驗室保存的純化對照品出峰時間6.556 min(圖2B)基本一致,并且待測樣品的純度達到98%,純度較高,可以為后續實驗使用。
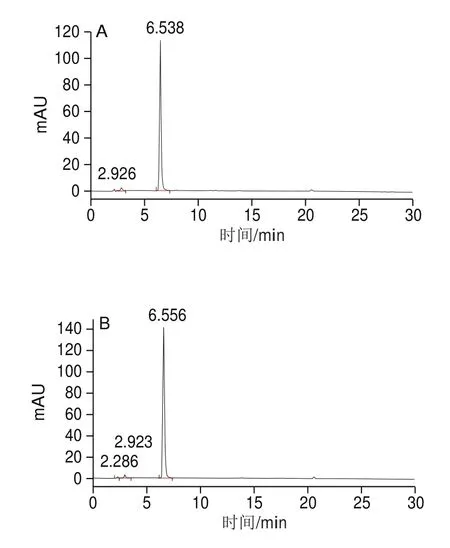
圖2 待測物(A)和對照品(B)的HPLC圖譜Fig.2 HPLC chromatograms of unknown (A) and control (B) samples
2.2 DTXT體外抗氧化活性
2.2.1 DTXT還原力
還原力反映了抗氧化物質的總抗氧化能力。DTXT還原力隨著質量濃度的提高而增強(表2),當DTXT質量濃度為200 μg/mL時,吸光度為0.608f0.002。在150~200 μg/mL質量濃度范圍內,DTXT吸光度較大,與蘆丁相當,差異不顯著。在20~200 μg/mL范圍內,DTXT還原力均顯著低于相同質量濃度下的VC,但顯著高于相同質量濃度的VE和BHT。結果表明DTXT具有良好的總抗氧化能力。
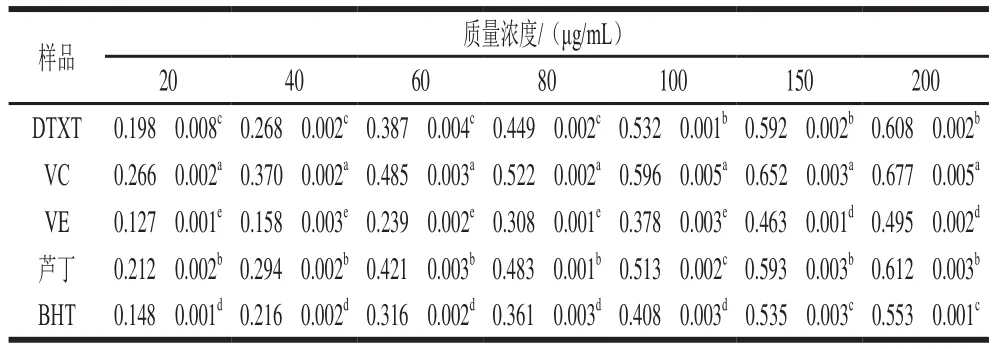
表2 DTXT的還原力Table 2 Reducing power of DTXT
2.2.2 DTXT對超氧陰離子自由基的清除作用
不同質量濃度的DTXT均能清除超氧陰離子自由基,在20~200 μg/mL范圍內,清除能力隨著DTXT質量濃度的提高而增強(表3),IC為112.70 μg/mL。在200 μg/mL質量濃度下,DTXT對超氧陰離子自由基清除率達到(67.00f5.05)%。在150 μg/mL和200 μg/mL質量濃度下,DTXT對超氧陰離子自由基清除率顯著高于BHT。在20~200 μg/mL范圍內,DTXT清除超氧陰離子自由基的能力與VE大體相當,但低于相同質量濃度的VC和蘆丁,且差異顯著。
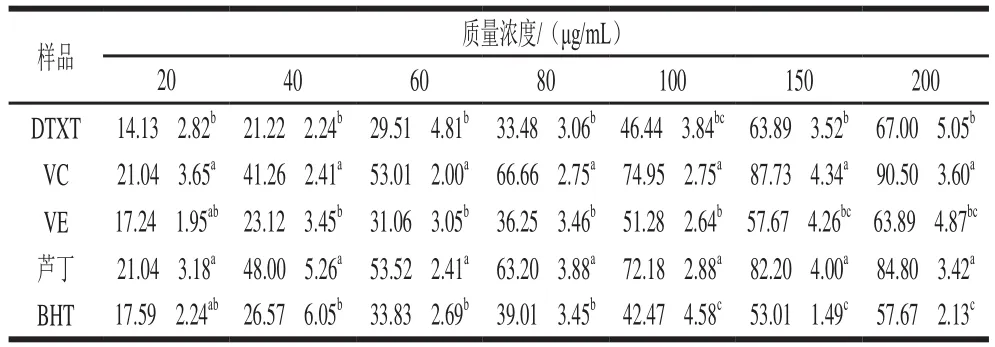
表3 DTXT對超氧陰離子自由基的清除率Table 3 Percentage scavenging of O2-· by DTXT %
2.2.3 DTXT對羥自由基的清除作用
DTXT對羥自由基具有良好的清除作用,清除能力隨著DTXT質量濃度的提高而增強(表4),IC為78.63 μg/mL。在200 μg/mL時,DTXT對羥自由基清除率為(78.83f3.19)%。在20~200 μg/mL范圍內,DTXT對羥自由基清除率均顯著高于相同質量濃度的VE和BHT,但低于相同質量濃度的VC。在高質量濃度(150~200 μg/mL)時,與蘆丁的清除作用差異不顯著。
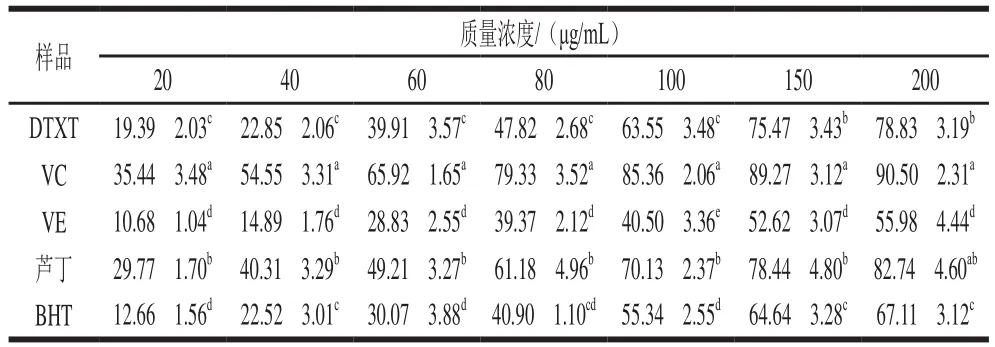
表4 DTXT對羥自由基的清除率Table 4 Percentage scavenging of ·OH by DTXT %
2.2.4 DTXT對DPPH自由基的清除作用
DTXT對DPPH自由基也具有良好的清除作用(表5),清除能力隨著DTXT質量濃度的提高而增強,IC為88.36 μg/mL。在質量濃度為200 μg/mL時,對DPPH自由基清除率達到(76.53f3.08)%。在較高質量濃度(150 μg/mL和200 μg/mL)下,DTXT對DPPH自由基清除率顯著高于相同質量濃度的BHT和VE,低于相同濃度的蘆丁,但無顯著差異。在20~200 μg/mL范圍內,DTXT對DPPH自由基清除率均顯著低于相同質量濃度的VC。
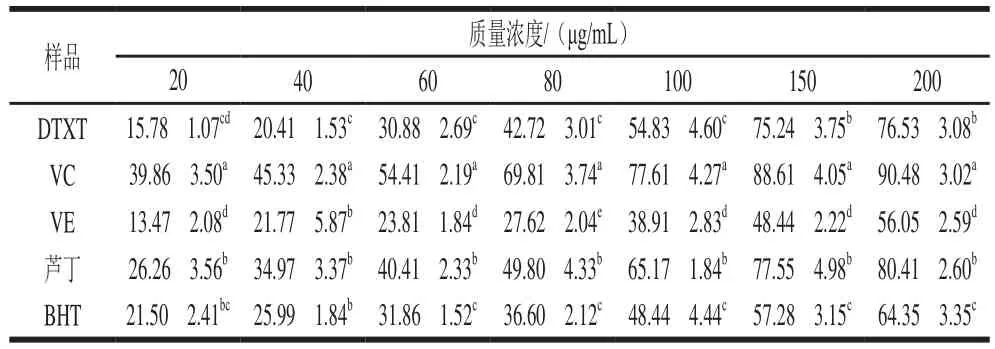
表5 DTXT對DPPH自由基的清除率Table 5 Percentage scavenging of DPPH free radical by DTXT%
2.3 DTXT的固體發酵
2.3.1 DTXT產量曲線
DTXT產量隨著供試菌株瓶生頂孢霉CA022固體發酵培養時間的延長不斷增加(圖3),在固體發酵14 d達到最大(2 815.89 mg/kg),之后,產量逐步下降,因此將DTXT的固體發酵時間確定為14 d。
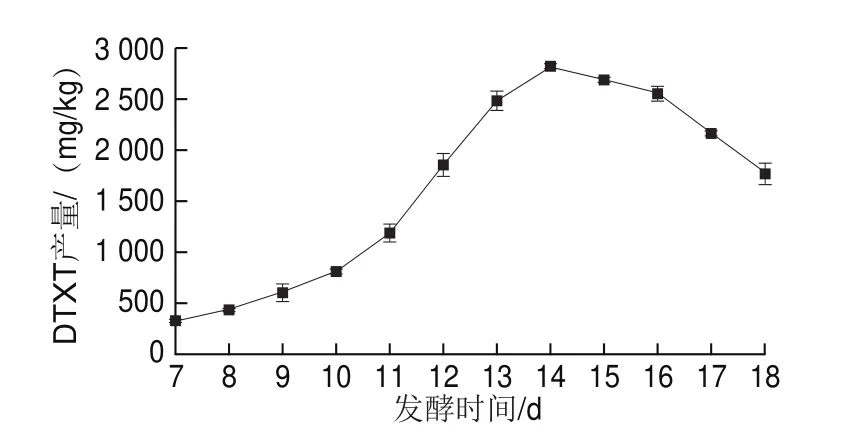
圖3 DTXT產量與發酵培養時間的關系Fig.3 Relationship between fermentation time and DTXT production
2.3.2 碳源對固體發酵產DTXT產量的影響
向瓶生頂孢霉CA022菌株固體發酵培養基中分別添加6 種供試碳源(葡萄糖、蔗糖、麥芽糖、果糖、乳糖和可溶性淀粉),圖4結果表明,它們均可被CA022菌株利用,并且提高了DTXT產量。隨著碳源質量分數的增加,DTXT產量在較低質量分數下都在逐漸增加,在較高質量分數下則逐漸下降。DTXT產量達到最高時的各碳源處理質量分數不同,葡萄糖質量分數為1.0%時,DTXT產量達到2 864.83 mg/kg;蔗糖質量分數為1.25%時,DTXT產量達到1 564.15 mg/kg;麥芽糖質量分數為1.25%時,DTXT產量達到 2 693.61 mg/kg;果糖質量分數為1.25%時,DTXT產量達到2 024.51 mg/kg;乳糖質量分數為1.25%時,DTXT產量達到2 210.11 mg/kg;可溶性淀粉質量分數為1.0%時,DTXT產量達到2 349.49 mg/kg。相比于另外5 種碳源,葡萄糖在較低質量分數時,DTXT產量就達到最高,且高于其他5 種碳源處理的最高產量。
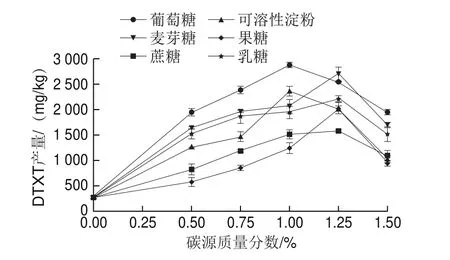
圖4 不同碳源對固體發酵DTXT產量的影響Fig.4 Effect of different carbon sources on DTXT production
2.3.3 氮源對固體發酵產DTXT產量的影響
向瓶生頂孢霉CA022菌株固體發酵培養基中分別添加6 種供試氮源(硝酸鈉、硝酸鉀、氯化銨、硫酸銨、尿素和蛋白胨),圖5結果表明,它們均可被CA022菌株利用,并且提高了DTXT產量。隨著氮源質量分數的增加,DTXT產量在較低質量分數下都在逐漸增加,在較高質量分數下則逐漸下降。DTXT產量達到最高時的各氮源處理質量分數不同,硝酸鈉質量分數為0.175%時,DTXT產量達到2 837.97 mg/kg;硝酸鉀質量分數為0.175%時,DTXT產量達到2 444.31 mg/kg;氯化銨質量分數為0.175%時,DTXT產量達到992.47 mg/kg;硫酸銨質量分數為0.15%時,DTXT產量達到864.27 mg/kg;尿素質量分數為0.15%時,DTXT產量達到700.06 mg/kg;蛋白胨質量分數為0.175%時,DTXT產量達到643.24 mg/kg。相比于另外5 種氮源,添加0.175%硝酸鈉時,DTXT產量最高,且顯著高于其他5 種氮源處理的最高產量(<0.05)。
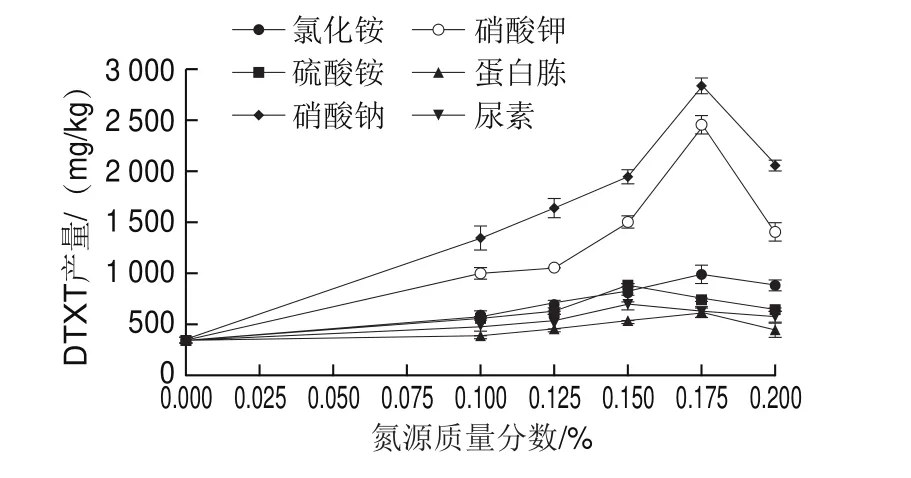
圖5 不同氮源對固體發酵DTXT產量的影響Fig.5 Effect of different nitrogen sources on DTXT production
2.3.4 微量元素對固體發酵產DTXT產量的影響
向瓶生頂孢霉CA022菌株固體發酵培養基中分別添加5 種微量元素(MgSOg7HO、ZnSOg7HO、FeSOg7HO、MnSOg7HO和HBO),圖6結果表明,它們均可被CA022菌株利用,并且提高了DTXT產量。隨著微量元素質量分數的升高,DTXT產量在較低質量分數下都在逐漸增加,在較高質量分數下則逐漸下降。DTXT達到最高時的各微量元素處理質量分數不同,MgSO質量分數為0.03%時,DTXT產量達到2 558.55 mg/kg;ZnSO質量分數為0.03%時,DTXT產量達到1 452.88 mg/kg;FeSO質量分數為0.025%時,DTXT產量達到572.50 mg/kg;MnSO質量分數為0.025%時,DTXT產量達到727.36 mg/kg;HBO質量分數為0.03%時,DTXT產量達到2 831.37 mg/kg。相比于另外5 種微量元素,HBO效果最佳,質量分數為0.03%時,DTXT產量最高,且顯著高于其他4 種供試微量元素處理的最高產量(<0.05)。
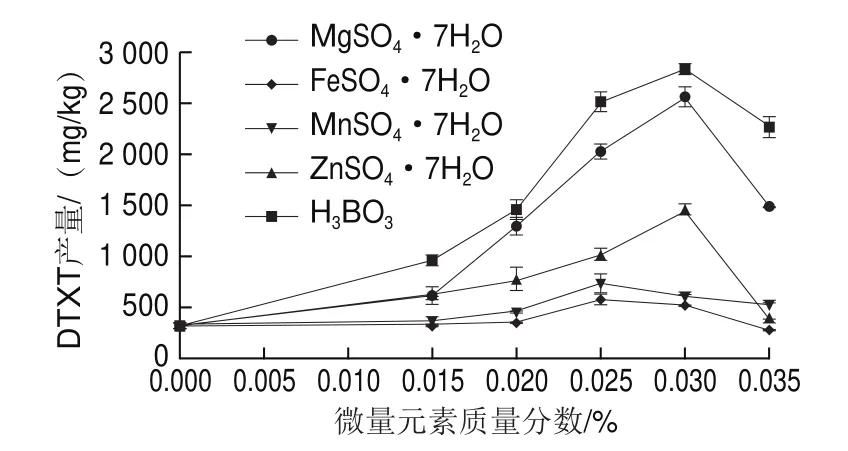
圖6 不同微量元素對固體發酵DTXT產量的影響Fig.6 Effect of different microelements on DTXT production
2.3.5 維生素對固體發酵產DTXT產量的影響
向瓶生頂孢霉CA022菌株固體發酵培養基中分別添加6 種B族維生素üü硫胺素(VB)、核黃素(VB)、煙酸(VB)、吡哆素(VB)、生物素(VB)和鈷胺素(VB),結果表明(圖7),與不添加任何維生素的處理相比,它們在一定程度上均可提高固體發酵DTXT產量,但差異不顯著。其中VB的效果最好,含量為75 μg/100 g時,DTXT產量最高,達到4 254.90 mg/kg。
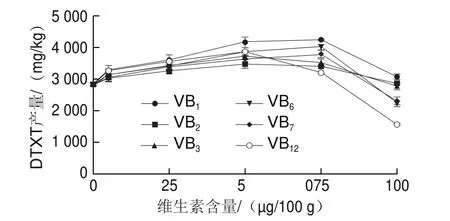
圖7 維生素對DTXT產量的影響Fig.7 Effect of different vitamins on DTXT production
2.3.6 響應面試驗結果
根據單因素試驗結果,分別選擇葡萄糖、硝酸鈉、HBO和VB作為瓶生頂孢霉CA022菌株固態發酵產DTXT的組合處理,利用Design-Expert 12.0進行中心組合試驗設計,共30 組,所得結果如表6所示。
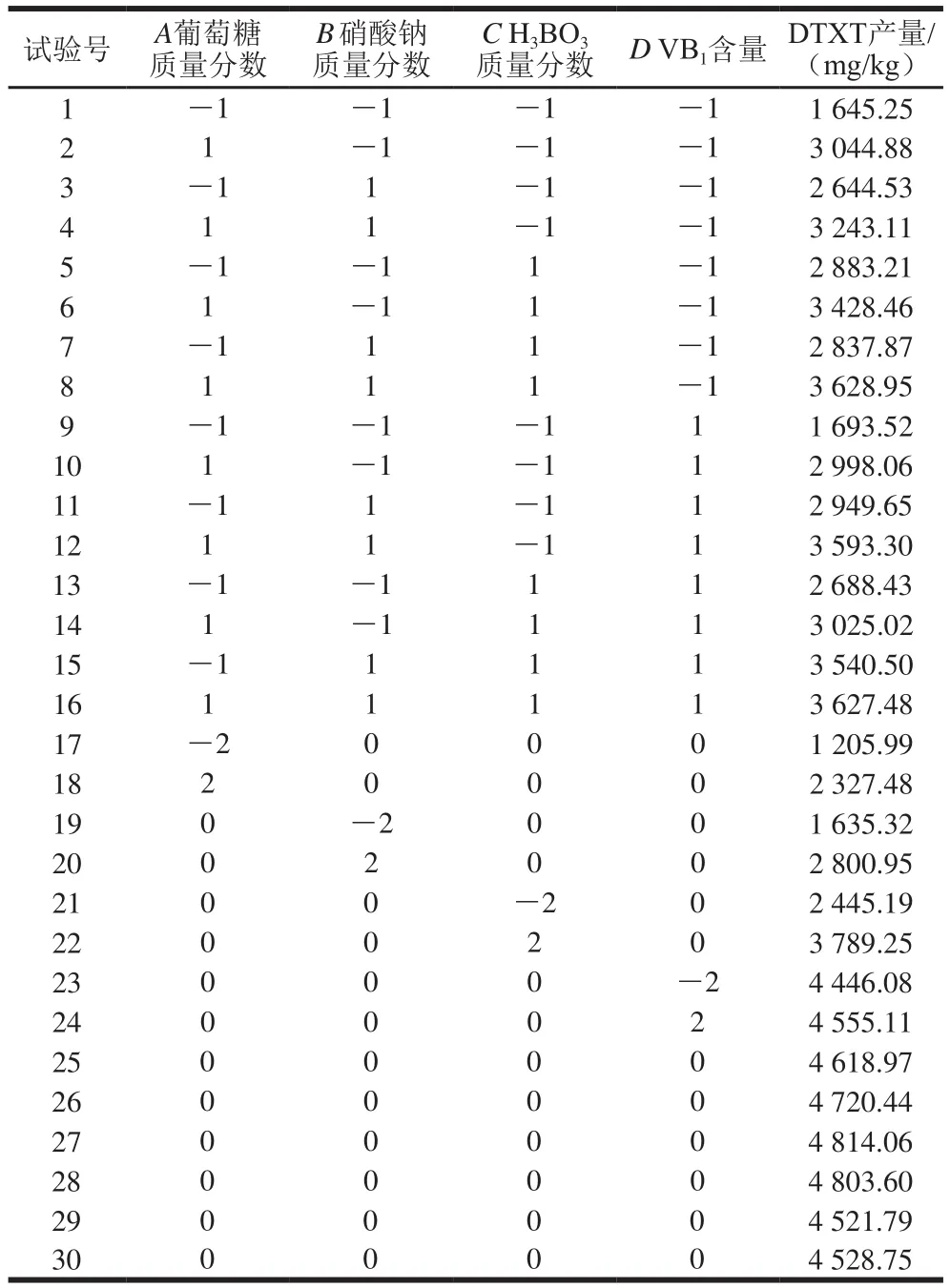
表6 響應面試驗方案及結果Table 6 Experimental design and results for response surface analysis
根據所獲DTXT產量數據()進行多元回歸擬合,得到下面的二階多項式回歸方程:

由回歸模型方差分析(表7)可以看出,響應模型的<0.000 1,=75.65,失擬項=0.228 6>0.05不顯著,表明該模型擬合度較高。此外,模型的相關系數為0.986 0,說明該模型可以解釋98.60%的響應值變化,只有很小的變量(1.40%)沒有得到合理的解釋,表明預測結果與實際結果的一致性較好。以上結果表明該模型的擬合度良好,可用于瓶生頂孢霉CA022菌株固態發酵產DTXT產量的預測。回歸模型的方差分析可以判斷自變量對因變量的影響程度。由表7可見,一次項、、對響應值的影響較大,達到極顯著水平(<0.01),而影響則不顯著(>0.05)。二次項、、達到極顯著水平(<0.01),影響則不顯著(>0.05)。模型中的交互項、、達到顯著水平(<0.05),而、、影響則不顯著(>0.05)。比較4 個因素的值大小可知,影響DTXT產量的因素依次為:葡萄糖>硝酸鈉>HBO>VB。
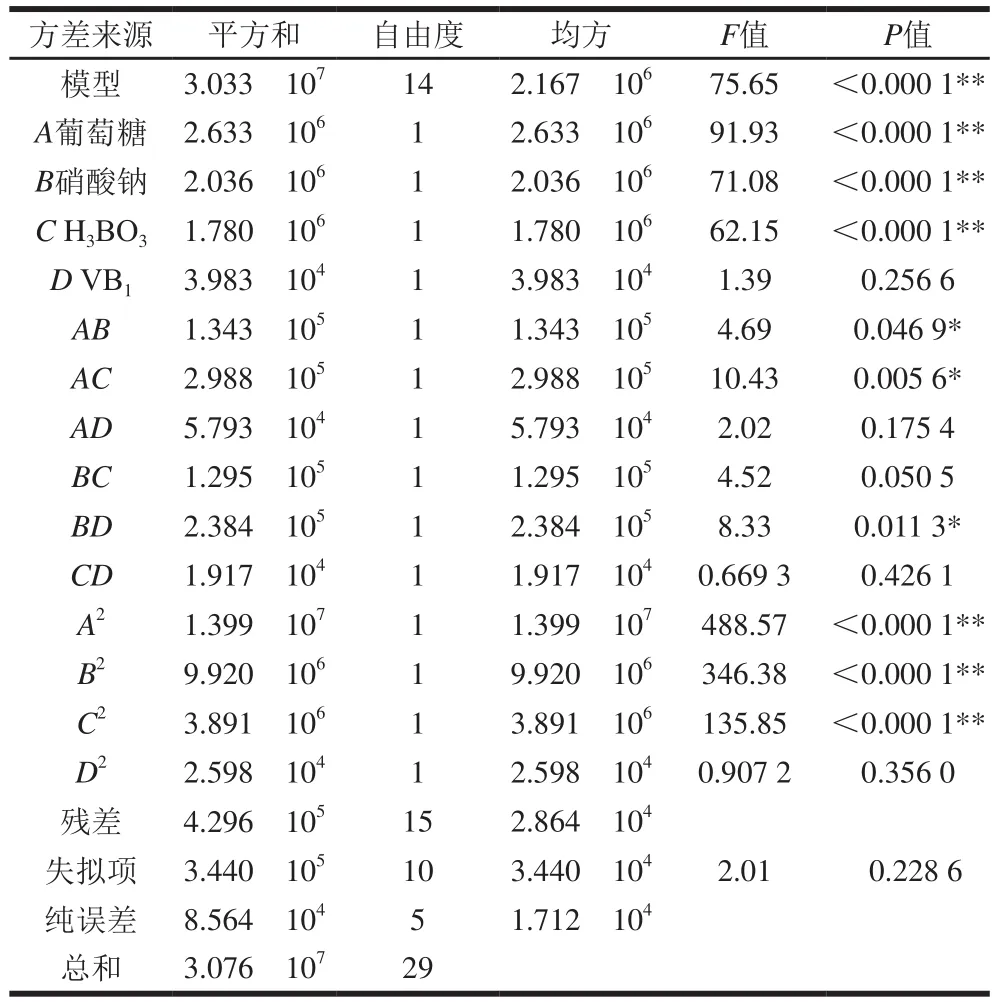
表7 回歸模型的方差分析Table 7 Analysis of variance of quadratic polynomial model
根據三維響應面可以看出各變量之間的交互作用對響應值的影響。等高線是響應面在水平方向的投影,等高線呈橢圓形表示兩因素交互作用顯著,呈圓形表示兩因素交互作用不顯著。由圖8可以看出,各因素交互作用大小依次為:葡萄糖與HBO>硝酸鈉與VB>葡萄糖與硝酸鈉>硝酸鈉與HBO>葡萄糖與VB>HBO與VB,與表7回歸分析結果相符。
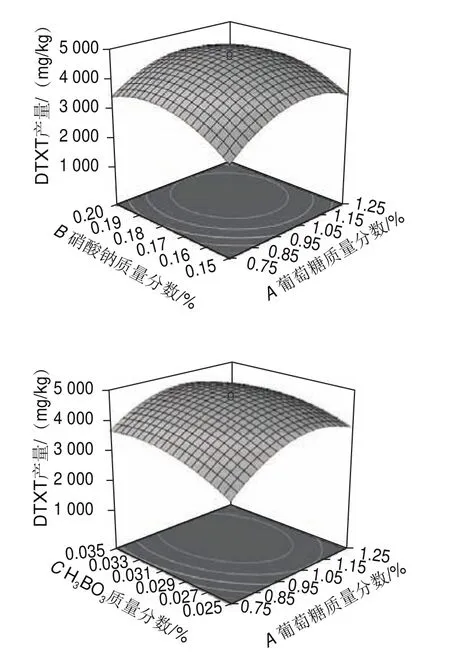
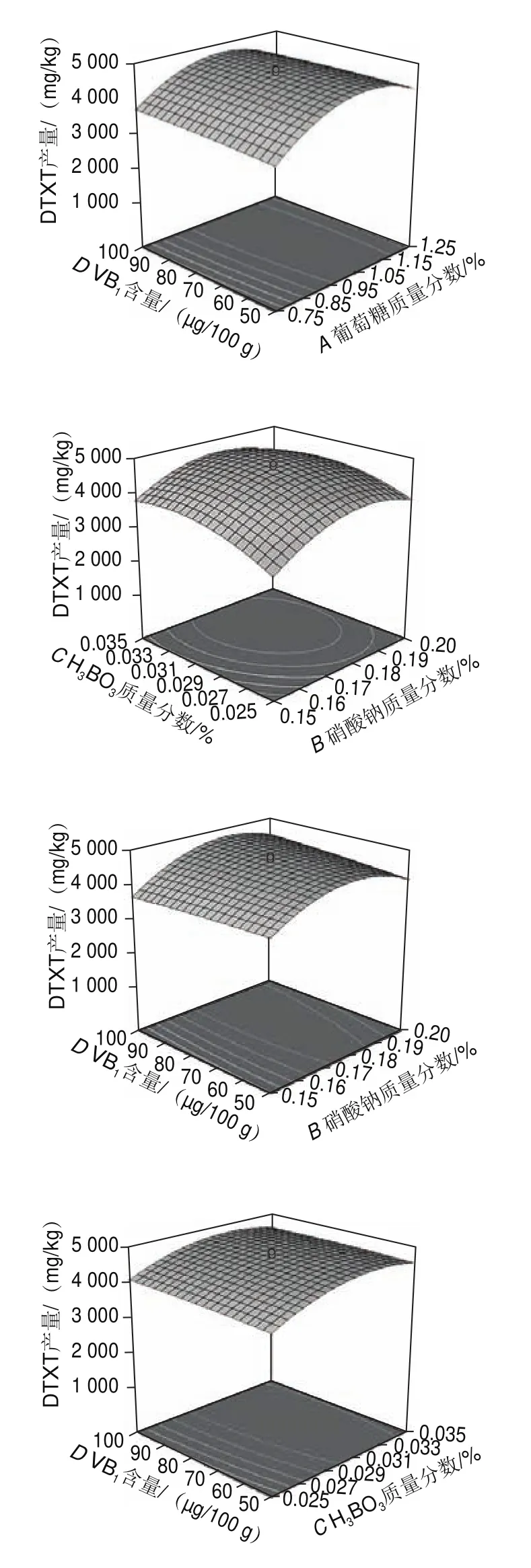
圖8 各因素交互作用對DTXT產量的影響Fig.8 Response surface plots showing the interactive effects of different factors on DTXT production
通過Design-Expert 12.0軟件,預測得到瓶生頂孢霉CA022菌株發酵產DTXT的最優組合為葡萄糖0.773%、硝酸鈉0.185%、HBO0.032%、VB100 μg/100 g,預測得到的DTXT最大產量為4 016.24 mg/kg。在模型預測最優組合條件下進行發酵,實際得到的DTXT產量為4 150.80 mg/kg。實驗值與理論值在合理的誤差范圍內,證明該優化方案可行,可用于DTXT的生產。
3 討 論
為了評價藥物或天然化合物能否在體內作為抗氧化劑,通常先在體外進行研究。本研究采用體外抗氧化法考察DTXT的抗氧化活性,結果表明DTXT具有良好的還原能力和清除自由基的能力,其中對于羥自由基和DPPH自由基清除率分別達到78.83%和76.53%。文獻中也有關于苯醌化合物體外抗氧化活性的報道,如Joshi在研究天然苯醌Embin的抗氧化活性時發現其對于DPPH自由基清除率達到50%以上,對羥自由基清除率達到79%;Deniz等在研究1,4-苯醌取代物時發現2,5-二氨基-1,4-苯醌對羥自由基清除率達到76.70%;Liu Kun等對提取自蘑菇的3 種苯醌化合物的抗氧化活性進行了比較,發現3 種化合物均對DPPH自由基的清除效果不佳(<50%),但其中化合物2-苯基-3-甲氧基-[1-2-苯并吡喃][4,3-]對苯醌對羥自由基清除率達到80%以上。這與本實驗結果有所不同,可能是因為苯醌自身結構的差異,如取代基的不同,導致其對不同自由基的清除率不同。本研究有助于了解苯醌類化合物的抗氧化活性,但關于DTXT的抗氧化活性機理還有待進一步研究。
本研究通過單因素試驗,得到瓶生頂孢霉CA022菌株固體發酵產DTXT的最佳碳源、氮源、微量元素和維生素分別是葡萄糖、硝酸鈉、HBO和VB。文獻中也有關于天然苯醌生產條件的報道,如幸峰等研究熱帶假絲酵母()產苯醌的最佳碳源和氮源分別是葡萄糖和蛋白胨,茍學磊等指出角毛殼菌()發酵產苯醌類色素的最佳碳源、氮源和微量元素分別是蔗糖、蛋白粉和NaCl,這與本實驗結果有所不同,這說明不同真菌產苯醌所需要的營養條件不同。某些微量元素或生長因子也能影響苯醌的產生,如Zheng Ziyi等發現CaCl和VB能促進對麥胚發酵產甲氧基對苯醌和2,6-二甲氧基對苯醌。影響真菌次級代謝的因素有很多,這些因素之間不是孤立的,而是相互聯系的,只有選擇較佳的營養物質及其配比,微生物才能生長良好。
4 結 論
通過體外抗氧化實驗考察了DTXT的抗氧化活性,通過優化瓶生頂孢霉CA022菌株的培養基配方,提高了DTXT產量。體外抗氧化實驗結果表明,DTXT還原能力以及對DPPH自由基和羥自由基的清除能力與蘆丁大體相當,具有作為抗氧化劑的潛力。響應面試驗結果表明,優化后的DTXT產量(4 150.80 mg/kg)是優化前(2 864.83 mg/kg)的1.45 倍,為DTXT固體發酵的研發提供了理論依據。

