胰腺癌“炎-癌”轉化關鍵基因篩選及干預中藥的預測分析
肖 祥,吳宣諭
胰腺癌“炎-癌”轉化關鍵基因篩選及干預中藥的預測分析
肖 祥,吳宣諭*
成都中醫藥大學附屬醫院,四川 成都 610072
通過生物信息學技術篩選胰腺癌(pancreatic cancer)與慢性胰腺炎(chronic pancreatitis,CP)組織的差異基因,預測能夠干預胰腺癌“炎-癌”轉化進程的中藥及其潛在治療靶點及機制。從基因表達數據庫(Gene Expression Omnibus,GEO)獲取GSE151945、GSE30134基因芯片,應用R軟件進行數據標準化、差異表達基因(differentially expressed genes,DEGs)篩選,并進行基因本體論(gene ontology,GO)和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)富集分析;通過STRING數據庫構建蛋白-蛋白互作網絡,應用Cytoscape構建蛋白互作網絡圖,應用CytoHubba插件篩選關鍵基因;使用R軟件對關鍵基因進行生存分析,篩選顯著影響胰腺癌預后的基因,通過Kaplan-Meier曲線進行可視化展示;將上述基因與Coremine Medical數據庫相互映射,預測潛在治療作用的中藥。從TCMSP和TCMID數據庫獲取中藥化學成分,利用Cytoscape構建“中藥-成分-靶點”網絡圖,并使用CytoHubba插件篩選關鍵靶點。共篩選出178個DEGs,其中88個上調基因,90個下調基因;DEGs主要參與病毒生命周期、細胞外結構組織、細胞外基質組織、染色質的共價修飾等生物功能;KEGG通路分析顯示DEGs主要富集在人乳頭瘤病毒感染、志賀菌病、亨廷頓病、癌癥蛋白多糖和絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路;共得出20個關鍵基因,生存分析提示黏附連接相關蛋白紐蛋白(vinculin,)、核不均一性核糖核蛋白L(heterogeneous nuclear ribonucleoprotein L,L)、小泛素樣修飾物3(small ubiquitin like modifier 3,)、整合素α3(integrin subunit alpha 3,)、整合素β5(integrin subunit beta 5,)、黏結蛋白聚糖1(syndecan 1,)和神經細胞黏附分子1(neural cell adhesion molecule 1,)顯著影響胰腺癌預后;篩選得到干預胰腺癌“炎-癌”轉化進程的潛在中藥有夏枯草、金錢草、紫蘇、生地、赤芍、菟絲子等。胰腺癌“炎-癌”轉化機制復雜,中藥可通過多靶點干預胰腺癌“炎-癌”轉化,該研究將為胰腺癌發生機制和治療藥物的研究提供參考方向。
慢性胰腺炎;胰腺癌;生物信息學;中藥預測;夏枯草;金錢草;紫蘇;生地黃;赤芍;菟絲子
胰腺癌(pancreatic cancer)是由于胰腺內細胞發生DNA的異常突變引起細胞的增殖、生長失控從而形成的腫瘤,是惡性程度最大的腫瘤之一[1]。據國際癌癥研究機構報道,胰腺癌的病死率位于所有惡性腫瘤的第7位[2]。我國胰腺癌的發病率位于所有惡性腫瘤的第10位,而其病死率位于第6位[3]。胰腺癌的危險因素包括遺傳、衰老、吸煙、飲酒、肥胖、飲食以及慢性胰腺炎[4]。其中慢性胰腺炎(chronic pancreatitis,CP)是胰腺癌的重要危險因素之一,這對胰腺癌的預防和早期干預提供了一定的思路,國際胰腺癌病例與對照聯盟指出預防CP有助于避免胰腺癌的發生[5]。現有研究表明CP主要通過內源性和外源性途徑引起胰腺癌的發生,其機制可能與胰腺纖維化有關[6-7],其中、、、、和等基因的異常表達可能促進由CP向胰腺癌的進展[8-13],但其具體機制仍不清楚。因此,深入探索胰腺癌“炎-癌”轉化關鍵基因和重要生物途徑,對于胰腺癌的預防、早期診斷和靶向治療具有重要意義。
隨著社會對精準醫學重視度的提高,生物信息學技術憑借其高通量數據處理優勢而受到廣泛運用[14]。關于治療胰腺癌新藥的研究仍是當下的熱點話題[15],具有數千年歷史的中醫藥,對于胰腺癌的防治具有一定優勢[16-18]。本研究基于生物信息學探索胰腺癌“炎-癌”發展過程中的關鍵基因,并對其展開進一步研究,探索其對于胰腺癌生存率的影響,進一步預測治療胰腺癌的潛在中藥,并構建“中藥-成分-靶點”網絡圖,揭示其作用機制,以期為胰腺癌的臨床診治提供新的思路和方向。
1 資料和方法
1.1 數據來源
從基因表達數據庫(Gene Expression Omnibus,GEO)數據庫下載包含胰腺癌與CP患者的基因芯片(GSE151945、GSE30134)數據,下載數據格式為MINiML。其中GSE151945芯片包括胰腺癌組織3例,CP組織3例,GSE30134芯片包括胰腺癌組織15例,CP組織8例。2種芯片平臺分別來自GPL17077、GPL3985,種屬為“homo sapiens”。
1.2 數據標準化處理
采用R 3.40.2軟件preprocessCore軟件包中的normalize.quantiles函數進行數據標準化處理,將探針ID轉換為gene symbol,剔除有多個基因的探針,計算多個探針對應基因的平均值。提取2個數據集共有gene symbol。不同數據集標記為不同批次,采用R軟件limma包中的removeBatchEffect函數去除批次效應,針對數據預處理結果,通過箱線圖評估數據標準化情況;通過對比批次去除前后可視化主成分分析(principal component analysis,PCA)圖評估數據批次效應情況,箱線圖和PCA圖分別通過R軟件包ggplot2和ggord繪制。
1.3 差異表達基因(differentially expressed genes,DEGs)篩選
使用R軟件的limma軟件包研究胰腺癌與CP樣本之間mRNA的DEGs。以<0.05且log2(FC)>1或log2(FC)<?1為條件篩選DEGs。FC為差異倍數,代表2組樣本間表達量的比值。其中log2(FC)>1代表基因表達上調,log2(FC)<?1代表基因表達下調,表達熱圖通過R軟件包pheatmap進行展示。
1.4 基因本體論(gene ontology,GO)和京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
為進一步確認上述DEGs的潛在功能,進行功能豐富分析。GO是一種廣泛使用的工具,用于注釋具有功能的基因,包括分子功能(molecular function,MF)、生物過程(biological process,BP)和細胞成分(cell component,CC)。KEGG可用于分析基因功能以及相關的高級基因組功能信息。使用R軟件中的ClusterProfiler程序包進行GO及KEGG分析。
1.5 蛋白-蛋白互作(protein-protein interaction,PPI)網絡分析與關鍵基因篩選
將上述DEGs導入STRING數據庫進行PPI分析,物種設置為“homo sapiens”,選取相互作用得分大于0.4的基因輸入Cytoscape進行可視化,用CytoHubba插件篩選PPI網絡中度(degree)值前20個基因作為CP癌變關鍵基因。
1.6 關鍵基因的生存分析
從癌癥基因組圖譜(TCGA)數據集獲得了178個胰腺癌的RNA測序數據(第3級)的原始計數和相應的臨床信息,通過R軟件survival和survminer軟件包對20個關鍵基因與胰腺癌總體生存率(overall survival,OS)和無病生存率(disease free survival,DFS)的相關性進行分析,繪制預后顯著性差異基因的Kaplan-Meier曲線。
1.7 潛在治療中藥的預測
參照贠張君等[19]的研究,將顯著影響胰腺癌預后的基因導入Coremine Medical數據庫映射出具有潛在干預作用的中藥,以<0.05為標準篩選,若藥物數量過多,則根據中醫藥理論知識和臨床常用為原則進一步篩選[20]。從TCMSP數據庫中根據生物口服利用度(OB)≥30%、類藥性(DL)≥0.18篩選預測中藥的有效成分,提取相應成分的作用靶點,TCMSP數據庫未收錄的藥物成分通過TCMID數據庫進行檢索[21-22]。運用Uniprot數據庫對獲得的有效靶點進行去重、規范化,將處理后的數據導入Cytoscape中構建“中藥-成分-靶點”網絡圖,利用CytoHubba插件中degree算法對排名前25的靶點進行篩選并進行可視化處理[21]。
2 結果
2.1 芯片數據標準化和預處理結果
根據數據預處理方案,得到處理后的數據符合預期要求,見圖1-A;通過對比批次去除前后可視化PCA圖見圖1-B、C,認為數據批次去除效應良好。
2.2 DEGs篩選
根據篩選條件,發現胰腺癌組和CP組之間有178個DEGs,其中上調基因88個,下調基因90個,DEGs火山圖見圖1-D;下調和上調最顯著的前50個基因表達熱圖見圖1-E。
2.3 GO富集分析和KEGG通路富集分析
使用R軟件的ClusterProfiler程序包,分析上述DEGs的GO功能并富集KEGG通路,見圖2。GO分析結果顯示,上調基因主要參與病毒生命周期(viral life cycle)、細胞外結構組織(extracellular structure organization)、細胞外基質組織(extracellular matrix organization)等生物功能;下調基因主要參與組蛋白變性(histone madification)、染色質的共價修飾(covalent chromatin modification)等生物功能。KEGG通路富集分析結果顯示,上調基因主要富集在人乳頭瘤病毒感染(human papillomavirus infection)、志賀菌病(Shigellosis)、亨廷頓病(Huntington disease)和癌癥蛋白多糖(proteoglycans in cancer)通路;下調基因主要富集在絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路。
2.4 PPI網絡分析與關鍵DEGs篩選
將上述DEGs導入STRING數據庫進行PPI網絡分析,以TSV文件格式導出數據,再導入Cytoscape進行PPI網絡圖的構建,見圖3;利用CytoHubba插件,根據度值降序篩選網絡圖中相互作用程度較高的前20個基因作為關鍵基因,得到胰腺癌和CP的關鍵基因分別為鈣離子依賴的細胞黏附素1(cadherin 1,CDH1)、小泛素樣修飾蛋白- E2連接酶I(ubiquitin conjugating enzyme E2 I,UBE2I)、信號傳導轉錄激活因子1(signal transducer and activator of transcription 1,STAT1)、黏附連接相關蛋白紐蛋白(vinculin,VCL)、轉化生長因子B受體2(transforming growth factor beta receptor 2,TGFBR2)、環磷酸腺苷應答元件結合蛋白1(cAMP responsive element binding protein 1,CREB1)、染色質域解旋酶DNA結合蛋白4(chromodomain helicase DNA binding protein 4,CHD4)、β-2微球蛋白(beta-2-microglobulin,B2M)、組織抑制劑金屬蛋白酶-1(tissue inhibitor metalloproteinase-1,TIMP-1)、伴侶素包含T復合蛋白1ε亞基(chaperonin containing TCP1 subunit 5,CCT5)、RAS癌基因家族成員(member RAS oncogene family,RAN)、黏結蛋白聚糖1(syndecan 1,SDC1)、神經細胞黏附分子1(neural cell adhesion molecule 1,NCAM1)、苯丙氨酰-tRNA合成酶β(phenylalanyl-tRNA synthetase subunit beta,FARSB)、核不均一性核糖核蛋白L(heterogeneous nuclear ribonucleoprotein L,HNRNPL)、溶酶體相關膜蛋白3(lysosomal-associated membrane protein 3,CD63)、基質金屬蛋白酶2(matrix metallopeptidase 2,MMP2)、小泛素樣修飾物3(small ubiquitin like modifier 3,SUMO3)、整合素α3(integrin subunit alpha 3,ITGA3)、整合素β5(integrin subunit beta 5,ITGB5)。其中、、、、、、、、、、、、、為上調基因;、、、、、為下調基因。
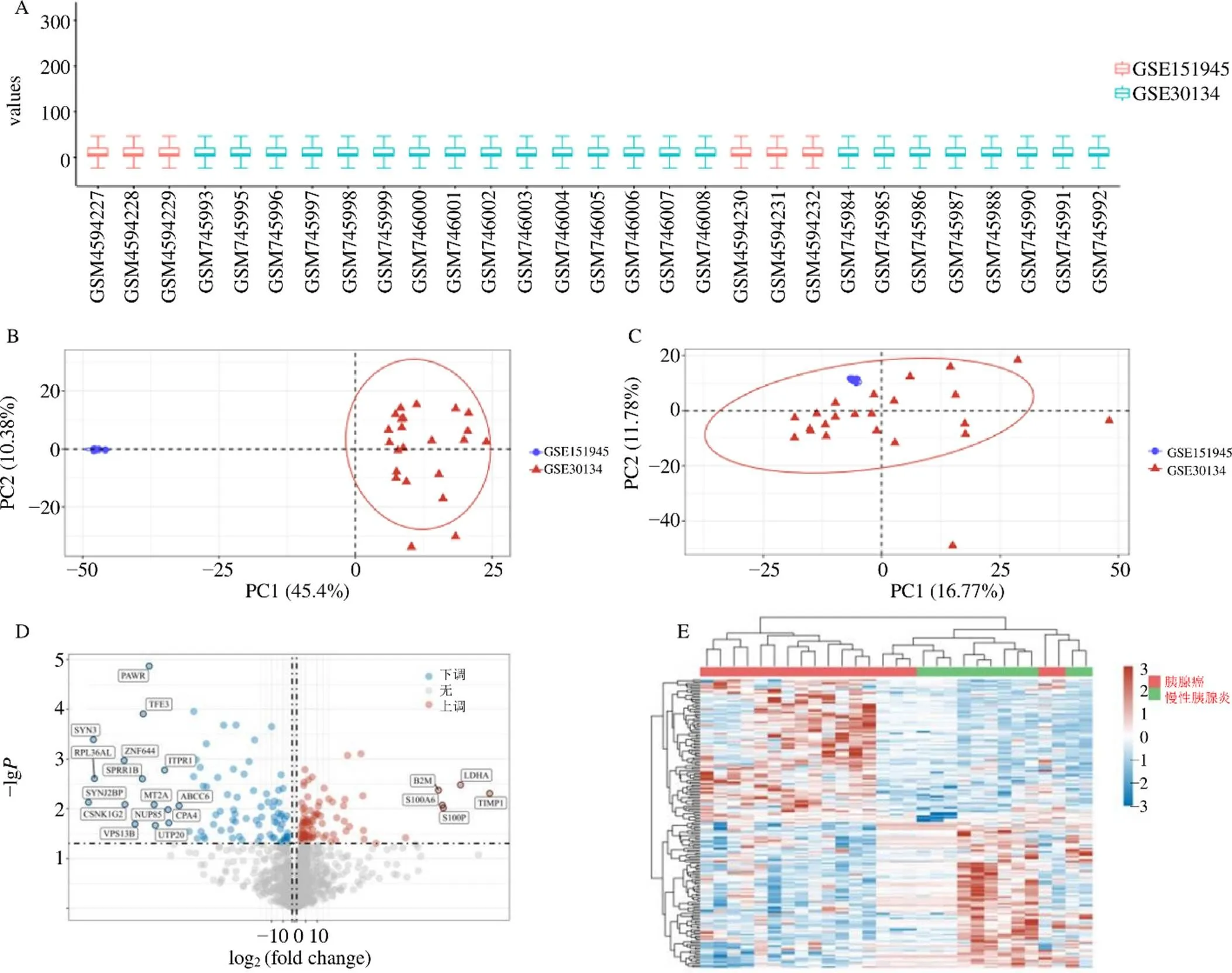
A-數據標準化后箱線圖 B-去批次前PCA圖 C-去批次后PCA圖 D-DEGs火山圖 E-下調和上調最顯著的前50個基因表達熱圖
2.5 關鍵基因的生存分析
對上述關鍵基因與胰腺癌的OS和DFS的相關性進行分析,以下7個基因(、、、、、和)顯著影響胰腺癌預后。其中、、、、高表達為OS的危險因素,高表達為OS的保護因素;、、、高表達為DFS的危險因素。上述基因對胰腺癌患者OS的Kaplan-Meier曲線見圖4,對胰腺癌患者DFS的Kaplan-Meier曲線見圖5。
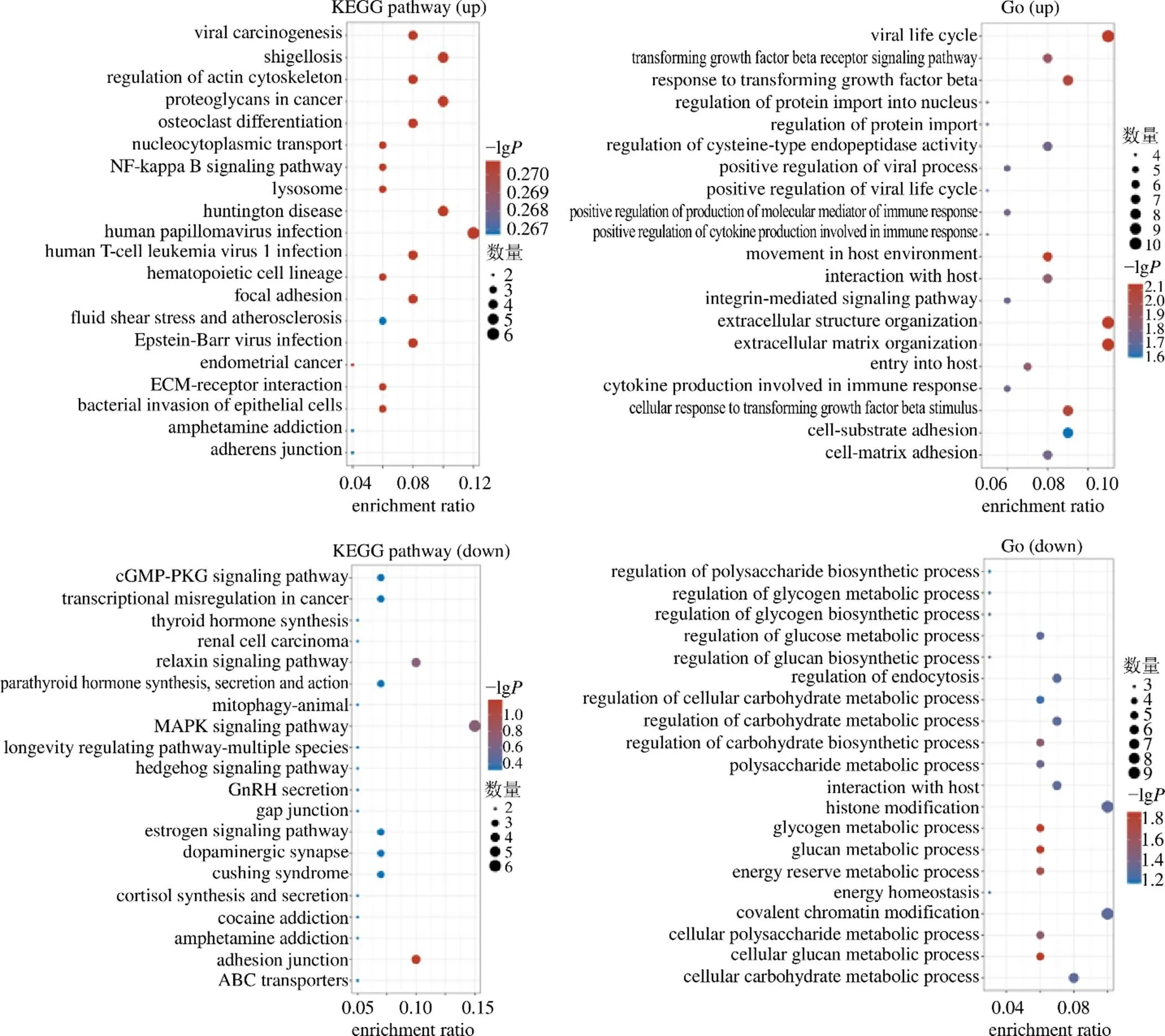
圖2 GO富集分析與KEGG通路富集分析
2.6 潛在治療中藥的預測
將以上7個基因與Coremine Medical數據庫映射,以<0.05為標準,得到潛在治療中藥,見表1。基于中醫藥理論分析,夏枯草、金錢草、生地、赤芍具有清熱燥濕、瀉火解毒、活血消癓的功效;紫蘇具有行氣寬中、止嘔的功效;菟絲子補益肝腎,兼走脾經,上述藥物在中醫臨床中常用于CP與胰腺癌的治療,故用于進一步分析[23-28]。從TCMSP數據庫中獲取上述6味中藥活性成分和作用靶點,得到85種有效成分,1439個作用靶點。在Uniprot數據庫中對上述成分作用靶點進行基因去重、規范化,并繪制“中藥-成分-靶點”網絡圖,見圖6。使用CytoHubba插件degree算法篩選出排列前25的靶點,并以不同色階進行展示,上述6味中藥的活性成分主要參與調控前列腺素氧化環化酶1(prostaglandin-endoperoxide synthase 1,PTGS1)、前列腺素氧化環化酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、核受體輔激活因子2(nuclear receptor coactivator 2,NCOA2)、孕酮受體(progesterone receptor,PGR)等基因,可能成為干預胰腺癌“炎-癌”發展過程的潛在中藥,見圖7。
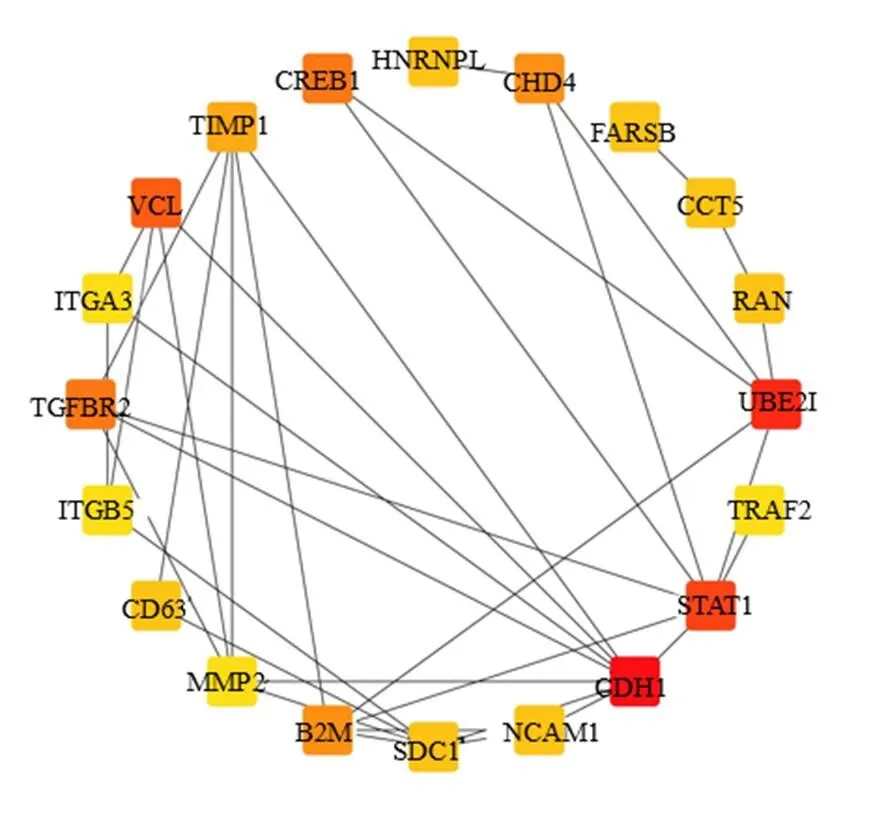
圖3 前20位關鍵基因編碼蛋白PPI網絡
3 討論
胰腺癌是惡性程度最高的腫瘤之一,是一種典型的炎癥驅動型癌癥,CP是其主要危險因素之一[29]。研究表明CP患者群體發生胰腺癌的概率較一般人群增加2.3~18.5倍,其中遺傳性胰腺炎是已知的最重要的胰腺癌危險因素[30-31]。最近在歐洲的一項隊列研究中,581名CP患者在5年隨訪中有6名確診胰腺癌,從診斷CP到胰腺癌發生的平均時間為5年[32]。CP癌變具體機制尚不明了,本研究通過GEO數據庫下載胰腺癌與CP患者基因芯片,通過R軟件分析DEGs,得到88個上調基因,90個下調基因。
通過GO和KEGG富集分析對DEGs進行功能注釋,分析其生物學過程,GO富集分析顯示,上調基因主要涉及病毒生命周期、細胞外結構組織、細胞外基質組織。溶瘤腺病毒被認為是胰腺癌治療的理想療法之一,其具有特異性感染并裂解腫瘤細胞的作用,具有靶向性好,不良反應少等優點[33],慢病毒載體在胰腺癌的抗腫瘤研究中廣為運用[34]。目前也有研究提出胰腺癌的發生可能與乙型肝炎病毒(hepatitis B,HBV)感染相關[35],且HBV感染者患胰腺癌的可能性增加24%[36],可能機制為HBV-X蛋白在胰腺組織內表達并通過磷脂酰肌醇-3-羥激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路促進胰腺癌的增殖與轉移[37]。因此,上調基因可能通過調節病毒感染介導的通路促進腫瘤的發生、增殖與轉移。下調基因主要參與組蛋白變性、染色質的共價修飾。組蛋白賴氨酸甲基轉移酶2D(lysine methyltransferase 2D,KMT2D)下調可促進胰腺癌細胞生長,抑癌基因含有WW結構域的氧化還原酶(WW domain containing oxidoreductase,)甲基化導致其表達下調,也是胰腺癌發生的機制之一[38-39]。因此,下調基因可能通過誘導組蛋白變性使DNA構象改變,導致轉錄異常而引起胰腺癌的發生。
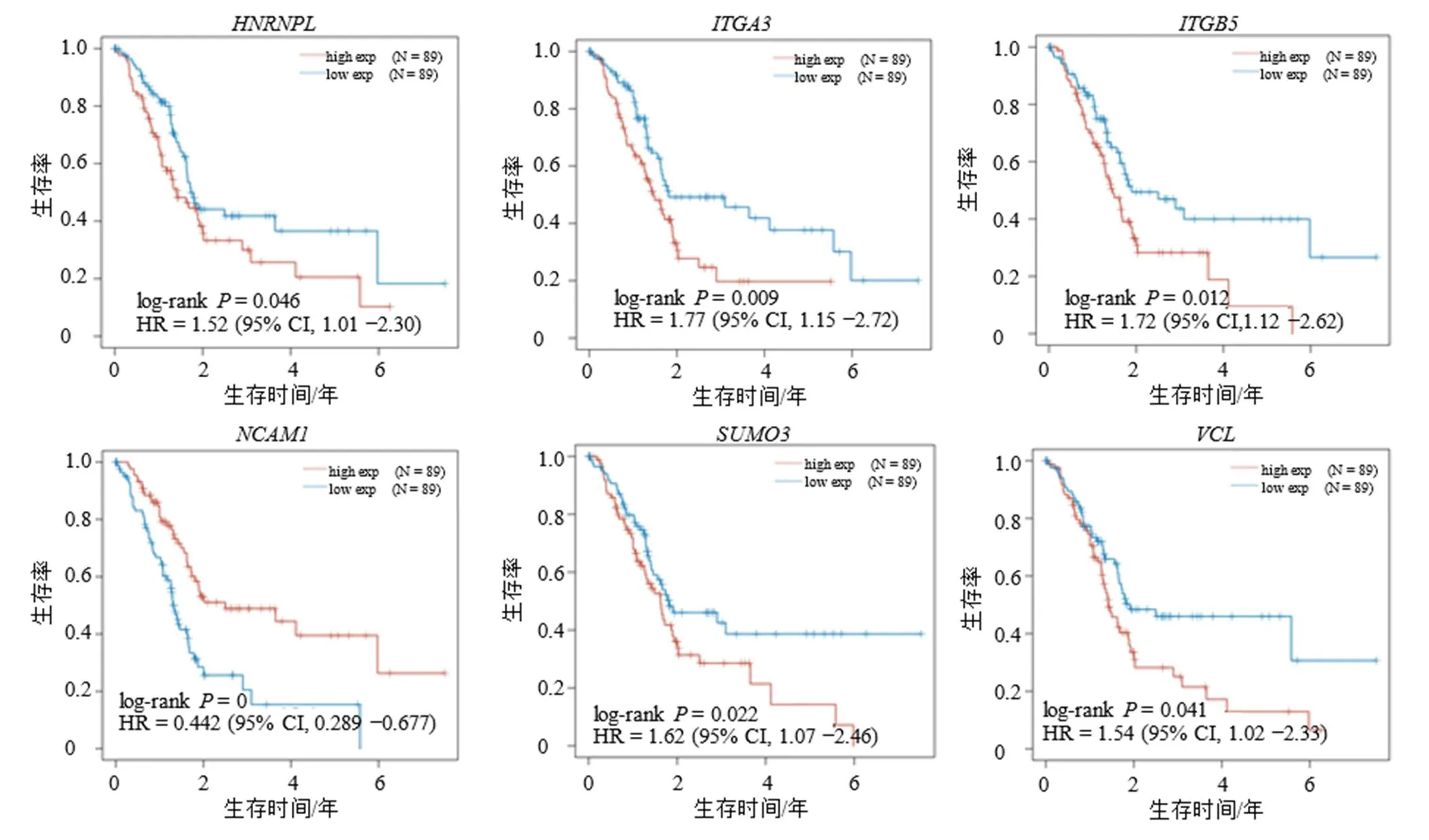
圖4 關鍵基因對胰腺癌OS的影響
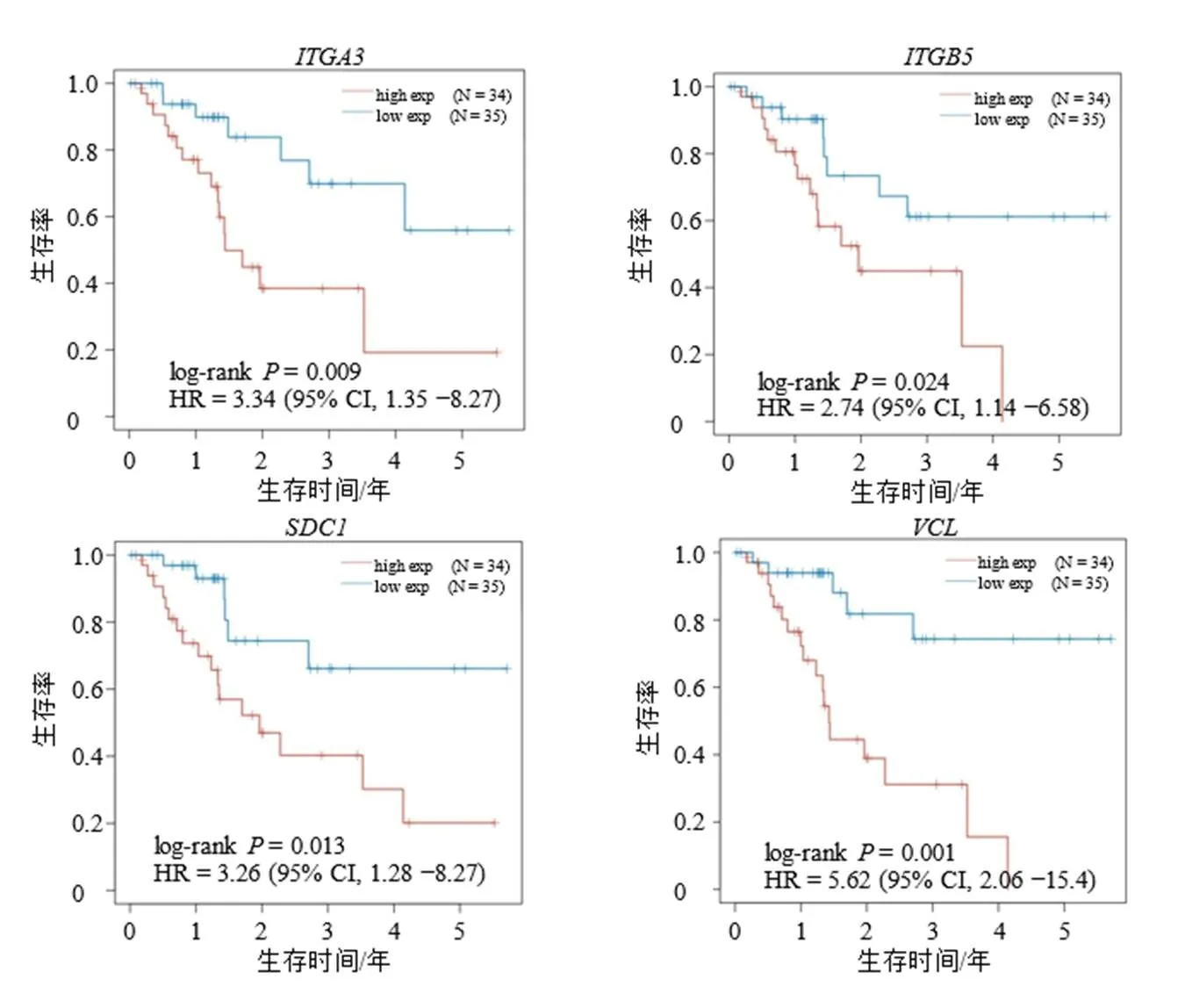
圖5 關鍵基因對胰腺癌DFS的影響

表1 關鍵基因中藥預測
KEGG通路富集分析結果顯示,上調基因主要富集在人乳頭瘤病毒感染、志賀菌病,亨廷頓病和癌癥蛋白多糖通路。人乳頭瘤病毒(human papillomavirus,HPV)與全球5.5%的癌癥相關,HPV感染后基因插入宿主細胞DNA為其主要機制,據報道,PC的發生可能與HPV的感染有關[40-42]。志賀菌是一種革蘭陰性菌,感染后易引起人體出現腹瀉、發燒、胃部痙攣等癥狀[43],據Khodavirdipour等[44]報道,Flexneri志賀菌在胰腺癌中具有潛在的抗細胞增殖作用,其可能機制為上調Bcl-2-相關X蛋白(Bcl-2 associated X protein,Bax)及下調B淋巴細胞瘤-2(B-cell lymphoma-2,Bcl-2)表達。研究表明,人亨廷頓相互作用蛋白可選擇性表達于人胰島中,對胰島分泌功能起著一定的調節作用[45-47]。蛋白多糖(proteoglycans, PGs)是一種含有長而不分硫支共價結合重復二糖長鏈的糖蛋白,在細胞中和細胞外基質中含量豐富,并在發育和病理生理學中發揮多種作用[48]。PGs與腫瘤發生過程相關,主要影響腫瘤細胞增殖、黏附、遷移和侵襲能力,同時對腫瘤血管生成具有促進或抑制作用[49]。研究表明,在胰腺癌的發生中,硫酸軟骨素蛋白多糖4(chondroitin sulfate proteoglycan 4,CSPG4)和磷脂酰肌醇蛋白多糖-1(glypican-1,GPC-1)起著重要作用[50-52]。差異下調基因主要富集在MAPK信號通路,該通路是真核生物信號傳遞網絡中的重要途徑之一,在基因表達調控和細胞質功能活動中發揮關鍵作用[53]。鼠類肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,)突變激活MAPK通路,是胰腺癌起始和進展的關鍵遺傳驅動因素[54-55],通路上的鼠類肉瘤濾過性毒菌致癌同源體(V-Raf murine sarcoma viral oncogene homolog,RAF)、絲裂原活化的蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)、細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun amino terminal kinase,JNK)等信號的激活對于胰腺癌的發生具有促進作用[56-58]。

六邊形-各中藥獨有成分 正方形-2種及以上中藥的共同成分 菱形-靶點,圖7同
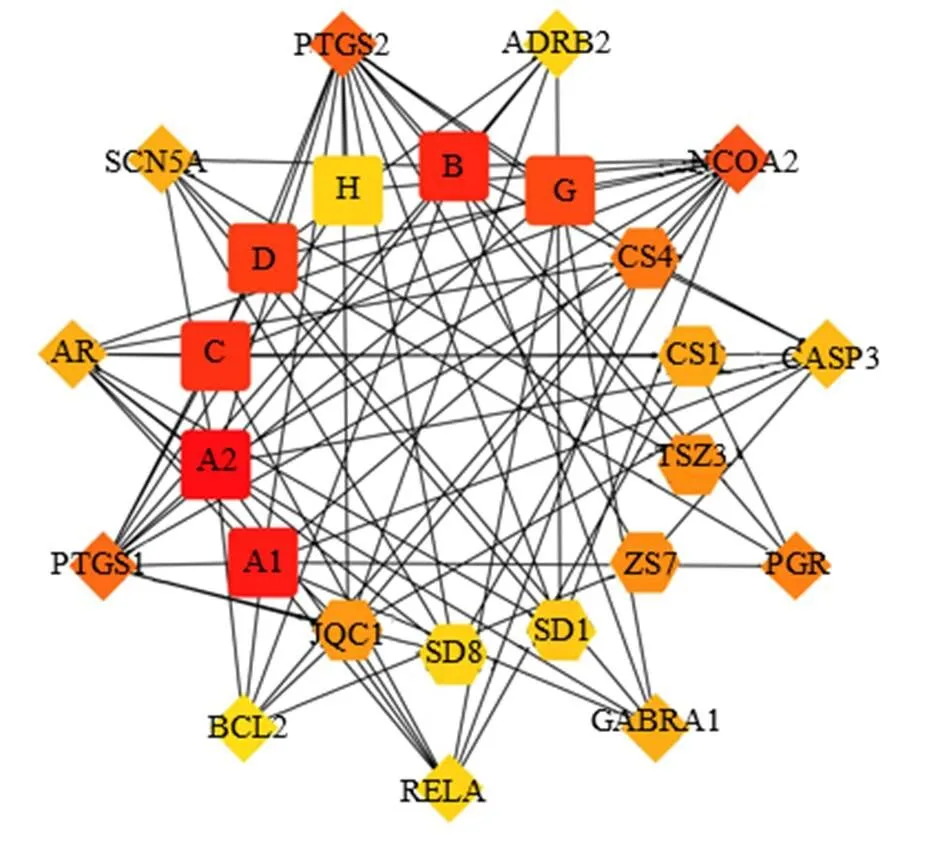
圖7 預測中藥干預胰腺癌“炎-癌”進展的關鍵靶點
為了進一步研究DEGs與胰腺癌之間的關系,通過PPI分析篩選出20個關鍵基因,對上述關鍵基因與胰腺癌的OS和DFS的相關性進行分析,結果發現、、、、高表達為OS的危險因素,高表達為OS的保護因素;、、、高表達為DFS的危險因素,這與其他研究結果基本一致,互相映證,從側面體現了本研究具有較高的可信度[59-64]。其中可能是胰腺癌的保護因素,但有待進一步驗證,可以確定的是,是一種神經細胞黏附分子,在細胞黏附和發育過程中具有調節作用。近期的一項研究表明成釉細胞瘤組織中高表達的可抑制細胞遷移,從而起到抗成釉細胞瘤作用[65]。的過度表達通過抑制長鏈非編碼RNA1060(long intergenic non-protein coding RNA 1060,Linc01060)的表達來促進胰腺癌細胞的增殖和侵襲,同時可通過上調ERK的表達來加速胰腺癌細胞增殖[66]。表達上調可促進上皮間充質轉化(epithelial mesenchymal transition,EMT)過程,從而提高胰腺癌細胞遷移率[67]。SUMO信號通路與原癌基因相連通,可以導致低分化程度胰腺癌的發生,但其具體機制仍不明確[68]。和是細胞表面基質受體,與細胞外基質一同介導致癌信號傳導,其表達增高可促進胰腺癌細胞的遷移和侵襲能力[69-70]。的高表達可上調成纖維細胞生長因子2(fibroblast growth factor 2,FGF2)的表達,從而促進胰腺癌細胞的侵襲和轉移[71]。眾多基因顯著影響胰腺癌的預后,進一步說明胰腺癌的致病分子具有復雜性和多樣性,未來的研究任重而道遠。
中醫藥作為我國的傳統醫學,經歷了數千年的實踐檢驗,對于胰腺癌的治療具有一定的特色。鑒于此,將上述顯著影響胰腺癌預后的基因輸入Coremine Medical數據庫,按照臨床常用原則篩選出夏枯草、金錢草、赤芍、生地、紫蘇、菟絲子6味中藥。為了進一步探索這6味中藥治療胰腺癌的機制,進行了網絡藥理學分析,結果發現這些中藥主要通過調控、、、等基因發揮作用。胰腺癌的發生與中焦脾胃關系密切,其證候特征是本虛標實,本虛為臟腑元氣虛弱,以脾虛為主;標實為肝郁、濕熱、痰瘀[72]。臨床治療以疏肝健脾、活血化瘀、清熱燥濕為主。夏枯草、金錢草、赤芍、紫蘇、生地和菟絲子均屬于上述治則范疇,現代藥理研究表明,這些藥物的有效成分具有抗腫瘤、抗炎、抗氧化的作用[73-77]。宋瑋等[78]發現夏枯草注射液可以通過調控胰腺癌的Bcl-2家族基因表達,使人胰腺癌PANC-1細胞Bax表達上調和Bcl-2表達下調,從而促進胰腺癌細胞凋亡并抑制其增殖。Matos等[79]發現紫蘇的有效成分紫蘇醇能促進胰腺癌患者腫瘤細胞凋亡。黃巍等[80]發現赤芍的有效成分芍藥苷可通過激活Caspase途徑抑制Panc-1細胞的增殖并促進其凋亡,從而達到抗胰腺癌效果。葉春林等[77]發現菟絲子多糖能抑制PANC-1細胞生長,且呈濃度相關性。進一步說明了本研究的藥物預測結果符合中醫對胰腺癌的認識,符合臨床實際,具有較高的可信度。然而其具體機制仍不明確,有待深入挖掘,而本研究通過網絡藥理學預測出來中藥通過調節PTGS1、PTGS2、NCOA2、PGR等靶點從而達到防治胰腺癌的作用,不失為一個有意義的研究方向。
4 結論
本研究通過對胰腺癌及PC基因芯片的數據挖掘及生物信息學分析,篩選出胰腺癌“炎-癌”轉化的20個關鍵基因,發現病毒生命周期、細胞外結構組織、細胞外基質組織、染色質的共價修飾、癌癥蛋白多糖和MAPK等生物過程和信號通路等在胰腺癌癌變中起著關鍵作用。夏枯草、金錢草、生地、赤芍、紫蘇、菟絲子及其活性成分可能通過多靶點實現抗胰腺癌作用。為后續胰腺癌發生發展機制及其潛在治療藥物的研究提供了新的研究方向。基因芯片技術和網絡藥理學的出現為中醫藥的發展帶來了新的契機,通過生物信息學技術挖掘疾病潛在靶點,通過網絡藥理學提取中藥作用靶點,為中醫藥現代化發展提供了新的思路和方向。
利益沖突 所有作者均聲明不存在利益沖突
[1] Moore A, Donahue T. Pancreatic cancer [J]., 2019, 322(14): 1426.
[2] Bray F, Ferlay J, Soerjomataram I,. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2018, 68(6): 394-424.
[3] 楊軍, 李賀, 鄭榮壽, 等. 2014年中國胰腺癌發病與死亡分析 [J]. 中國腫瘤, 2018, 27(6): 420-425.
[4] 楊歡, 王曉坤, 范金虎. 中國胰腺癌流行病學、危險因素及篩查現況 [J]. 腫瘤防治研究, 2021, 48(10): 909-915.
[5] Duell E J, Lucenteforte E, Olson S H,. Pancreatitis and pancreatic cancer risk: A pooled analysis in the International Pancreatic Cancer Case-Control Consortium (PanC4) [J]., 2012, 23(11): 2964-2970.
[6] Huang C, Iovanna J, Santofimia-Casta?o P. Targeting fibrosis: The bridge that connects pancreatitis and pancreatic cancer [J]., 2021, 22(9): 4970.
[7] 李春艷, 胡勇, 崔云峰. 慢性炎癥與胰腺導管腺癌關系的研究進展 [J]. 中華肝膽外科雜志, 2019, 25(8): 636-640.
[8] Gumpper K, Dangel A W, Pita-Grisanti V,. Lipocalin-2 expression and function in pancreatic diseases [J]., 2020, 20(3): 419-424.
[9] Schaeffer D F, Owen D R, Lim H J,. Insulin-like growth factor 2 mRNA binding protein 3 (IGF2BP3) overexpression in pancreatic ductal adenocarcinoma correlates with poor survival [J]., 2010, 10: 59.
[10] Abiatari I, Gillen S, DeOliveira T,. The microtubule-associated protein MAPRE2 is involved in perineural invasion of pancreatic cancer cells [J]., 2009, 35(5): 1111-1116.
[11] Tan L P, Ye X, Zhou Y,. Macrophage migration inhibitory factor is overexpressed in pancreatic cancer tissues and impairs insulin secretion function of β-cell [J]., 2014, 12: 92.
[12] Gao J, Song J, Huang H J,. Methylation of thegene promoter and its clinical implication in pancreatic cancer [J]., 2010, 29: 28.
[13] Mohamed A, Saad Y, Saleh D,. Can Serum ICAM 1 distinguish pancreatic cancer from chronic pancreatitis? [J]., 2016, 17(10): 4671-4675.
[14] 吳小倩, 黃偉芳, 孔德松, 等. 基于生物信息學探討丹參酮IIA治療潰瘍性結腸炎及其機制 [J]. 中國藥理學通報, 2021, 37(12): 1750-1756.
[15] 李勇. 胰腺癌新藥再次敗北后來者越挫越勇 [N]. 醫藥經濟報, 2021-11-22(F03).
[16] 徐曉青, 余亞萍, 王炳淑, 等. 基于網絡藥理學的黨參抗胰腺癌機制研究 [J]. 海南醫學院學報, 2022, 28(12): 939-948.
[17] 盧丹, 彭小蘭, 熊珊, 等. 高良姜素促進胰腺癌PCNA-1細胞凋亡和自噬并抑制移植瘤生長 [J]. 廣州中醫藥大學學報, 2021, 38(9): 1963-1971.
[18] 劉福棟, 龐博, 花寶金. 基于中醫經典與人用經驗構建胰腺癌防治方藥發掘體系思路探析 [J]. 北京中醫藥, 2021, 40(9): 929-933.
[19] 贠張君, 王慧靜, 俞儀萱, 等. 基于生物信息學技術篩選結直腸癌的差異基因和中藥預測研究 [J]. 中國中藥雜志, 2022, 47(6): 1666-1676.
[20] 周宙, 王震, 劉楊, 等. 心肌纖維化關鍵基因與通路的研究及有效中藥預測[J]. 海南醫學院學報, doi: 10.13210/j.cnki.jhmu.20210516.001.
[21] 張道平, 劉起立, 姚昆鵬, 等. 基于生物信息學分析肝癌差異基因及潛在的中藥干預 [J]. 中草藥, 2022, 53(3): 788-798.
[22] 王葦, 郭媛媛, 連雅君, 等. 基于網絡藥理學探討枳實薤白桂枝湯治療肺栓塞的作用機制 [J]. 中國醫院用藥評價與分析, 2021, 21(3): 262-268.
[23] 許欣欣. 消化道惡性腫瘤的用藥規律研究及典型案例介紹[D]. 濟南: 山東中醫藥大學, 2020.
[24] 張燕娜, 左明煥, 王子卿, 等. 基于數據挖掘探討王沛治療胰腺癌的用藥規律[J]. 世界中醫藥, 2021, 16(06): 924-928.
[25] 紀曉丹. 蔣健教授基于“治未病”理念對“胰腺炎、膽囊炎膽石癥、尿路感染以及復發性口腔潰瘍”防治策略探討 [D]. 上海: 上海中醫藥大學, 2019.
[26] 丁鈮. 基于數據挖掘技術探討胰腺癌臨床用藥規律的研究 [D]. 濟南: 山東中醫藥大學, 2016.
[27] 黃蓉, 張培彤, 李鳳杰. 基于數據挖掘的中藥湯劑聯合化療治療胰腺癌的用藥規律分析 [J]. 世界科學技術—中醫藥現代化, 2021, 23(10): 3719-3726.
[28] 劉二委, 鄭功澤, 丁世芹. 益氣活血解毒方聯合GEMOX方案治療晚期胰腺癌46例 [J]. 中醫研究, 2021, 34(4): 32-37.
[29] Multhoff G, Molls M, Radons J. Chronic inflammation in cancer development [J]., 2011, 2: 98.
[30] Kong X Y, Sun T, Kong F Y,. Chronic pancreatitis and pancreatic cancer [J]., 2014, 1(3): 123-134.
[31] Schneider A, Whitcomb D C. Hereditary pancreatitis: A model for inflammatory diseases of the pancreas [J]., 2002, 16(3): 347-363.
[32] Vujasinovic M, Dugic A, Maisonneuve P,. Risk of developing pancreatic cancer in patients with chronic pancreatitis [J]., 2020, 9(11): E3720.
[33] 鄒秀文, 沈藝南, 郭成祥, 等. 溶瘤病毒治療胰腺癌新進展 [J]. 中華消化外科雜志, 2020, 19(8): 892-896.
[34] 衛海燕, 鄭新宇, 王國洲, 等. 維甲酸誘導2基因表達上調抑制胰腺癌SW1990細胞裸鼠皮下移植瘤的生長 [J]. 中華實驗外科雜志, 2021, 38(8): 1527-1529.
[35] Liu T, Song C H, Zhang Y C,. Hepatitis B virus infection and the risk of gastrointestinal cancers among Chinese population: A prospective cohort study [J]., 2022, 150(6): 1018-1028.
[36] Desai R, Patel U, Sharma S,. Association between hepatitis B infection and pancreatic cancer: A population-based analysis in the United States [J]., 2018, 47(7): 849-855.
[37] Chen Y W, Bai X L, Zhang Q,. The hepatitis B virus X protein promotes pancreatic cancer through modulation of the PI3K/AKT signaling pathway [J]., 2016, 380(1): 98-105.
[38] 趙玉, 潘新宇, 于建渤. 賴氨酸甲基轉移酶2D與人類腫瘤的關系 [J]. 診斷病理學雜志, 2020, 27(3): 209-211.
[39] 陳廣, 魏東, 王滔, 等. 抑癌基因WWOX甲基化與腫瘤的研究進展 [J]. 重慶醫科大學學報, 2021, 46(1): 5-9.
[40] Schottenfeld D, Beebe-Dimmer J L. Advances in cancer epidemiology: Understanding causal mechanisms and the evidence for implementing interventions [J]., 2005, 26: 37-60.
[41] Wentzensen N, Vinokurova S, von Knebel Doeberitz M. Systematic review of genomic integration sites of human papillomavirus genomes in epithelial dysplasia and invasive cancer of the female lower genital tract [J]., 2004, 64(11): 3878-3884.
[42] Sohrabi E, Rezaie E, Heiat M,. An integrated data analysis of mRNA, miRNA and signaling pathways in pancreatic cancer [J]., 2021, 59(5): 1326-1358.
[43] Kotloff K L, Riddle M S, Platts-Mills J A,. Shigellosis [J]., 2018, 391(10122): 801-812.
[44] Khodavirdipour A, Jamshidi F, Nejad H R,. To study the anti-cancer effects ofin AspC-1 pancreatic cancer cell line in approach to bax and bcl-2 genes [J]., 2021, 52(2): 593-599.
[45] 胡志為, 黃婷, 劉艷霞, 等. 人亨廷頓相互作用蛋白14在1型糖尿病發病中的作用 [J]. 河南醫學研究, 2014, 23(4): 6-8.
[46] 劉晶晶, 陳櫻花, 陳小偉, 等. 鏈脲佐菌素敏感的胰島細胞表達亨廷頓蛋白相關蛋白1 [J]. 解剖學報, 2006, 37(3): 299-302.
[47] Liao M, Chen X X, Han J H,. Selective expression of Huntingtin-associated protein 1 in{beta}-cells of the rat pancreatic islets [J]., 2010, 58(3): 255-263.
[48] 曹峻嶺. 蛋白聚糖與軟骨結構、功能及骨關節病的關系 [J]. 西安交通大學學報: 醫學版, 2012, 33(2): 131-136.
[49] 樊江浩, 劉揆亮, 吳靜. 蛋白多糖在腫瘤血管生成中的作用 [J]. 臨床與病理雜志, 2016, 36(4): 515-519.
[50] 孫靖, 盧樂樂, 賴潔娟, 等. 胰腺癌組織中硫酸軟骨素蛋白多糖4的表達及其臨床意義 [J]. 第三軍醫大學學報, 2015, 37(8): 787-791.
[51] 張泉東, 金政錫, 郝迪斯. 磷脂酰肌醇蛋白多糖-1與趨化因子受體CXCR7在胰腺癌中的表達及臨床意義 [J]. 國際免疫學雜志, 2014, 37(2): 157-160.
[52] Melo S A, Luecke L B, Kahlert C,. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer [J]., 2015, 523(7559): 177-182.
[53] Qi M, Elion E A. MAP kinase pathways [J]., 2005, 118(16): 3569-3572.
[54] Hingorani S R, Petricoin E F, Maitra A,. Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse [J]., 2003, 4(6): 437-450.
[55] Luchini C, Paolino G, Mattiolo P,. KRAS wild-type pancreatic ductal adenocarcinoma: Molecular pathology and therapeutic opportunities [J]., 2020, 39(1): 227.
[56] Hanrahan A J, Solit D B. RAF/MEK dependence of KRAS-mutant pancreatic ductal adenocarcinomas [J]., 2012, 2(8): 666-669.
[57] Liu Y, Li F, Gao F,. Periostin promotes tumor angiogenesis in pancreatic cancer via Erk/VEGF signaling [J]., 2016, 7(26): 40148-40159.
[58] Liu L, Aleksandrowicz E, Sch?nsiegel F,. Dexamethasone mediates pancreatic cancer progression by glucocorticoid receptor, TGFβ and JNK/AP-1 [J]., 2017, 8(10): e3064.
[59] Islam S, Kitagawa T, Azuma T,. The expression levels of vinculin in pancreatic cancer tissues significantly correlates with patient survival [J]., 2021, 41(10): 4979-4984.
[60] Pan L, Huang X D, Liu Z X,. Inflammatory cytokine-regulated tRNA-derived fragment tRF-21 suppresses pancreatic ductal adenocarcinoma progression [J]., 2021, 131(22): e148130.
[61] Biederst?dt A, Hassan Z, Schneeweis C,. SUMO pathway inhibition targets an aggressive pancreatic cancer subtype [J]., 2020, 69(8): 1472-1482.
[62] Liu M Y, Zhang Y Q, Yang J X,. ZIP4increases expression of transcription factor ZEB1 to promote integrin α3β1 signaling and inhibit expression of the gemcitabine transporter ENT1 in pancreatic cancer cells [J]., 2020, 158(3): 679-692.
[63] Zhuang H K, Zhou Z X, Ma Z Y,. Characterization of the prognostic and oncologic values of ITGB superfamily members in pancreatic cancer [J]., 2020, 24(22): 13481-13493.
[64] Yao W T, Rose J L, Wang W,. Syndecan 1 is a critical mediator of macropinocytosis in pancreatic cancer [J]., 2019, 568(7752): 410-414.
[65] Guan G Y, Niu X, Qiao X,. Upregulation of neural cell adhesion molecule 1 (NCAM1) by hsa-miR-141-3p suppresses ameloblastoma cell migration [J]., 2020, 26: e923491.
[66] Shi X H, Guo X J, Li X,. Loss of Linc01060 induces pancreatic cancer progression through vinculin-mediated focal adhesion turnover [J]., 2018, 433: 76-85.
[67] Qiao L, Xie N, Bai Y R,. Identification of upregulated HNRNPs associated with poor prognosis in pancreatic cancer [J]., 2019, 2019: 5134050.
[68] Biederst?dt A, Hassan Z, Schneeweis C,. SUMO pathway inhibition targets an aggressive pancreatic cancer subtype [J]., 2020, 69(8): 1472-1482.
[69] Kurozumi A, Goto Y, Matsushita R,. Tumor-suppressive microRNA-223 inhibits cancer cell migration and invasion by targeting ITGA3/ITGB1 signaling in prostate cancer [J]., 2016, 107(1): 84-94.
[70] Idichi T, Seki N, Kurahara H,. Involvement of anti-tumor miR-124-3p and its targets in the pathogenesis of pancreatic ductal adenocarcinoma: Direct regulation of ITGA3 and ITGB1 by miR-124-3p [J]., 2018, 9(48): 28849-28865.
[71] Chen X D, Zhao H C, Chen C Z,. The HPA/SDC1 axis promotes invasion and metastasis of pancreatic cancer cells by activating EMT via FGF2upregulation [J]., 2020, 19(1): 211-220.
[72] 關紫, 黃學武, 顏培宇. 中醫藥治療胰腺癌研究進展 [J]. 四川中醫, 2020, 38(4): 217-221.
[73] 王君明, 代永霞, 陳玉龍, 等. 雷公藤與金錢草配伍抗食管癌作用的組成配比及其劑量效應關系研究[J]. 中國全科醫學, 2015, 18(36): 4496-4500.
[74] 張金華, 邱俊娜, 王路, 等. 夏枯草化學成分及藥理作用研究進展[J]. 中草藥, 2018, 49(14): 3432-3440.
[75] 唐瑰琦, 嚴東, 夏伯候, 等. 夏枯草不同藥用部位抗炎活性的比較及其有效部位的篩選 [J]. 中藥與臨床, 2021, 12(1): 19-21.
[76] 陸小華, 馬驍, 王建, 等. 赤芍的化學成分和藥理作用研究進展[J]. 中草藥, 2015, 46(4): 595-602.
[77] 葉春林, KHUDOYBERDIEV Ilkhomjon, 陳穎, 等. 菟絲子多糖的抗氧化活性和抑制腫瘤細胞增殖的研究 [J]. 河南工業大學學報: 自然科學版, 2020, 41(5): 73-78.
[78] 宋瑋, 張炳太, 萬云杰, 等. 夏枯草注射液對胰腺癌細胞PANC-1凋亡的影響及機制研究 [J]. 中外醫療, 2012, 31(24): 26.
[79] Matos J M, Schmidt C M, Thomas H J,. A pilot study of perillyl alcohol in pancreatic cancer [J]., 2008, 147(2): 194-199.
[80] 黃巍, 孫誠誼, 喻超, 等. 芍藥苷對人胰腺癌Panc-1細胞系增殖和凋亡的影響 [J]. 貴州醫科大學學報, 2018, 43(8): 874-878.
Screening of key genes for “inflammation-cancer” transformation of pancreatic cancer and predictive analysis of intervening traditional Chinese medicine
XIAO Xiang, WU Xuan-yu
Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China
To screen the differentially expressed genes (DEGs) between pancreatic cancer (PC) and chronic pancreatitis (CP) tissues through bioinformatics techniques, in order to predict the traditional Chinese medicine (TCM) that can interfere with the “inflammation-cancer” transformation process and their the potential therapeutic targets and mechanisms.GSE151945 and GSE30134 gene chips were obtained from Gene Expression Omnibus (GEO), and R software was applied to normalize the data, screen DEGs, and perform gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG) enrichment analysis. The protein-protein interaction network was constructed by STRING database, the protein-protein interaction network map was created by Cytoscape, and the hub genes were screened by CytoHubba plug-in. R software was used to analyze the effect of the hub gene on the survival analysis of pancreatic cancer and screen for genes that significantly affect the prognosis of pancreatic cancer, visualized by Kaplan-Meier curves. The above genes were mapped with Coremine Medical database to predict potential therapeutic TCM. The chemical components of the TCM were obtained from TCMSP and TCMID databases. The network diagram of “TCM-component-target” was constructed by Cytoscape, and the key targets were screened by CytoHubba plug-in.A total of 178 DEGs were screened, including 88 up-regulated and 90 down-regulated genes. DEGs were mainly involved in biological functions such as virus life cycle, extracellular structure, extracellular matrix organization, and covalent modification of chromatin. KEGG pathway analysis showed that DEGs were mainly enriched in human papillomavirus infection, shigellosis, Huntington’s disease, cancer proteoglycan, and mitogen-activated protein kinase (MAPK) signaling pathway. A total of 20 hub genes were obtained, and survival analysis showed that adhesion-linkage-associated protein nucleoprotein vinculin (), heterogeneous nuclear ribonucleoprotein L (L), small ubiquitin like modifier 3 (), integrin subunit alpha 3 (), integrin subunit beta 5 (), syndecan 1(), and neural cell adhesion molecule 1 () significantly affected the prognosis of PC. The potential TCMs that can interfere with the “inflammation-cancer” transformation process of PC include Xiakucao (),Jinqiancao (),Zisu (),Shengdi (),Chishao (),Tusizi ().The transformation mechanism of “inflammation-cancer” of PC is complex, and TCM can interfere with the “inflammation-cancer” transformation process of PC through multiple targets. This study will provide a reference direction for the study of the pathogenesis and therapeutic agents of PC.
chronic pancreatitis; pancreatic cancer; bioinformatics; prediction of traditional Chinese medicine;;;(L.) Britt.;;;
R285
A
0253 - 2670(2022)15 - 4795 - 12
10.7501/j.issn.0253-2670.2022.15.023
2022-02-18
成都中醫藥大學大學生科研實踐創新課題(ky-2021049,ky-2022004)
肖 祥,男,本科在讀,研究方向為中醫學。E-mail: xxiangtcm@163.com
通信作者:吳宣諭,女,研究方向為中醫學。E-mail: w_syuanyu@163.com
[責任編輯 潘明佳]