納豆激酶的微生物生產及其生理功能的研究進展
姚明靜,楊 楊,范 婧,趙祥穎,任麗琨,邊 鑫,邢童林,朱鵬宇,孫智慧,張 娜,
(1.哈爾濱商業大學食品工程學院,黑龍江省食品科學與工程重點實驗室,黑龍江哈爾濱 150076;2.齊魯工業大學(山東省科學院)山東省食品發酵工業研究設計院,山東省食品發酵重點實驗室,山東濟南 250013)
隨著人們生活水平的提高,人們的飲食方式發生了改變,肉類、脂肪類攝入量增加,膳食纖維、果蔬攝取減小,由此引發了心血管疾病、肥胖癥和糖尿病等慢性疾病[1],尤其是心血管疾病,已成為人類健康第一大殺手,每年約有1790 萬患者死于該病,占全世界死亡率的31%(World Health Statistics,2019)。在心血管疾病患者中,85%的患者死于心臟病和中風,而血栓的形成是是心臟病和中風的重要誘因,因此,血栓的治療引起了科研工作者廣泛的關注。目前已有的溶栓藥物鏈激酶、尿激酶、單鏈尿激酶型纖溶酶原激活劑(scu-PA)、組織型纖溶酶原激活劑(t-PA)等具有半衰期短、特異性差等缺陷,可能會造成局部出血等副作用,因此,開發半衰期長、特異性強的新型溶栓酶具有重大的現實意義。
納豆激酶(Nattokinase,簡稱NK)(EC 3.4.21.62),又被稱為枯草桿菌蛋白酶NAT(subtilisin NAT),最初由日本科研人員Sumi 在1987 年研究納豆時發現[2]。納豆激酶可直接水解纖維蛋白,半衰期長、特異性強、副作用小,且在胃腸道內可保持穩定,因此,納豆激酶成為溶栓藥物的新熱點。研究發現,納豆激酶是由納豆中的Bacillus subtilis(natto)分泌而來,是一種堿性絲氨酸蛋白酶[3],等電點為8.6±0.3,在pH6~12 時可保持良好的纖溶活性,最適pH8.0,在酸性條件下活性和穩定性較差,當pH 低于3 時,酶活性徹底喪失[2]。NK 在低溫環境中(60 ℃以下)更穩定,反復凍融5 個循環,仍可保持95%的酶活力,但是熱穩定性差,當環境溫度高于60 ℃時,酶會迅速失活[4-5]。此外,野生型Bacillus subtilis(natto)產納豆激酶的產量較低,導致納豆激酶價格較高,限制了其的大范圍應用。目前國內外學者分別從菌種選育、培養基優化、基因工程和蛋白質工程改造等方面入手,以期提高納豆激酶產量、改善納豆激酶的酸穩定性和熱穩定性。
隨著對納豆激酶研究的深入,人們發現納豆激酶不僅具有溶栓的功效,還可以預防血栓的形成。此外,納豆激酶在降血壓[6-7]、降血脂[8-9]、治療鼻竇炎[10]等方面也有明顯的生理功效。因此,本文結合近年來國內外的相關研究成果,詳述了納豆激酶的結構特征、纖溶活性和抗血栓活性的作用機制,總結了納豆激酶在提高酶活性和穩定性,提升產量方面有關生產菌株選育、發酵優化、工程菌株改造以及酶固定化等方面的進展,闡述了納豆激酶的生理功能,最后對納豆激酶應用面臨的挑戰和未來發展趨勢進行了展望,以期為納豆激酶的進一步研究提供理論依據。
1 納豆激酶的簡介
1.1 納豆激酶的結構
納豆激酶是一種絲氨酸蛋白酶,屬于絲氨酸蛋白酶S8 家族。aprN基因為NK 的編碼基因,長度為0.8 kb,以GTG 為起始密碼子,共編碼381 個氨基酸,包含引導蛋白質分泌的信號肽序列(29 個氨基酸),幫助蛋白質正確折疊的分子伴侶前導肽(77 個氨基酸),以及最終產生的納豆激酶成熟肽(275 個氨基酸)[5]。NK 為一條單鏈多肽,分子內不含半胱氨酸,因此無二硫鍵,成熟肽的分子量為27.7 kDa[11]。NK 成熟肽的氨基酸序列與其他枯草桿菌蛋白酶序列高度同源,如與枯草桿菌蛋白酶E(Subtilisin E)、枯草桿菌蛋白酶BPN’(Subtilisin BPN’)、枯草桿菌蛋白酶Carlsberg(Subtilisin Carlsberg)、枯草桿菌蛋白酶DY(Subtilisin DY)在氨基酸序列上的同源性分別為99.5%、86%、72%和70%。然而,與其它枯草桿菌蛋白酶不同的是,NK 對纖維蛋白表現出高度的底物特異性[12]。基于枯草桿菌E 的晶體結構,Yanagisawa 構建了NK 的三維結構模型(如圖1所示),該酶的成熟肽主要由9 個α-螺旋和9 個β-折疊構成,以及2 個與穩定性相關的Ca2+結合位點[13]。

圖1 納豆激酶的三維結構圖[13]Fig.1 3D structure of nattokinase[13]
在NK 的氨基酸組成中,一些關鍵氨基酸殘基對NK 的活性和結構穩定性有著重要的影響。NK是一個球狀蛋白,其催化活性中心位于球狀蛋白表面淺槽,由Asp32-His64-Ser221 三聯體組成,NK 的底物結合位點由Ser125、Leu126 和Gly127三個保守的氨基酸組成[14]。氫鍵在NK 的催化活性和穩定性中起著重要作用,A32-H64-S221 三聯體和Gln155氧離子洞中的氫鍵對肽鍵的催化至關重要,Ser33、Asp60、Ser62 和Thr220 形成的氫鍵可穩定水解反應中的過渡態(圖2)。NK 的S3 結合區域的三個殘基Gly100、Ser101 和Leu126 對NK 的纖溶酶活性至關重要,因為它們可影響底物特異性[15-17]。在Gly100位點引入側鏈較長的氨基酸可能會降低底物結合和酶的催化活性[17]。與Gly100 相反,在Ser101 位引入體積較大的側鏈可以提高蛋白酶活性[17]。Leu126被認為是NK 活性裂隙的重要結構成分,它埋藏在活性裂隙中,靠近催化三聯體。這個殘基是保守的,對所有枯草桿菌蛋白酶的功能非常重要[3]。

圖2 NK 中由Ser33、Asp60 和Ser62 形成的環狀結構[16]Fig.2 Loop structure of NK including Ser33,Asp60 and Ser62[16]
1.2 納豆激酶的作用機制
與其它纖溶酶相比,納豆激酶的溶栓作用明顯,溶栓效率高,作用時間長,是由多個機制同時作用。納豆激酶不僅可以通過直接水解纖維蛋白和纖溶酶底物來分解血液凝塊,還可以將內源性尿激酶原轉化為尿激酶(u-PA),降解纖溶酶原激活物抑制物-1(PAI-1,可以抑制t-PA 的活性),并增加具有纖溶活性的組織纖溶酶原激活物(t-PA,可以促進人體內纖溶酶原向纖溶酶的轉化反應)(圖3)[11]。與t-PA 和uPA 等常見的纖溶酶不同,納豆激酶不會產生出血等副作用,在人體血液中的半衰期可超過3 h,遠優于其它纖溶酶[11]。
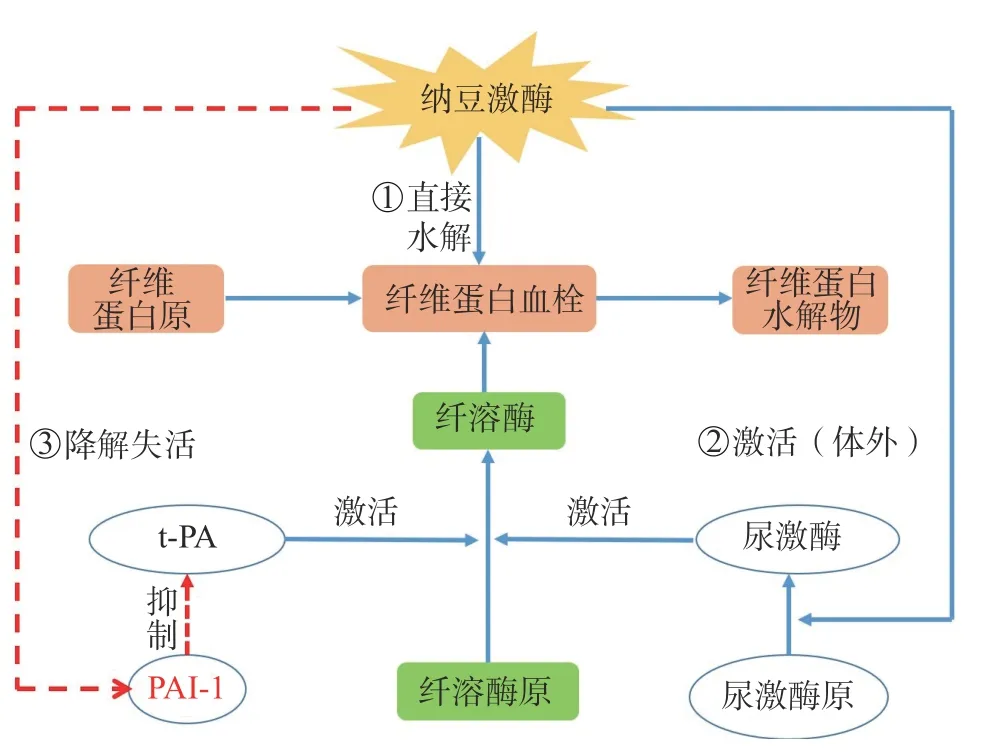
圖3 納豆激酶的作用機制Fig.3 Mechanism of nattokinase
因此,NK 目前被認為是一種高效、安全和經濟的酶,也是溶栓藥物研究的焦點。降低NK 的生產成本,進一步提高NK 產量,增強NK 穩定性成為NK的研究熱點。
2 納豆激酶的生產和發酵
2.1 納豆激酶的生產菌株
目前,納豆激酶主要由三種微生物發酵產生,芽孢桿菌(Bacillus)、海洋生物[18]和假單胞菌(Pseudomonassp.)[19]。如表1所示,NK 的生產菌株主要是從發酵食品中分離出來的。B. subtilisLSSE-62 來自于中國大豆醬中[20],B. amyloliquefaciensDC-4 和B.sublitisDC33 則是從中國傳統發酵食品豆豉中獲得的[21-22]。Bacillussp. CK 11-4 來自傳統的韓國發酵食 品 Chungkook-Jang[23],B. subtilisWRL101 和Bacillussp. DJ-4 是從傳統的韓國發酵食品豆漿Doenjang 中篩選出來的[24-25]。從牛乳中篩選而來的Pseudomonas aeruginosaCMSS[26],從土壤中獲得的Pseudomonassp. TKU015[27]以及從鐵銹中分離而來的B. cereusVITSDVM3[28]也被確認為有效的NK 生產者。由于研究人員定義NK 活性的單位不一致,如FU/mL、U/mL、IU/mL、FU/g 和U/g 等,因此很難比較各個菌株之間的NK 產量。目前研究最多的是枯草芽孢桿菌,尤其是從日本納豆中篩選的Bacillus subtilisnatto。

表1 NK 的生產菌株來源及發酵底物Table 1 Strain source and fermentation substrates of NK
2.2 納豆激酶的制備
目前,納豆激酶主要通過發酵來制備,根據發酵方式可分為固態發酵和液態發酵兩種。固態發酵所使用的生產設備要求簡單,控制方便,發酵原料成本較低。液態發酵過程傳質均勻可控,監測技術成熟,易放大,可實現大規模的自動化連續生產。因此,兩種發酵方式在研究和實際生產中均有應用。
2.2.1 納豆激酶的固態發酵 固態發酵通常是在沒有游離水的情況下,以具有一定濕度的水不溶性的固態物質做物理介質及營養來源,接種一種或多種微生物發酵的生物反應過程。固態發酵是納豆激酶制備的重要生產方式,納豆激酶的制備最初主要從固態發酵豆制品如納豆[2]、豆豉[33]、豆醬[34]、Jotgal[35]等中提取而來。影響固態發酵的因素主要有發酵物料、料液比、發酵溫度、接種量和發酵時間。固態發酵可選用的發酵物料比較多,既可以選擇黃豆[36]、黑豆[37]、鷹嘴豆[20]、銀杏果[38]、板栗[39]等天然作物,還可以選擇豆粕[40]、麥麩、稻殼[36]等農產品加工副產物。其不僅可降低成本,還可以減少環境污染實現資源的最大化利用。此外,固態發酵過程中幾乎無廢水產生,環境污染少;通氣可采用自然通風或者間歇通風,無需嚴格的無菌空氣及相應的設備。因此,固態發酵的投資較少,能耗低,技術比較簡單,適于小規模生產。目前,商業化應用的固態發酵制備納豆激酶活性一般能達到20~100 FU/g[41]。然而,由于固態發酵培養基中水分含量較少,流通性差,整個過程較為粗放,發酵過程中間參數難以進行檢測及監測,發酵調控比較困難,因此固態發酵很難進行純種培養和大規模工業化生產。
2.2.2 納豆激酶的液態發酵 液態發酵具有傳質均勻,發酵過程檢測技術成熟、可控,能夠實現自動連續化和易于放大等優勢,是近20 年NK 大規模生產研究的主要方法。影響液態發酵的主要因素有發酵培養基,發酵條件和發酵方式。培養基中碳源、氮源及無機鹽的種類對最終NK 的產量影響較大。碳源可為微生物的生產代謝提供能量,而氮源則可為微生物合成蛋白質和核酸等生物大分子提供原料。比較適宜用于生產NK 的碳源主要有葡萄糖[42]、麥芽糖[34]、甘油[43],而蛋白胨[44]、酵母提取物和大豆蛋白被確認為NK 生產的氮源[19,45]。無機鹽種類,例如Ca2+、Mg2+、Al3+、Co2+、Cu2+、 Fe3+、Zn2+、Mn2+、Na+等也會對NK 的產量有影響。其中Ca2+一般可促進NK 的產量,這可能是因為Ca2+參與酶的協同作用,可將表面蛋白固定在細胞壁上,提高了菌體對蛋白的利用效率進而可產生更高產量的NK[46-47]。而其余的金屬離子對NK 產量的影響與具體的菌株及培養基成分有關,例如0.02%的MgSO4的添加可顯著提高Bacillus subtilis MX-6 的NK 產量[47],然而MgSO4卻對Bacillus natto NLSSE 生產NK 的產量無顯著影響[34]。
發酵條件主要包含pH、溫度和溶氧。一個最佳的培養基pH 有助于維持膜中的電荷和培養基中的蛋白質的穩態,通過調節質子泵和通過膜運輸營養物質[48]。大多數纖溶酶發酵的最適pH 范圍為中性到微堿性(pH6.0~9.0),一般每種菌都有一個自己最適宜的pH,高于或低于此pH 酶產量明顯減少[49]。例如,Bacillus subtilis natto 在pH7.5 時NK 產量最高,低于或高于pH7.5 時酶產量急劇降低[46]。溫度是發酵過程的一個重要變量,大多數產纖溶酶的微生物的發酵溫度一般在30~40 ℃[50,51],而一些嗜熱菌的最適發酵溫度一般較高。例如,B. tequilensis ZMS-2最適溫度60 ℃[52],而S. megasporus SD5 MCMB-379 最適溫度55 ℃[53]。NK 生產菌株一般都為好氧菌,溶氧量的控制對NK 的生產至關重要,一般可以通過調節裝液量(搖瓶)、轉速(搖瓶和發酵罐)及通氣量(發酵罐)來控制溶氧[49]。菌株的生長對數期耗氧量比較大,提高溶氧有助于菌體的生長,發酵后期菌株進入穩定期耗氧量穩定,因此發酵過程中可通過分階段控制溶氧來提高NK 產量[49]。
液態發酵根據發酵方式可分為分批發酵和補料分批發酵,與分批發酵方式相比,在細胞生長階段補料發酵更具有優勢,例如在菌體生長的對數期分批補料甘油顯著提高NK 的產量[43]。此外,還可以通過pH 值恒定補料分批培養法,通過補料添加葡萄糖和蛋白胨保持發酵過程中的穩定pH,最終NK 產量為分批發酵的3 倍[54]。
微生物發酵產納豆激酶,最初采用固態發酵方式,后由于固態發酵需要空間比較大,發酵周期長,時間成本較高,人們逐漸采用了液態發酵。后研究發現,由于一般液態發酵的培養基營養比較豐富,導致發酵結束后NK 產品分離純化困難。而且,液態發酵過程中產生的大量廢水,易造成環境污染。因此,目前固態發酵生產NK 又重新吸引了人們的關注,具體生產過程中固態發酵與液態發酵方式的選擇應根據具體的菌株以及實際情況來選擇。
3 提高NK 產量、酶活性及穩定性的方法
3.1 發酵優化
發酵優化包含發酵培養基優化、發酵條件優化及發酵方式的優化,通過優化可以顯著提高NK 的產量。傳統發酵優化的方法是一次改變變量(碳源種類、溫度、pH、接種量、轉速和物料濃度等),其余條件保持不變,依據最終NK 產量獲取最優的發酵條件。這種方法耗時長、工作量大,有時還因為各因素間的交互作用而產生不正確的結果。利用統計學方法可很好的解決此類問題,例如響應面優化方法,田口正交設計或部分析因設計[49]。統計方法提供了可靠性,有助于確定最佳的營養成分,了解參數之間的相互作用,因此節省時間和能量。例如,以板栗為原料進行固體發酵,經Box-Behnken design(BBD)優化后,NK 的產量提高了1.2 倍[39]。發酵方式的優化主要指的是分批發酵、連續發酵等發酵過程方式選擇的優化,一般通過分批補料發酵或者連續發酵最終生成的NK 產量更高[43,54],然而其操作過程相對復雜,對儀器設備的要求也比較高。
3.2 基因工程及蛋白質工程方法
除了普通的發酵培養基優化及發酵方式優化外,基因工程技術可用于提高NK 產量。源于Bacillussubtilisnatto 納豆激酶的基因aprN通過基因克隆后可通過異源表達方式提高NK 產量,目前常用的基因工程宿主既有細菌宿主,如Bacillus subtilis[55]、Escherichia coli[56]和Lactococcus lactis[57],也有植物宿主(如煙葉和甜瓜[58])和動物宿主(如果蠅和甜菜夜蛾的昆蟲細胞[59])。微生物宿主生長成本低,繁殖周期短,但各宿主工程菌有其固有的缺點此外,可以通過基因工程技術和營養優化策略提高重組納豆激酶的表達量。例如,可以通過啟動子優化,改變NK 基因啟動子(PaprN)的-10 或-35 元件的序列,特別是-10 元件的序列,提高重組NK 的胞外表達[60]。利用DNA 家族重排技術也可將NK 的催化效率提高2.3 倍[61]。此外,還可以通過信號肽優化、合成啟動子及刪除冗余基因元件提高Bacillus subtilis表達NK 的產量[62]。另外,對于重組的產NK 的枯草芽孢桿菌,可以通過在培養基中添加金屬離子和谷氨酸等營養物質將NK 產量提高4 倍[63]。
蛋白質工程技術通過氨基酸的定點突變也可實現NK 活性的提高及穩定性的增強,例如優化位于酶催化殘基Ser221 附近的氨基酸殘基Thr220 和Met222,可提高NK 的活性及氧化穩定性[16]。將NK分子表面的天冬酰胺和谷氨酰胺突變為天冬氨酸和谷氨酸,可提高NK 的酶活和熱穩定性,例如Q59E的突變株的酶活為野生型NK 的1.54 倍,N218D的突變株在55 ℃的半衰期為28 min,是野生型菌株的1.35 倍[14]。然而,通過引入半胱氨酸殘基從而形成二硫鍵來提高NK 的熱穩定性的嘗試并不成功[64]。
3.3 酶的固定化
為提高納豆激酶的穩定性,除了應用基因工程和蛋白質工程的定點誘變技術外,還可采用酶的固定化技術。固定化是一種商業應用和方便的方法,因為它通常可以提高酶的熱穩定性和pH 穩定性,降低生產成本,而且易于處理和分離,進而可使酶重復使用[73]。NK 的固定化現在已用的方法主要有吸附法、包埋法、共價結合法及交聯法(表2)。目前吸附法研究的最熱的就是以納米顆粒為材料進行NK 的固定,例如選用聚羥基丁酸酯(PHB)納米粒子進行NK的吸附固定,固定后酶的穩定性明顯提高,4 °C 保存25 d 活性完全保持不變[65]。包埋法也是NK 固定化常用的方法,目前使用的包埋材料主要有γ-聚谷氨酸[66]、聚賴氨酸[67]、葉酸改性殼聚糖(CS-FA)[68]、多巴胺微膠囊[69]等,包埋后的NK 的酶活、穩定性都會明顯提高,而且有的還可以實現體內靶藥給藥的功效[69]。共價結合法和交聯法也是NK 固定的常用方法,NK 通過化學鍵的結合或者交聯與材料結合在一起,穩定性較好,同時也可保持NK 的生物活性。當以1-(3-二甲基氨基丙基)-3-乙基碳二亞胺為偶聯劑,將NK 固定在磁性納米顆粒Fe3O4中,發現NK納米顆粒結合物的最佳溶栓活性可達91.89%,明顯高于純酶活性82.86%[70]。以聚(賴氨酸)樹枝狀大分子為材料,通過交聯作用可與NK 形成納米復合物,明顯提高了NK 相對酶活性、熱穩定性和酸穩定性,體內溶栓率在12 h 達到50%,并可有效避免出血等其他并發癥[67]。綜上所述,利用共價結合、吸附、包埋、交聯等方法進行NK 的固定化,可以顯著提高酶的酶學性質(包含纖溶活性,酸穩定性和熱穩定性)。

表2 NK 的固定化原理及效果Table 2 Principle of immobilization and its effect on NK activity and stability
此外,為了保持納豆激酶在人體內的活性,防止被胃酸變性,可以將納豆激酶制成制劑,控制其在人體內的釋放速度。可先將NK 粉末壓縮成片劑,然后用Eudragit L100-55 腸道材料和羥丙基纖維素的混合物通過直接壓縮涂覆,進而可保證NK 通過胃腸道時的活性[74]。也可先用薄膜法制備的植物甾醇脂質體,再將脂質體包封納豆激酶(NK),制備NK 口服藥[75],保護NK 通過胃時不變性。NK 制劑的研究將會推進NK 作為一種口服藥的推廣,對NK 未來的應用有重大意義。
4 納豆激酶的生理功能
4.1 納豆激酶的抗血栓功效
在體外和動物模型中,已經進行了大量的工作來評估NK 的溶栓作用,研究發現NK 不僅可溶解已有的血栓,還可預防血栓的形成,且出血等副作用較小。以經過化學誘導產生頸總動脈(CCA)血栓的大鼠為研究對象,NK 的溶栓效力是纖溶酶的4 倍[76],在2836FU 濃度下,NK 在6 h 內可溶解88%的血栓。用卡拉膠誘導的小鼠尾部血栓形成,發現事先服用NK 的小鼠血栓形成的時間明顯延遲[77],說明NK 可以減緩血栓的形成。與組織纖溶酶原激活劑(t-PA)相比,NK 的出血等副作用明顯較小。先用FeCl3浸泡的紙誘導大鼠頸動脈血栓形成,后靜脈注射NK 或t-PA,結果發現NK 和t-PA 均可延遲血栓形成,分別在75 和8.5 mg/kg 時幾乎完全抑制(90%),但NK 在300 mg/kg 時才會引起出血,而t-PA 在10 mg/kg 時即可引起點狀出血[78]。此外,在肺血栓小鼠模型以及健康人類志愿者中,口服NK 可導致血栓計數和血漿優球蛋白溶解時間(ELT)的減少,以及t-PA 的增加,表明NK 能夠激活小鼠和人體的血漿纖溶能力[79]。目前關于NK 的作用機制仍主要從圖3所示的三個方面來考慮,然而,關于NK 在體內的具體作用機制現在研究的還不夠透徹,未來仍需要此方面的研究。
4.2 納豆激酶的降血壓功效
納豆激酶可在預防和治療高血壓中發揮作用。2008 年,Kim 等研究了NK 補充劑對高血壓前期或1 期高血壓受試者血壓的影響,結果發現口服NK 8 周后可降低患者的收縮壓和舒張壓(NET)變化分別為-5.55 和-2.84 mmHg(P<0.05)[7]。最近,Jensen等[6]的一項研究表明,服用NK8 周后,高血壓患者的血壓發生有益變化。這與之前的報道一致,NK 給藥可有效降低自發性高血壓大鼠的血壓[80-84]。
關于NK 的抗高血壓的作用機制目前尚無定論。在Jensen 等[6]的研究中,高血壓患者血壓的下降與血漿腎素活性無關,并且血管緊張素轉換酶(ACE)在NK 的降壓作用中的功效備受爭議。雖然人體研究表明,接受NK 治療的患者的ACE 濃度沒有統計學上的顯著差異,但其他8 項使用動物模型的研究表明,NK 的降壓作用與ACE 的抑制有關[83]。然而,根據口服給藥方式的不同,可能存在不同的降壓作用機制。在一項使用自發性高血壓大鼠的研究中,NK 及其片段通過不同的機制降低了高血壓[80],NK 可能通過血漿中纖維蛋白原的裂解來降低血壓,而NK 片段可能阻止血漿血管緊張素II 水平的升高,從而抑制大鼠高血壓[80]。此外,NK 的ACE 抑制作用呈劑量依賴性[81,84]。
由于長期使用抗高血壓藥物具有明顯的副作用[85],NK 攝入可能是治療CVD 患者高血壓的一種有希望的替代方案。因此,每天攝入NK 可能是治療高血壓的一種有效策略[82]。
4.3 納豆激酶的降血脂功效
多個實驗室證實NK 具有降血脂作用,食用NK 或含有NK 的納豆提取物,可顯著降低動物模型中升高的血清甘油三酯、總膽固醇和低密度脂蛋白膽固醇(LDL-C)水平[8-9]。在高脂血癥患者中,NK治療(6500 FU 治療26 周)降低了總膽固醇、LDLC 和甘油三酯,提高了高密度脂蛋白膽固醇(HDL-C)水平[86]。然而,在小樣本實驗中,以原發性高膽固醇血癥患者為對象,NK 治療組每天給與4000 FU,治療4 周后血清膽固醇、LDL-C 和HDL-C 均有所下降,但無明顯差異,可能是由于實驗中使用NK 的劑量相對較低,治療時間也相對較短[87]。當NK 使用劑量較高,并延長其治療時間時,NK 的降血脂效果較顯著,例如,謝嵩等[88]以大鼠為動物模型每天使用360 mg/kg 的劑量(約為3000 FU)連續治療六周后,總膽固醇含量(TC)可降低16%,甘油三酯含量(TG)含量可降低20%。因此,當利用NK 來進行降血脂時,需使用較高的NK 劑量并延長治療時間。此外,還有研究發現,NK(100 mg/d)結合紅曲米(1200 mg/d)對高脂血癥患者的血脂控制更加有效[89-90],這也為降血脂藥物的開發提供了新思路。
關于NK 降膽固醇血脂的機制現在研究的還比較少,Yoo 等[91]研究了發現補充NK 對非糖尿病和高膽固醇血癥患者膠原-腎上腺素關閉時間、凝血酶原時間和活化部分凝血活酶時間的影響,結果發現NK可改變止血因子,NK 實驗組的膠原-腎上腺素關閉時間、凝血酶原時間和活化部分凝血活酶時間明顯延長。
4.4 納豆激酶其它方面的功效
納豆激酶在保護神經細胞預防阿爾茨海默病(AD)方面有明顯的功效。蛋白質由正常的三維結構轉變成淀粉樣結構是AD 的重要表征,納豆激酶可通過減少蛋白淀粉樣結構來治療阿爾茨海默病(AD)患者。在AD 大鼠模型中,口服NK 對降低AD 通路中乙酰膽堿酯酶(AchE)活性、轉化生長因子β(TGF-β)、Fas 和白細胞介素-6(IL-6)含量的調節具有積極作用[91]。在秋水仙堿中毒引起的AD 認知障礙的大鼠模型中,含有NK 的納米營養劑被證明能夠修復其受損的學習和記憶能力,并且可有效抑制β-淀粉樣蛋白和BACE-1 活性,從而表明NK 具有神經保護作用[92]。與未經治療的AD 對照組相比,在360 FU/kg 的劑量下,NK 可顯著降低TGF-β、IL-6 和p53 含量以及膽堿酯酶活性,增加Bcl-2 含量[93]。以上數據表明,NK 的神經保護作用是由于其水解蛋白、抗炎和抗凋亡作用。
納豆激酶還可以有效地治療慢性鼻竇炎、玻璃體視網膜疾病和長時間飛行導致的疾病。納豆激酶可以通過水解纖維蛋白有效收縮慢性鼻竇炎患者的鼻息肉組織,進而緩解慢性鼻竇炎所引起的哮喘,因此NK 有望成為慢性鼻竇炎鼻息肉和共病哮喘患者的有效替代治療方案[10]。NK 還可以用于治療增殖性玻璃體視網膜疾病患者,這一作用是由于NK 可誘導玻璃體后脫離(PVD)的有效性[94]。Flite Tabs(Aidan,AZ,USA)的一項研究發現,Pinokinase(碧蘿芷和納豆激酶的組合)可顯著改善長時間飛行導致的腿部腫脹、深靜脈血栓形成(DVT)和肺栓塞(PE)。此外,納豆激酶在抑制小鼠肝細胞癌(HCC)[95]、改善胰島素缺乏性2 型糖尿病大鼠腸道菌群失調[96]、用作醫療器械工具涂層預防手術中血栓并發癥的發生等方面也有重要的應用[97]。
5 結論與展望
納豆激酶生產菌株目前已從食物和非食物中分離得到,與非食品來源相比,食品來源的生產菌株,尤其是來自于傳統發酵食品的菌株在未來NK 的生產應用中更具有競爭力。其中,Bacillus種屬產的纖溶酶因其高特異性及酶活性而引起廣泛關注。NK 可通過固態發酵和液態發酵來制備,并通過發酵優化、基因工程和蛋白質工程等進行菌株改造來提高酶的產量、酶活性和穩定性。然而,目前NK 的發酵產量還不能滿足大規模生產,未來新菌株選育及改造仍是未來的努力方向。現在已發現NK 在抗血栓、降血壓、降血脂、預防AD、治療鼻竇炎等方面具有明顯的生理功效,但是關于NK 的具體作用機制尤其是體內的作用機制研究的仍比較少,限制了NK 的推廣使用。未來關于NK 的臨床實驗研究、體內作用機制研究將有助于推動NK 的進一步進展。此外,NK 突出的溶栓效果和抗出血傾向的特性,或許可成為COVID 患者(常存在凝血功能異常問題)的輔助治療方案[98-99]。

