術前充氣加溫對胃癌患者圍手術期低體溫的療效評價*
陳言例,沈玲珊,黃志成,嚴明芳
(福建醫科大學附屬腫瘤醫院/福建省腫瘤醫院手術室,福建 福州 350014)
根治性手術是胃癌治療的重要手段之一,然而,胃血供豐富、淋巴結清掃難度大,切除范圍廣,術后愈合慢、并發癥多[1]。世界衛生組織(WHO)發布手術安全指南明確指出手術期間機體的體溫維持正常范圍可減少手術后并發癥[2]。圍手術期內非醫療計劃引起機體核心體溫<36.0 ℃稱為圍手術期低體溫,又稱圍手術期意外低體溫[3]。圍手術期低體溫發生率高達50%~70%,引起肌松藥代謝率降低、心輸出量減少、代謝性酸中毒、凝血功能改變、切口感染率增加、寒戰后耗氧量增多、促進去甲腎上腺素釋放和心肌缺血[4-5]。
維持圍手術期正常體溫的最佳方法尚未建立,術前預加溫是指至少在患者術前30 min進行預熱式主動加溫保暖。術前預加溫的臨床效果存在爭議,一項meta分析表明術前預加溫降低圍手術期低體溫的風險[6]。但JO等[7]研究表明術前主動加溫無法預防圍手術期低體溫。了解圍手術期低體溫及不良影響,并采取有效的預防措施是護士圍手術期護理的主要目標。本文探討了術前充氣加溫對胃癌患者圍手術期低體溫的影響,具體報道如下。
1 資料與方法
1.1一般資料 選取2019年3月至2021年4月本院接受手術治療的胃癌患者,納入標準:(1)胃癌根治性手術,行靜脈復合全身麻醉;(2)年齡≥18歲;(3)術前體溫正常;(4)美國麻醉醫師協會(ASA)麻醉分級為Ⅰ~Ⅲ級。排除標準:(1)嚴重心、肺、肝功能異常;(2)甲狀腺功能低下;(3)術前凝血功能異常;(4)認知功能障礙。期間共有148例胃癌患者納入研究,按照隨機數表法將其分成研究組和對照組,各74例。
1.2方法
1.2.1干預措施 對照組采用常規護理,具體措施包括:(1)術前告知患者及家屬圍手術期低體溫的發生率高及不良影響,爭取其配合;保持術前環境溫度(手術等候區及手術室)≥23 ℃。(2)術中使用充氣式加溫儀進行加溫,實時監測患者的體溫。濕化加熱麻醉氣體,腹腔鏡手術還需加熱氣腹。輸注的液體及冷藏血制品使用輸液加溫儀加熱至37 ℃;腹腔沖洗液加溫至38~40 ℃后使用。(3)術后進入麻醉恢復室繼續動態監測體溫,覆蓋棉毯保溫。(4)返回病房后,囑家屬使用溫水擦拭四肢,做好保暖措施。研究組在常規護理基礎上術前使用充氣式加溫儀預熱至少30 min,在預熱期間,詢問患者的感受將升溫毯調節至最適合患者的溫度,保證患者圍手術期感受良好的熱舒適感。
1.2.2觀察指標 (1)體溫測量:人體體溫分為皮膚體溫(指體表溫度)和核心體溫(指腦、心、肺等深部器官的溫度)。患者進入手術室時使用體溫槍測量其額頭體溫作為其體表溫度。麻醉后將鼻咽溫度作為核心體溫的測量部位,測量方法為麻醉誘導氣管插管后將體溫探頭置入患者鼻咽部,深度為耳屏到鼻孔的距離,測量手術開始時、麻醉后60 min、麻醉后120 min及手術結束時的核心溫度。(2)凝血功能:術前及術后2 h檢驗凝血功能,包括凝血酶原時間(PT)、活化部分凝血活酶時間(APTT)、凝血酶時間(TT)。(3)并發癥:術后注意觀察可能出現低體溫癥狀(寒戰)。切口感染根據美國疾病控制和預防中心發布的《手術部位感染預防指南》進行評估[8],出現如下癥狀即可診斷:①切口及周圍組織出現紅、腫、熱、痛;②切口引流出膿性分泌物;③切口分泌物培養顯示病原菌感染。

2 結 果
2.12組患者基線資料比較 2組患者性別、年齡、體重指數(BMI)、ASA分級、麻醉時間、手術時間、手術方式、手術切除范圍、術中輸液量、沖洗液比較,差異均無統計學意義(P>0.05),見表1。
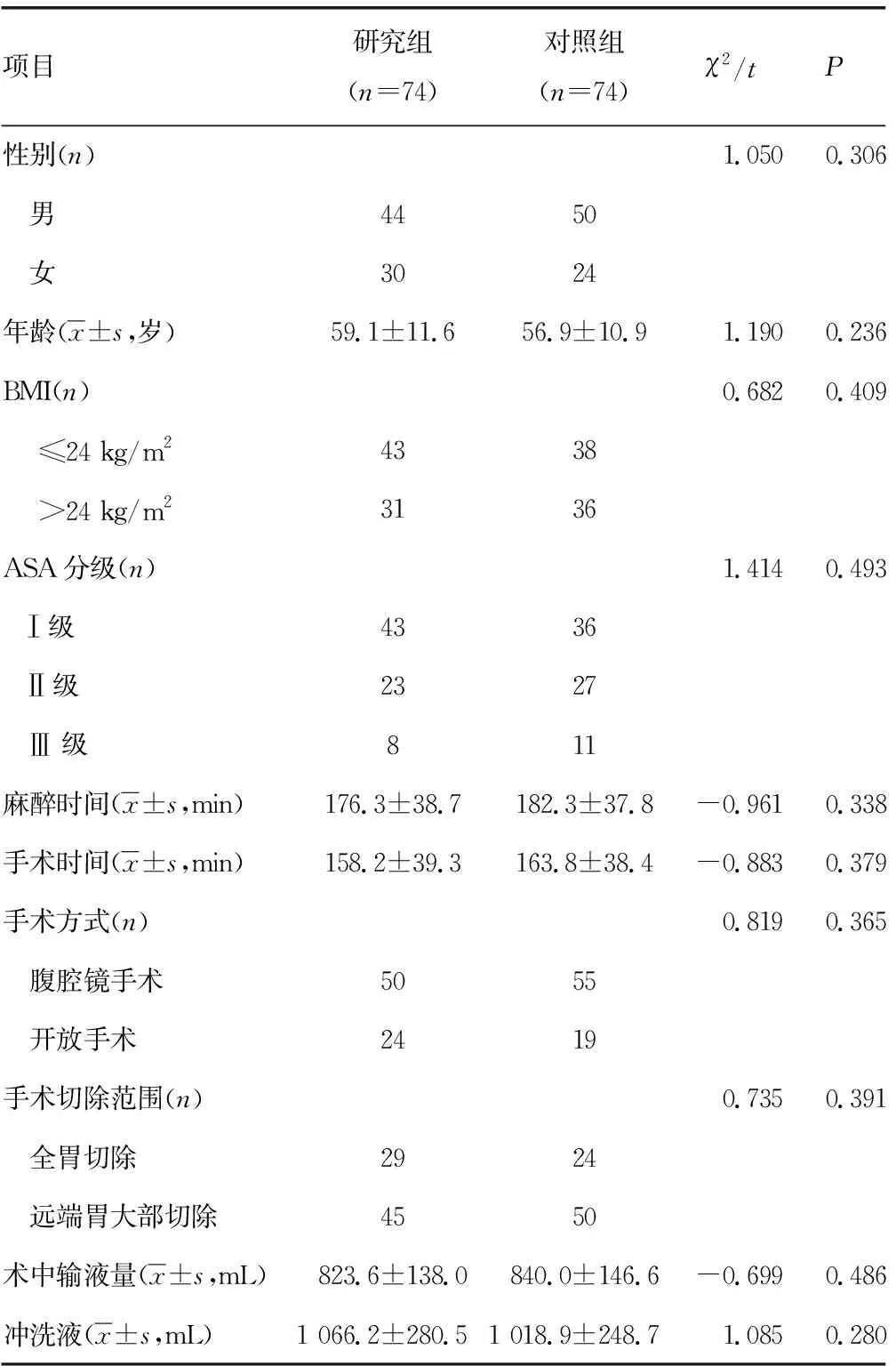
表1 2組患者基線資料比較
2.22組患者不同時間點的體溫變化 入手術室時2組患者的體溫未見明顯差異(P>0.05)。麻醉開始時、麻醉后60 min、麻醉后120 min及手術結束時,研究組患者的核心體溫均高于對照組,差異均有統計學意義(P<0.05),見表2。
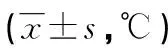
表2 2組患者不同時間點的體溫變化
2.32組患者凝血功能比較 術前2組患者APTT、PT、TT比較,差異均無統計學意義(P>0.05);術后研究組APTT、PT、TT均短于對照組,差異均有統計學意義(P<0.05),見表3。
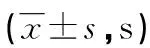
表3 2組患者凝血功能比較
2.4術后患者復蘇時間及低體溫、寒戰、切口感染發生情況比較 術后研究組圍手術期復蘇時間短于對照組,低體溫、寒戰、切口感染發生率均低于對照組,差異均有統計學意義(P<0.05),見表4。
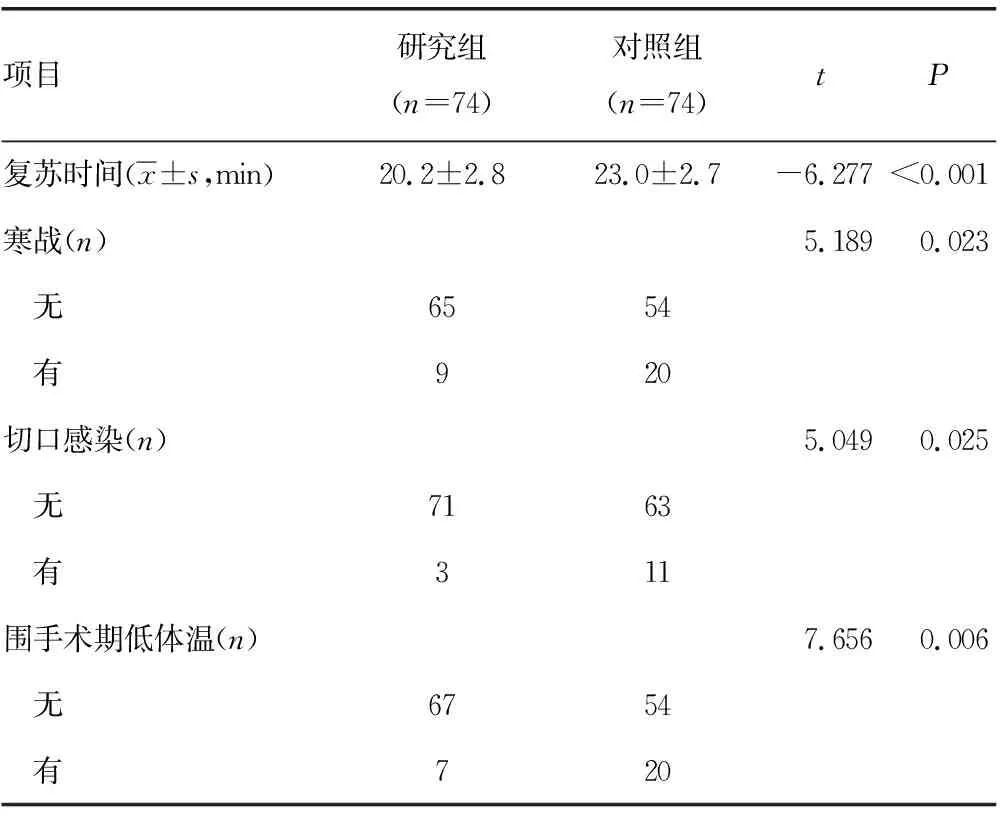
表4 術后患者圍手術期復蘇時間及低體溫、寒戰、切口感染發生情況比較
3 討 論
先前研究表明,術中維持正常體溫可使患者的住院時間減少40%,圍手術期感染的發生率降低64%,增加患者的滿意度和熱舒適度[6]。麻醉期間,機體大約90%的熱量損失是由皮膚輻射到環境中,使用皮膚保暖方法有效降低熱損失[9]。加溫措施包括被動加溫(棉毯、反光毯)和主動加溫(充氣加溫、加溫輸液、加溫沖洗液)。SHAW等[10]進行meta分析表明,在圍手術期主動加溫維持患者的體溫比被動加溫更有效。充氣加溫是最常用的主動加溫方式。先前研究建議術前至少預加溫30 min[11],因此,本研究選用術前充氣加溫≥30 min作為研究方法。
目前部分學者推薦術前需要預加溫[12-13],然而與術中加溫相比,術前預加溫在臨床實踐中重視程度低,同時,一項研究表明術前預加溫對圍手術期低體溫無效且無法提高術后滿意度[14]。本研究中,麻醉開始時、麻醉后60 min、麻醉后120 min及手術結束時,研究組的核心體溫均高于對照組,圍手術期低體溫發生率顯著低于對照組,表明術前預加溫可有效維持術中體溫,降低圍手術期低體溫的發生,提高患者的舒適度。低溫時人體需要骨骼肌的寒戰進行產熱,因此,本研究中預加溫有利于減少寒戰的發生。與先前研究一致,GROTE等[15]將7 786例全身麻醉患者進行研究發現,術前預加溫患者術中低體溫的發生率為15.8%,顯著低于未預加溫患者的30.4%。MENZEL等[16]將3 228例患者納入研究表明,僅術中加溫比術前結合術中加溫術出現圍手術期低體溫的風險增加1.8倍。LAU等[17]研究顯示與單純術中加溫相比,聯合進行術前加溫出現低體溫更少,但在手術部位感染、血細胞比容和術后24 h阿片類藥物消耗量未見優勢。
術前預加溫的作用機制考慮為麻醉誘導后核心體溫下降經歷3個階段,分別是急速下降期、緩慢線性下降期和平臺期。大部分體溫損失發生在第一階段,占總熱量損失的65%,麻醉藥物麻痹體溫調節中樞,使血管收縮及寒戰閾值降低,造成外周血管擴張,機體熱量由核心向外周分布,也稱為“再分配階段”[18]。預加溫提高體表溫度、軀體血管擴張,降低核心組織到外圍的溫度梯度,減少第一階段的熱量再分布,因此預加溫有利于維持術中溫度。
本研究中,研究組術后切口感染發生率低于對照組,表明術前預加溫有效降低術后切口感染。圍手術期低體溫造成外周血液循環減少,加重組織缺氧,免疫功能下降,使傷口愈合功能減弱、易受感染[3]。中華醫學會外科學分會外科感染與重癥醫學組發布的《中國手術部位感染預防指南》指出,術中低體溫延緩傷口愈合、增加切口感染率,強烈推薦維持圍手術期正常溫度[19]。低體溫導致凝血功能受損、抑制血凝塊形成、血栓素A3的合成減少后影響血小板聚集功能[20]。本研究中,研究組術后APTT、PT、TT短于對照組,提示術前預加溫有利于保護機體的凝血功能。細胞和酶功能是溫度依賴性,活性受溫度變化而改變。低溫影響麻醉藥物的代謝率,延長麻醉藥物在體內的代謝時間,因此,本研究中研究組的蘇醒時間比對照組長。
總之,圍手術期的溫度管理是臨床工作中的重要挑戰,目前體溫保護措施可緩解體溫降低,但無法完全消除。術前結合術中使用充氣加溫對改善維持體溫、凝血功能、降低術后并發癥效果良好。

