拋射劑四氟乙烷中雜質CFC115和HFC1243zf的吸入毒理安全性評價
趙燕君,楊會英,儀忠勛,孫會敏,林 飛
(中國食品藥品檢定研究院,國家藥品監督管理局藥用輔料質量研究與評價重點實驗室,北京 100050)
藥物吸入氣霧劑指藥物及輔料與拋射劑共同裝封于具有定量閥門系統和一定壓力的耐壓容器中,形成溶液、混懸液或乳液,使用時借助拋射劑的壓力,將內容物呈霧狀噴出而用于呼吸道局部治療的制劑[1]12。吸入氣霧劑直接接觸呼吸道黏膜或破損組織并迅速被毛細血管吸收,是風險等級“最高”的品種之一[2]。拋射劑是氣霧劑藥液霧化的動力,也是溶解或分散藥物及輔料的介質[3],臨床使用時會隨藥液直接吸入體內,其質量的優劣直接影響到藥品的安全性和有效性。
1,1,1,2-四氟乙烷(HFA-134a)是目前藥用氣霧劑尤其是藥用吸入氣霧劑中使用最為廣泛的拋射劑,由于合成路線復雜,生產過程會產生很多未知的雜質[4],這些雜質結構的確定和含量的變化是HFA-134a 質量控制的重點。本實驗室在質量抽檢中發現,國內某企業6批次HFA-134a產品均含有五氟氯乙烷(CFC115)和3,3,3-三氟丙烯(HFC1243zf)這兩種雜質,最高分別可檢出0.015‰和0.006‰,而進口產品中未檢出。這兩種雜質是否存在臨床吸入后毒理學危害,目前還未見安全性文獻報道。
為此,本研究應用6 種試驗方法對CFC115 和HFC1243zf 高濃度混合氣體(按照HFA-134a 中實際檢出比例混合)進行動物體內、外毒理學安全性檢測,為制定吸入用四氟乙烷標準及國產產品的吸入安全性風險評估提供技術支撐。
1 材料與方法
1.1 材 料
1.1.1 受試樣品高濃度混合氣體:五氟氯乙烷(CFC115,CAS 登記號76-15-3),相對分子質量154,室溫無色氣體,沸點-39~-37.7 ℃,含量>99.9%,由中化藍天貿易有限公司提供;3,3,3-三氟丙烯(HFC1243zf,CAS 登記號677-21-4),相對分子質量96,室溫無色氣體,沸點-18~-16 ℃,含量>99.9%,由北京宇極科技發展有限公司提供;CFC115 與HFC1243zf 按體積比7∶3 混合,再與潔凈空氣和氧氣混合后直接進入全身暴露裝置內,對動物進行吸入給樣,體外試驗進行接觸給樣。
1.1.2 主要儀器和試劑HRH-7981 口鼻式給藥裝置購于北京慧榮和科技有限公司,CHT-24 口鼻式染毒裝置購于美國CHT 公司,HP1712 吸入全身暴露裝置購于北京匯普儀器設備科技有限公司,NE-C28 醫用霧化器購于日本歐姆龍公司,TVA-1000B揮發性有毒氣體檢測儀購于美國熱電公司,BS-220全自動生化分析儀和BC-5000VET 全自動血液分析儀購于深圳邁瑞生物醫療電子股份有限公司,CBS-400 電解質分析儀購于煙臺卓越生物技術責任有限公司,PUN-2048B半自動凝血分析儀購于北京普朗新技術有限公司,2 L、40 L Tedlar?PVF 采樣袋購于大連德林氣體包裝有限公司,5 L/min 流量計購于美國德威爾公司,37XB 倒置生物顯微鏡購于上海光學儀器廠,ELx808酶標儀購于美國伯騰儀器有限公司,IP-20T真空泵購于日本SIBATA公司。
血液或生化測定試劑盒購于深圳邁瑞生物醫療電子股份有限公司,凝血酶測定試劑盒購于上海太陽生物技術有限公司。蘇木素染色液、伊紅染液、四甲基噻唑藍(dimethylthiahiazo phenytetrazoliumromide,MTT)溶液等購于北京索來寶科技有限公司,99.99%高純氧、人造空氣購于北京亞南偉業氣體有限公司。
1.1.3 實驗動物及細胞株SPF級SD大鼠100只,普通級Hartley 豚鼠24只,雌、雄各半,由斯貝福(北京)生物技術有限公司提供,生產許可證號:SCXK(京)2016-0002。實驗動物使用許可證號:SYXK(京)2018-0009。
Ames 試驗菌株TA 系列購于美國Molecular Toxicology 公司,小鼠成纖維細胞(L929)購于中國醫學科學院基礎醫學研究所。
1.2 試驗方法
1.2.1 細胞毒性試驗[5-6]L929 細胞傳代培養,試驗設空白對照組、陽性對照組、陰性對照組和受試樣品組。空白對照組常規操作不放入采樣袋;陽性對照組常規操作另加入10% DMSO不放入采樣袋;陰性對照組將無菌空氣和5%二氧化碳氣體混合置于2 L密閉真空采樣袋中;受試樣品組將3 263 g/m3(CFC115)+872 g/m3(HFC1243zf)、無菌空氣、氧氣和5%二氧化碳氣體混合,置于2 L密閉真空采樣袋中(根據空氣中含氧量占21%計算)。96 孔細胞培養板置密閉真空采樣袋中37 ℃開蓋4 h接觸氣體,閉蓋后置CO2培養箱中37 ℃繼續培養44 h,移除培養液,每孔加50 μL MTT 溶液,繼續于37 ℃培養2 h。棄去MTT 溶液,每孔加100 μL異丙醇溶液,洗脫貼壁細胞,用酶標儀測定吸光度D(570)和D(630)值,根據如下公式計算細胞相對增殖率(relative growth rate,RGR)。

細胞毒性分級判定:RGR≥100 為0 級;RGR 在80~99 為1 級;RGR 在50~79 為2 級;RGR 在30~49 為3 級;RGR 在0~29 為4 級。若陰性對照組的RGR <80,陽性對照組的RGR>30,本次試驗結果不成立,應重新試驗。
1.2.2 Ames試驗[6-7]采用組氨酸缺陷型鼠傷寒沙門氏菌株TA97a、TA98、TA100、TA102 和TA1535,在有或無代謝活化條件(±S9)下采用平板摻入法進行。試驗設空白對照組、陽性對照組、陰性對照組和受試樣品5 個濃度組,每組設3 個平行皿。空白對照組和陽性對照組常規操作不放入采樣袋;陰性對照組和受試樣品5 個濃度組在常規操作至頂層培養基固化后,平皿開蓋置40 L無菌真空采樣袋中,最高濃度分別為3 483 g/m3(CFC115)和931 g/m3(HFC1243zf),以1.7 倍組距稀釋4 個染毒濃度,按空氣氧含量21%導入不同濃度的受試樣品、氧氣和空氣進行37 ℃密閉氣態染毒4 h,閉蓋取出平皿置37 ℃繼續培養48 h,計數回變菌落數。
1.2.3 急性吸入毒性試驗[6,8]取7~9 周齡大鼠20只,雌、雄各半,全部大鼠口鼻暴露染毒持續4 h,吸入受試樣品CFC115 (3 115 g/m3)和HFC1243zf (832 g/m3)混合氣體,在染毒期間及染毒結束4 h 內不間斷臨床觀察,以后每天觀察1 次,連續14 d,觀察動物被毛、眼睛和黏膜、呼吸、神經、肢體活動和行為的改變,記錄有無流涎、腹瀉、震顫、驚厥、昏睡、昏迷等體征出現和消失的時間。試驗前后稱量大鼠體質量。試驗結束全部存活動物處死,大體解剖,觀察臟器變化,發現異常組織器官按病理組織學5級法(見表1)觀察、判定。
1.2.4 重復吸入局部刺激性試驗[6,9]取7~9 周齡大鼠40 只,隨機分為空白對照組和受試樣品組,每組雌、雄各10 只。空白對照組吸入潔凈空氣;受試樣品組吸入受試樣品CFC115 (3.59 g/m3)和HFC1243zf (0.96 g/m3)混合氣體,口鼻暴露染毒每天4 h,連續染毒7 d。末次染毒結束后4 h和24 h,每組取雌、雄各5只存活大鼠進行大體剖檢,觀察呼吸道局部(鼻、喉、氣管、肺臟),口腔,咽,食道黏膜及其他組織臟器有無充血、紅腫等體征,觀察呼吸道組織器官病理組織學變化,發現異常組織器官按5級法(見表1)對病變進行觀察、判定。

表1 病理組織學觀察病變分級
1.2.5 全身主動過敏試驗[6,9]取6~9 周齡Hartley 豚鼠24只,隨機分為空白對照組、陽性對照組、受試樣品低、高濃度組,每組雌、雄各3 只。空白對照組吸入潔凈空氣;陽性對照組霧化吸入卵白蛋白60 mg(誘導濃度10 mg/mL)或120 mg(激發濃度20 mg/mL);低濃度組吸入誘導濃度為2.80 g/m3的CFC115 和0.75 g/m3的HFC1243zf,激發濃度為5.77 g/m3的CFC115 和1.54 g/m3的HFC1243zf;高濃度組吸入誘導濃度為9.43 g/m3的CFC115和2.52 g/m3的HFC1243zf,激發濃度 為18.82 g/m3的CFC115 和5.03 g/m3的HFC1243zf。口鼻暴露染毒每次30 min,誘導吸入,隔天1 次共5次,于第1 次染毒后的第22 天和第29 天進行激發吸入。2次激發吸入后分別觀察各組豚鼠3 h,根據激發致敏后豚鼠過敏反應出現的體征(見表2,序號1~4 為弱陽性;5~10為陽性;11~19為強陽性;20為極強陽性),最終評價豚鼠致敏反應程度。
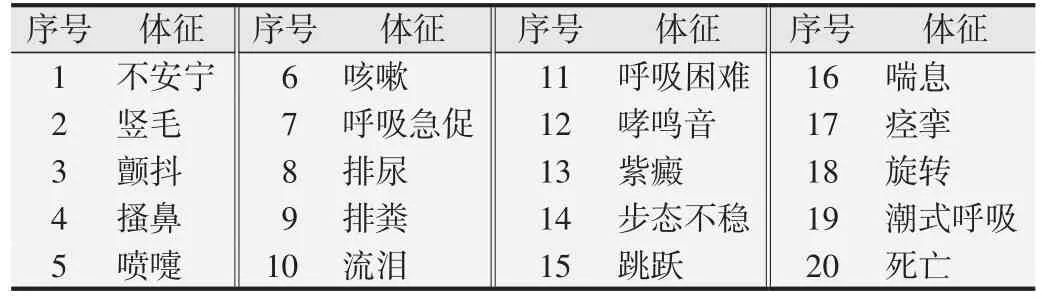
表2 豚鼠過敏反應觀察體征
1.2.6 重復吸入亞慢性毒性試驗[6,10]取6~8 周齡大鼠40 只,隨機分為空白對照組和受試樣品組,每組雌、雄各10只,空白對照組吸入潔凈空氣;受試樣品組吸入CFC115 (3 205 g/m3)和HFC1243zf (856 g/m3)混合氣體,口鼻暴露每天染毒2 h,連續染毒21 d。在染毒期間觀察和檢測大鼠的臨床體征、進食量、體質量增長變化。染毒結束取血檢測血常規:紅細胞計數(RBC)、白細胞計數(WBC)及5 項分類、紅細胞容積(HCT)、血紅蛋白(HGB)、血小板計數(PLT)及凝血酶原時間(PT)、活化部分凝血活酶時間(APTT)共12 項;血液生化學:丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、肌酐(CREA)、尿素氮(UREA)、堿性磷酸酶(ALP)、血糖(GLU)、總膽紅素(TBil)、總膽固醇(TC)、甘油三酯(TG)、總蛋白(TP)、白蛋白(ALB)、鉀離子(K)、氯離子(Cl)、鈉離子(Na)共14 項;尿液:比重(SG)、酸堿度(pH)、亞硝酸鹽(NIT)、尿蛋白(PRO)、潛血(ERY)、尿膽紅素(BIL)、尿膽原(UBG)、酮體(KET)、尿糖(GLU)、白細胞(LEU)共10 項指標。解剖大鼠組織器官,稱取臟器質量,計算臟器系數,觀察病理組織學變化,發現異常組織器官按5級法(見表1)對病變進行觀察、判定。
1.3 統計學分析及判定
試驗動物的體質量、血常規、生化學、臟器系數和回變菌落數等指標的統計以表示,采用SPSS 19.0 軟件進行回歸計算和統計分析,經F檢驗、泊松分布或雙側t檢驗判定P值。大鼠重復吸入刺激性試驗根據呼吸道局部大體觀察和病理學觀察進行級別判定;豚鼠全身主動過敏試驗根據致敏反應出現的癥狀和程度進行級別判定。細胞毒性試驗≤1級為陰性,2級為可疑陽性,≥3 級為陽性。Ames 試驗受試樣品各濃度組與陰性對照組比較,各試驗菌株的平均回變菌落數≥2倍判定為陽性。
2 結果
2.1 細胞毒性試驗
空白對照組細胞生長良好;陽性對照組細胞毒性反應均為4 級,判定為強陽性,表明本試驗敏感、有效;陰性對照組和受試樣品組細胞毒性反應均為0級。見表3。
表3 細胞毒性試驗結果(,n=8)
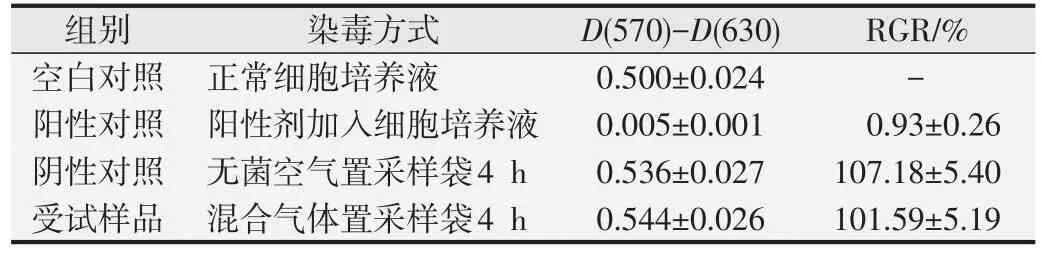
表3 細胞毒性試驗結果(,n=8)
2.2 Ames試驗
空白對照組與陰性對照組各試驗菌株的平均回變菌落數均在正常范圍內;陽性對照組各試驗菌株的平均回變菌落數為陰性對照組的2 倍以上,判定為陽性結果;受試樣品各濃度組各試驗菌株的平均回變菌落數與陰性對照組基本一致,未見明顯升高。見表4。
表4 Ames試驗回變菌落數觀察(,n=3)
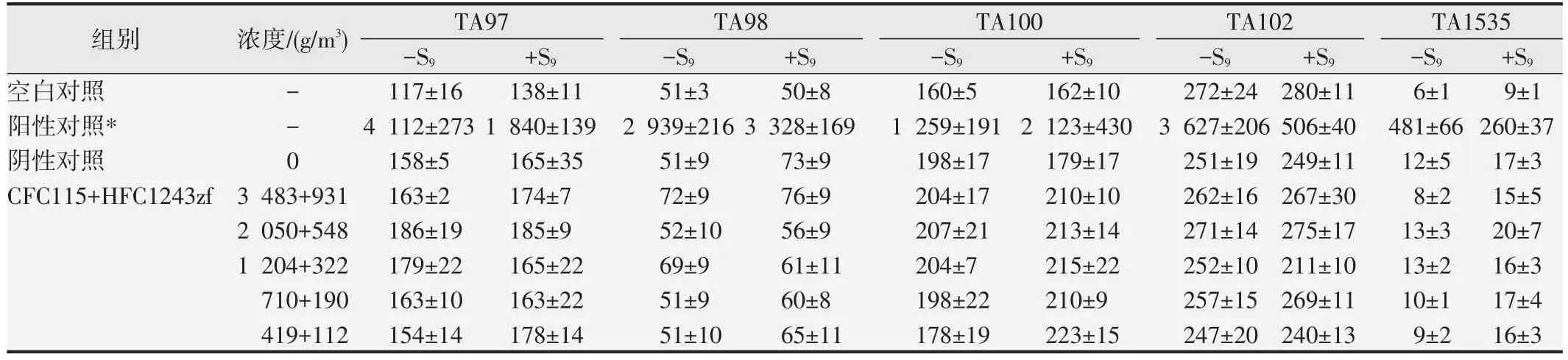
表4 Ames試驗回變菌落數觀察(,n=3)
*-S9:TA97、TA98(敵克松,50 mg/皿);TA100、TA102(甲基磺酸甲酯,2.5 mg/皿、4.0 mg/皿);TA1535(疊氮鈉,1.5 mg/皿).+S9:TA97、TA98、TA100(2-氨基芴,20 mg/皿);TA102(1,8-二羥基蒽醌,100 mg/皿);TA1535(2-氨基蒽,20 mg/皿).
2.3 急性吸入毒性試驗
持續染毒4 h和14 d觀察期,大鼠均未發現毒性反應,觀察期結束全部存活大鼠體質量平均增長46~115 g,大體剖檢無異常發現。其半數致死濃度(LC50)大于口鼻暴露染毒實際濃度,即3 115 g/m3的CFC115和832 g/m3的HFC1243zf。見表5。
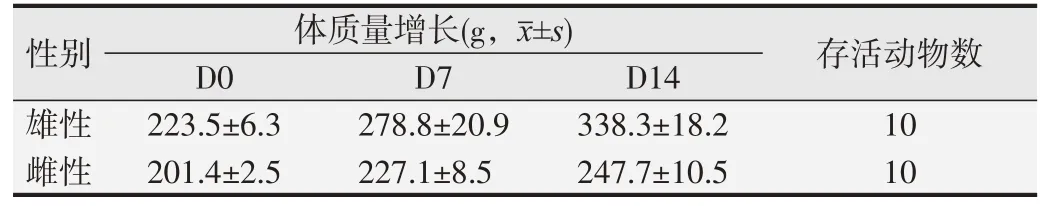
表5 急性吸入毒性試驗結果(n=10)
2.4 重復吸入局部刺激性試驗
口鼻暴露染毒期間,大鼠未見異常,末次染毒后4 h 和24 h,分別處死半數大鼠,大體剖檢觀察呼吸道、上消化道黏膜未發現紅腫、充血和出血等現象,體表和內臟器官未見組織異常改變。組織病理學檢查氣管、支氣管、肺臟、食管、咽喉、鼻腔、口腔黏膜等各層組織結構清晰,細胞形態、數量比例未見異常,未見變性、水腫、壞死、出血、異常增生、炎癥等組織病理學改變,按5級法對病變分級均為0~1級。
2.5 全身主動致敏試驗
豚鼠口鼻暴露染毒激發致敏第22 天和第29 天分別大體觀察:空白對照組和受試樣品組,未出現過敏反應體征;陽性對照組全部動物則出現顫抖、搔鼻、呼吸急促、呼吸困難、步態不穩、喘息及痙攣等強過敏反應。見表6。
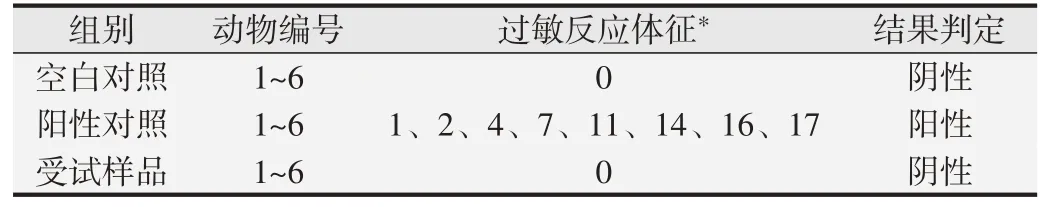
表6 豚鼠激發致敏后全身致敏反應觀察
2.6 重復吸入亞慢性毒性試驗
口鼻暴露染毒期間,大鼠精神好、行為正常、反應敏捷、被毛潤澤、棕黑色軟便,未見明顯中毒體征,與空白對照組比較,大鼠飼料攝入量和體質量降低(P<0.05 或P<0.01),血液Bas、AST、UREA 和腦系數值升高(P<0.05或P<0.01),尿液還出現NIT、KET和PRO 升高(P<0.05 或P<0.01)等;另外,雄性大鼠血液Mon、Eos、ALT、ALP和尿液pH升高,肺臟濕質量和系數降低(P<0.05 或<0.01);雌性大鼠血液RBC、HGB、HCT、TBiL、K 和腎上腺系數值升高(P<0.05 或P<0.01),血液WBC、尿液pH 和卵巢濕重值降低(P<0.05 或P<0.01)。見表7~10。組織病理學觀察(見圖1)發現,受試樣品組5 只大鼠可見心內膜灶性或多灶性壞死,單核細胞浸潤,病變等級在1~3 級,未見呼吸系統器官和其他組織臟器與受試樣品暴露染毒相關病變。
表7 受試樣品對大鼠體質量增長及攝食量的影響(,g)
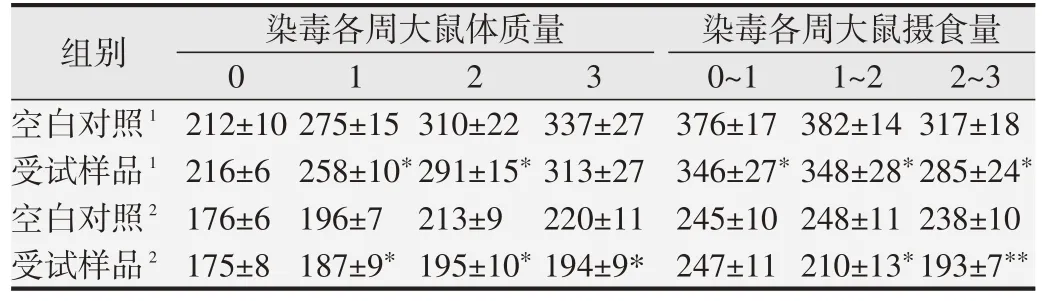
表7 受試樣品對大鼠體質量增長及攝食量的影響(,g)
1:雄鼠;2:雌鼠.與同一周次對照組比較,*P<0.05;**P<0.01.
表8 受試樣品對大鼠血液學部分指標的影響()

表8 受試樣品對大鼠血液學部分指標的影響()
與空白對照組比較,*P<0.05;**P<0.01.
表9 受試樣品對大鼠血液生化學部分指標的影響()
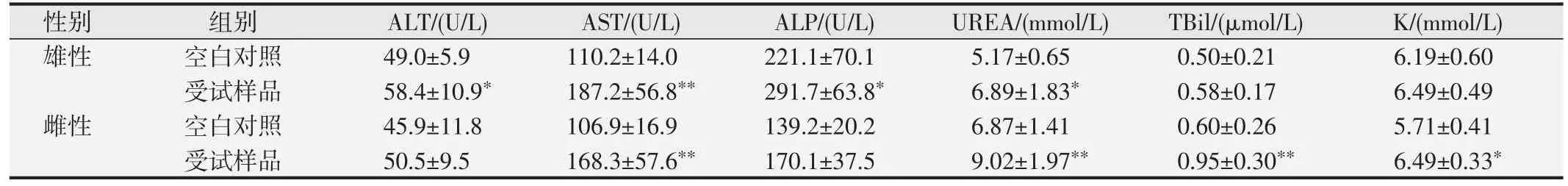
表9 受試樣品對大鼠血液生化學部分指標的影響()
與空白對照組比較,*P<0.05;**P<0.01.
表10 受試樣品對大鼠尿液及臟器部分指標的影響()
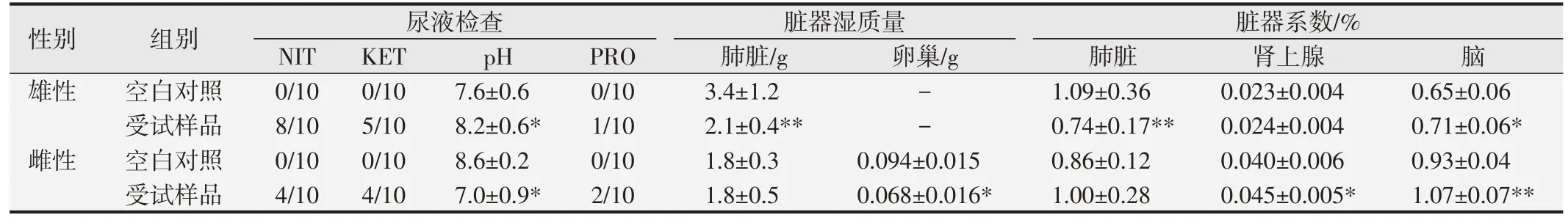
表10 受試樣品對大鼠尿液及臟器部分指標的影響()
與空白對照組比較,*P<0.05;**P<0.01.
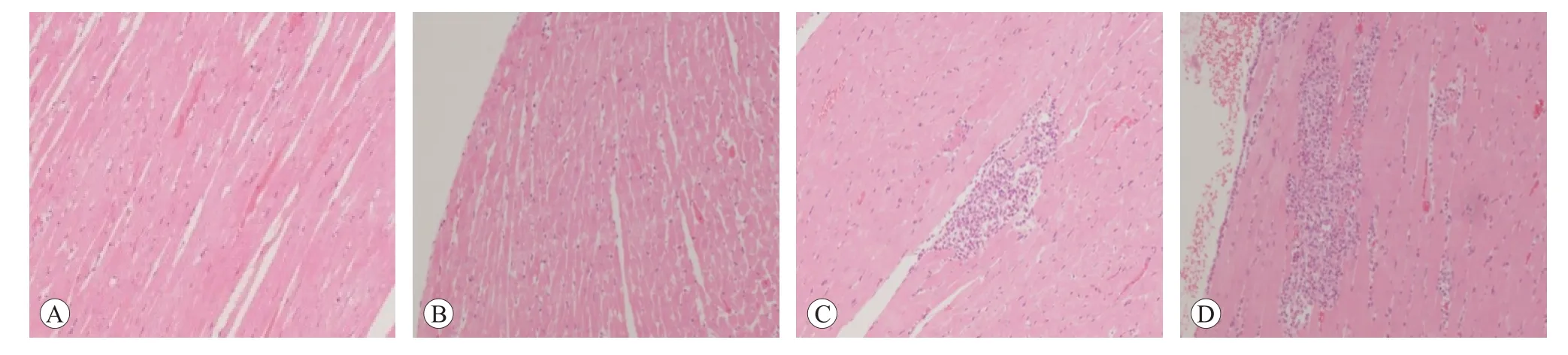
圖1 心肌組織病理學觀察
3 討論
HFA-134a 是國際公認的氟利昂拋射劑替代物,對其安全性已有多方面的研究,LC50>3 114 g/m3[11],與多數氫氟烷烴類相似屬于毒性較低物質[12]。然而,在不同廠家、不同工藝所生產的產品中雜質的成分和含量差別較大,這些雜質的結構類似氟碳化合物,不同氟碳組合的化合物毒性有很大區別,如全氟烷酸類化合物對水生生物和哺乳動物均可產生廣泛的毒性效應,包括肝臟毒性、免疫毒性、生殖和發育毒性以及神經毒性,甚至有可能誘發肝、睪丸、胰臟和乳腺癌[13],2,2,2-三氟乙醇也被證實可導致急性腎衰竭[14],HFA-134a 在3 340 g/m3以上濃度可導致心臟對腎上腺素敏感性增加[11]。CFC115 和HFC1243zf 這兩種雜質是國產HFA-134a 中的主要雜質,歐洲藥典[15]和FDA計量吸入器(MDI)和干粉吸入器(DPI)產品-質量考量工業指南草案[16]規定兩種雜質的含量均不得超過0.005‰,而《中國藥典》2020年版收錄的標準中只規定雜質總量不應超過0.05%[1]649。由于CFC115 和HFC1243zf 這兩種雜質的毒理學安全性評價尚未見文獻報道,因此為制定更加科學的吸入用四氟乙烷標準及雜質的含量限度值范圍,需要依據生物安全性風險評估數據為國產產品的吸入安全性提供技術支撐。
體外毒理學試驗各規程或方法中,對受試樣品的檢測均使用溶液或混懸液融入培養基直接接觸細胞或細菌等,本研究的受試物是氣體,無法溶入液體中,故細胞毒性試驗和Ames 試驗染毒方式采用密閉真空采樣袋置37 ℃培養箱中,每袋按比例充入不同濃度受試樣品氣體[6-7],打開96孔培養板或培養皿頂蓋,讓受試樣品氣體在無菌環境下,較長時間直接接觸染毒細胞或細菌(4 h),閉蓋后置培養箱中37 ℃繼續培養至試驗結束,用最大染毒限度觀察測定結果,未發現體外細胞毒性作用、Ames試驗未發現遺傳毒性;體內試驗在口鼻式染毒裝置中高氣體濃度下染毒,大鼠急性吸入毒性試驗結果顯示其LC50大于本實驗設計的染毒濃度;大鼠重復吸入7 d 未見呼吸道局部刺激性;豚鼠5 次誘導吸入后激發致敏未見全身致敏反應。大鼠連續吸入染毒21 d的亞慢性毒性試驗,在3 205 g/m3的CFC115和856 g/m3的HFC1243zf混合氣體染毒后出現統計學差異的指標如下:攝食量減少、體質量增長緩慢,血液白細胞分類Bas、Mon 百分數增高,生化AST、ALT、T-BIL、ALP、UREA 平均值增高,尿液NIT、KET、個別PRO 和LEU 平均值增高,腦系數值增高和卵巢濕質量值降低,組織病理學發現心內膜灶性或多灶性壞死、單核細胞浸潤的改變,另外雄性大鼠肺臟濕質量值和系數值降低等。其他升高或降低的各指標平均值在各組性別之間出現差異,并無相同項目指標的輔證,認為無毒理學意義。提示該混合氣體在高濃度、連續染毒后,對大鼠機體及臟器器官(肝臟、腎臟、肺臟、心臟、卵巢及腦)具有一定的毒性作用。
四氟乙烷(HFA-134a)的成人每日臨床最大使用量為0.048 g/(kg·d)[17],中國藥典規定雜質總量≤0.05%[1]649,故五氟氯乙烷(CFC115)和3,3,3-三氟丙烯(HFC1243zf) 的成人每日最大暴露量為0.024 mg/(kg·d)。根據大鼠暴露濃度換算大鼠吸入劑量[(樣品物質的量×樣品體積)/氣體標準物質的量]×大鼠的呼吸頻率/大鼠體質量],換算出CFC115的大鼠無可見有害作用劑量(NOAEL)為37.26 g/(kg·d),HFC1243zf 的大鼠NOAEL 為9.96 g/(kg·d),按人體等效劑量=大鼠NOAEL/6.3計算,CFC115 的人等效劑量為5.91 g/(kg·d),HFC1243zf 的大鼠吸入劑量為1.58 g/(kg·d),分別為每日臨床最大暴露量的2.5×105倍和6.6×104倍。以上兩種雜質結果顯示:體外試驗或短期動物試驗在高濃度接觸或吸入染毒下未見安全性風險,但較長期反復高濃度吸入染毒對大鼠機體存在多種毒性靶器官,相關內容未見文獻報道。故控制雜質成分及含量,在臨床使用量較大時(如哮喘等患者使用吸入氣霧劑的頻次較高),須進行嚴格安全性論證及綜合性風險評估。
[本文在2021 年北京環境誘變劑學會“環境中毒物綜合效應與控制高端學術交流會議”青年優秀論文評選中獲一等獎,感謝匯智泰康生物技術(北京)有限公司對本研究的支持]

