Circ_HECTD1調節miR-135a-5p/TP53INP1軸對OGD/R誘導的海馬神經元損傷的影響
逯 琴, 張文敏, 趙 敏
腦卒中是一種嚴重的心腦血管疾病,主要包括缺血性腦卒中和出血性腦卒中,其中缺血性腦卒中主要表現為腦血管破裂或阻塞導致血流量減少,引起神經功能受損,最終導致腦部病變,發病率、致死致殘率均極高[1,2]。缺血性腦卒中的發生機制復雜,多種因素導致神經元損傷與凋亡,如代謝異常、氧化應激及鈣離子超載等[3],目前臨床上對于腦卒中仍缺少有效的治療藥物。環狀RNA(circular RNA,circRNA)是一種單鏈環狀、共價閉合的非編碼RNA,可通過調控多種信號通路參與多種疾病的發生發展[4~6]。環狀RNA含HECT結構域的E3泛素連接酶1(circRNA HECT domain E3 ubiquitin ligase 1,Circ_HECTD1)在缺血腦組織中表達升高,抑制Circ_HECTD1表達能夠顯著改善腦梗死,減輕神經元損傷[7]。研究發現,miR-135a-5p在氧葡萄糖剝奪/復氧(oxygen-glucose deprivation/reoxygenation,OGD/R)誘導的PC12細胞中表達減少,過表達miR-135a-5p能夠顯著改善OGD/R誘導產生的氧化應激反應,抑制炎癥反應,減少細胞凋亡[8]。腫瘤蛋白53誘導型核蛋白1(tumor protein 53-induced nuclear protein 1,TP53INP1)是一種促凋亡蛋白,參與多種腫瘤引起的細胞應激反應,可誘導細胞生長停滯,引起細胞凋亡[9,10]。生物信息學網站預測可知TP53INP1是miR-135a-5p的靶基因。本研究通過進行體外OGD/R誘導海馬神經元損傷,觀察Circ_HECTD1對HT22細胞增殖、凋亡的影響以及對miR-135a-5p/TP53INP1軸的調控機制。
1 材料和方法
1.1 細胞與主要試劑 HT22小鼠海馬神經元細胞由中科院細胞生物研究所提供。胎牛血清(FBS,10099-141)、Lipofectamine 2000轉染試劑盒(BT11668-019)均購自美國賽默飛公司;青鏈霉素(R3470)購自北京康納瑞生物公司;si-Circ_HECTD1、miR-135a-5p模擬物(miR-135a-5p)、anti-miR-135a-5p及其陰性轉染物(si-NC、miR-NC、anti-miR-NC)、Circ_HECTD1野生型質粒(Circ_HECTD1-WT)與突變型質粒(Circ_HECTD1-MUT)、TP53INP1野生型質粒(TP53INP1-WT)與突變型質粒(TP53INP1-MUT)均購自北京六合華大基因公司;TRIzol試劑盒(SH-2366)購自北京凱詩源生物公司;熒光定量PCR檢測試劑盒(BK2100)購自百奧邁科生物公司;MTT細胞增殖檢測試劑盒(M1020)購自北京索萊寶生物公司;Annexin V-FITC/PI凋亡試劑盒(K201-100)購自北京博邁斯科技公司;雙熒光素酶報告基因實驗檢測試劑盒(AAT-12518)購自美國AAT Bioquest公司;Bax抗體(ab182733)、Bcl-2抗體(ab196495)、TP53INP1抗體(ab202026)、羊抗兔二抗(ab6721)購自英國Abcam公司。
1.2 主要儀器 JD-CW16實時熒光定量PCR儀購自山東競道光電科技有限公司;EXFLOW系列流式細胞儀購自北京達科為生物技術公司;LONZA ELx808酶標儀購自美國LONZA公司;Azure Biosystems C150凝膠成像系統購自美國Azure公司。
1.3 細胞培養與分組轉染 常規培養復蘇HT22細胞,并培養于含10% FBS,1%青鏈霉素雙抗的正常DMEM培養基中,置于37 ℃、5%CO2恒溫培養箱中進行傳代培養,待細胞融合≥80%后采用Lipofectamine 2000轉染試劑盒將si-NC、si-Circ_HECTD1、miR-NC、miR-135a-5p、si-Circ_HECTD1+anti-miR-NC、si-Circ_HECTD1+anti-miR-135a-5p分別轉染至HT22細胞中,依次作為si-NC組、si-Circ_HECTD1組、miR-NC組、miR-135a-5p組、si-Circ_HECTD1+anti-miR-NC組、si-Circ_HECTD1+anti-miR-135a-5p組,另將未進行轉染的細胞作為Con組、OGD/R組。
1.4 模型建立 除Con組外,其它7組建立OGD/R模型:棄去原來的培養液,PBS沖洗細胞,加入不含FBS的無糖DMEM培養基,置于常規恒溫培養箱中培養2 h,轉移至含有94%N2、5%CO2、1%O2的缺氧培養基中培養6 h,然后更換正常DMEM培養基,轉移至常規恒溫培養箱中繼續培養12 h。
1.5 qRT-PCR法檢測Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表達 收集各組HT22細胞,采用TRIzol試劑提取各組細胞總RNA,逆轉錄得到cDNA,采用熒光定量PCR檢測試劑盒檢測Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表達,以GAPDH和U6為內參,采用2-△△Ct法計算目的基因相對表達量。qRT-PCR所需引物:Circ_HECTD1上游引物5’-CACGTGTTATCAGGGGCCTT-3’,下游引物5’-CGCCACCCTTGCTTTTCATC-3’;miR-135a-5p上游引物5’-ACAGCCTCCATGGGAATGGAAGCAGGTTGA-3’,下游引物5’-TGGAGTGTGGCGTTCG-3’;TP53INP1上游引物5’-TGGCACTTATTTCCGCCTGTA-3’,下游引物5’-CGTGGCTGGAAGAAGTAGTGA-3’;U6上游引物5’-CGCTTCGGCAGCACATATAC-3’,下游引物5’-TTCACGAATTTGCGTGTCAT-3’;GAPDH上游引物5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物5’-GAAGATGGTGATGGGATTTC-3’。
1.6 MTT檢測細胞活性 收集各組HT22細胞,將細胞密度調整為1×105個/ml,接種至96孔板,每孔加入100 μl細胞懸液,待細胞鋪滿孔底,每孔加入5 mg/ml MTT溶液10 μl,37 ℃培養4 h,棄去培養液,每孔加入DMSO 150 μl,搖床上震蕩10 min,使結晶充分溶解,使用酶標儀于570 nm波長處測定吸光度值(OD值),計算各組細胞存活率:細胞存活率(%)=實驗組OD值/Con組OD值×100%。
1.7 流式細胞術檢測細胞凋亡 收集各組HT22細胞,調整細胞濃度為5×105個/ml。取500 μl細胞懸液,加入5 μl Annexin V-FITC溶液和5 μl PI溶液,孵育10 min,混勻后采用流式細胞儀檢測細胞凋亡率。
1.8 雙熒光素酶報告基因實驗驗證miR-135a-5p與Circ_HECTD1、TP53INP1的靶向關系 根據miR-135a-5p與Circ_HECTD1、TP53INP1序列間的互補結合位點,構建Circ_HECTD1、TP53INP1野生型和突變型質粒載體(Circ_HECTD1-WT與Circ_HECTD1-MUT、TP53INP1-WT與TP53INP1-MUT),并將其分別與miR-NC和miR-135a-5p共轉染至HT22細胞中,轉染48 h后,采用雙熒光素酶報告基因實驗檢測試劑盒檢測熒光素酶活性,以螢火蟲熒光素酶活性與海腎熒光素酶活性的比值作為相對熒光素酶活性。
1.9 Western blot法檢測Bax、Bcl-2、TP53INP1蛋白表達 收集各組HT22細胞,加入RIPA裂解液提取總蛋白,采用BCA法檢測蛋白濃度,進行SDS-PAGE電泳,轉移至PVDF膜上,5%脫脂牛奶37 ℃封閉2 h,加入Bax、Bcl-2、TP53INP1一抗,4 ℃孵育過夜,再加入HRP標記的二抗,37 ℃孵育2 h,ECL顯色后使用凝膠成像系統獲取圖像并分析條帶灰度值,以β-actin為內參,計算目的蛋白的相對表達量。

2 結 果
2.1 Circ_HECTD1、miR-135a-5p、TP53INP1在OGD/R誘導的HT22細胞損傷中的表達 與Con組比較,OGD/R組Circ_HECTD1與TP53INP1 mRNA表達均上調,miR-135a-5p表達下調(P<0.05)。結果(見表1)。
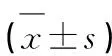
表1 各組HT22細胞中Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表達比較
2.2 沉默Circ_HECTD1表達對OGD/R誘導的HT22細胞損傷及miR-135a-5p、TP53INP1表達的影響 與Con組比較,OGD/R組HT22細胞存活率和Bcl-2蛋白表達降低,凋亡率和Bax蛋白表達升高(P<0.05);與OGD/R組、si-NC組比較,si-Circ_HECTD1組Circ_HECTD1、TP53INP1 mRNA和蛋白表達降低,miR-135a-5p表達升高,存活率和Bcl-2蛋白表達升高,凋亡率和Bax蛋白表達降低(P<0.05)。結果(見圖1、圖2和表2、表3)。
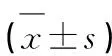
表2 各組HT22細胞Circ_HECTD1、miR-135a-5p、TP53INP1 mRNA表達存活率、凋亡率比較
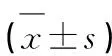
表3 各組HT22細胞中TP53INP1、Bax、Bcl-2蛋白表達比較

圖1 各組HT22細胞凋亡流式圖

A:Con組;B:OGD/R組;C:si-NC組;D:si-Circ_HECTD1組圖2 各組HT22細胞中TP53INP1、Bax、Bcl-2蛋白表達
2.3 Circ_HECTD1與miR-135a-5p、miR-135a-5p與TP53INP1的靶向關系 生物信息學網站(https://starbase.sysu.edu.cn/index.php)預測可知,Circ_HECTD1與miR-135a-5p、miR-135a-5p與TP53INP1序列間均具有互補結合位點(見圖3)。與轉染miR-NC比較,轉染miR-135a-5p的HT22細胞中Circ_HECTD1-WT以及TP53INP1-WT的相對熒光素酶活性降低(P<0.05);但對Circ_HECTD1-MUT和TP53INP1-MUT的相對熒光素酶活性無顯著影響(P>0.05)。結果(見表4)。
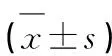
表4 雙熒光素酶報告基因實驗

圖3 Circ_HECTD1與miR-135a-5p、miR-135a-5p與TP53INP1結合位點
2.4 過表達miR-135a-5p對OGD/R誘導的HT22細胞損傷及TP53INP1表達的影響 與Con組比較,OGD/R組TP53INP1 mRNA和蛋白表達均升高(P<0.05);與OGD/R組、miR-NC組比較,miR-135a-5p組miR-135a-5p表達升高,TP53INP1 mRNA和蛋白表達均降低,細胞存活率和Bcl-2蛋白表達升高,凋亡率和Bax蛋白表達降低(P<0.05)。結果(見圖4、圖5和表5、表6)。
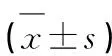
表5 各組HT22細胞miR-135a-5p、TP53INP1 mRNA表達、存活率與凋亡率比較
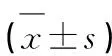
表6 各組HT22細胞中TP53INP1、Bax、Bcl-2蛋白表達比較

圖4 各組HT22細胞凋亡流式圖

A:Con組;B:OGD/R組;C:miR-NC組;D:miR-135a-5p組圖5 各組HT22細胞中TP53INP1、Bax、Bcl-2蛋白表達
2.5 抑制miR-135a-5p逆轉沉默Circ_HECTD1表達對OGD/R誘導的HT22細胞損傷的影響 與si-Circ_HECTD1+anti-miR-NC組比較,si-Circ_HECTD1+anti-miR-135a-5p組miR-135a-5p表達降低,TP53INP1 mRNA和蛋白表達升高,細胞存活率和Bcl-2蛋白表達降低,細胞凋亡率和Bax蛋白表達升高(P<0.05)。結果(見圖6、圖7和表7、表8)。
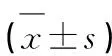
表7 各組HT22細胞miR-135a-5p、TP53INP1 mRNA表達、存活率與凋亡率比較
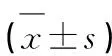
表8 各組HT22細胞TP53INP1、Bax、Bcl-2蛋白表達比較
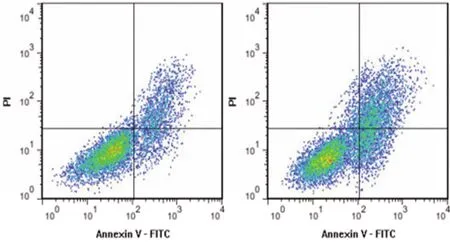
si-Circ_HECTD1+anti-miR-NC組;si-Circ_HECTD1+anti-miR-135a-5p組圖6 各組HT22細胞凋亡流式圖

A:si-Circ_HECTD1+anti-miR-NC組;B:si-Circ_HECTD1+anti-miR-135a-5p組圖7 各組HT22細胞TP53INP1、Bax、Bcl-2蛋白表達
3 討 論
近年來腦卒中的發病率與死亡率逐年升高,目前臨床上對于腦卒中的治療藥物主要是神經保護類藥物,其靶點單一,易出現耐藥性,尋找新的治療靶點是腦血管疾病的研究重點[11,12]。細胞凋亡是缺血性腦卒中神經元損傷的主要形式,缺血后腦組織中大量氧自由基的產生導致促炎因子釋放,最終引起細胞損壞和凋亡[13,14]。海馬區是腦缺血后最易受損的區域[15],本實驗采用小鼠海馬神經元HT22細胞建立OGD/R誘導細胞損傷體外模型,結果顯示,OGD/R誘導后HT22細胞存活率降低,凋亡率升高,Bax表達升高,Bcl-2表達降低,提示海馬神經元HT22細胞受損,細胞發生凋亡,與袁美玲等[16]研究結果一致。
研究發現[17],沉默Circ_HECTD1表達可有效降低癲癇模型小鼠海馬神經元凋亡,減輕炎癥反應。另有研究證實[18],Circ_HECTD1敲除后,通過調節miR-27a-3p/FSTL1軸,減輕OGD/R誘導HT22細胞損傷,為腦梗死的治療提供新的靶點。本研究發現沉默Circ_HECTD1可通過抑制細胞凋亡減輕HT22細胞損傷,與Zhang等[18]研究結果一致,但具體作用機制尚不完全清晰。
miR-135a-5p已被證實在腦缺氧/復氧損傷中發揮關鍵作用[19]。研究發現,M2小膠質細胞來源的miR-135a-5p表達上調,抑制神經元自噬,減輕缺血性腦損傷[20]。TP53INP1影響OGD/R誘導的神經元細胞活力,促進神經元中炎癥與氧化應激的發生,誘導細胞凋亡[21,22]。本研究結果顯示,HT22細胞中TP53INP1上調,miR-135a-5p下調;雙熒光素酶報告基因檢測證實TP53INP1是miR-135a-5p的靶基因;且過表達miR-135a-5p可通過下調TP53INP1表達減輕HT22細胞損傷。另外,雙熒光素酶報告基因檢測證實,miR-135a-5p是Circ_HECTD1的靶基因;且沉默Circ_HECTD1可顯著上調miR-135a-5p表達,下調TP53INP1表達,而抑制miR-135a-5p表達能夠顯著逆轉沉默Circ_HECTD1對HT22細胞損傷的保護作用。以上研究結果提示Circ_HECTD1可通過調控miR-135a-5p/TP53INP1信號軸發揮對海馬神經元損傷的保護作用。
綜上所述,沉默Circ_HECTD1表達能夠有效減少細胞凋亡,促進細胞增殖,保護OGD/R誘導的海馬神經元損傷,且其作用機制可能與調節miR-135a-5p/TP53INP1信號軸有關。但目前缺血性腦卒中發病機制復雜,Circ_HECTD1在缺血性腦卒中的研究尚少,其具體影響機制還需進一步深入探索。

