酵母糖蛋白工程的研究進(jìn)展
李婉情,張 蕾
(天津大學(xué)生命科學(xué)學(xué)院,天津 300072)
使用生物系統(tǒng)生產(chǎn)生物藥物這一理念于1982年提出[1],幾十年來(lái),大量生物藥物的出現(xiàn)改變了許多疾病的治療方法。在生物藥物中,70%以上的是糖蛋白,這顯示了生物表達(dá)系統(tǒng)對(duì)蛋白進(jìn)行糖基化修飾的重要性,常見(jiàn)的糖基化修飾類型有N-糖基化和O-糖基化。能夠進(jìn)行糖基化修飾的生物系統(tǒng)有酵母、哺乳動(dòng)物細(xì)胞、昆蟲(chóng)細(xì)胞和轉(zhuǎn)基因動(dòng)物等。其中酵母表達(dá)系統(tǒng)中,常用的生產(chǎn)重組蛋白的菌株有釀酒酵母(Saccharomyces cerevisiae)和畢赤酵母(Pi?chia pastoris),約有20%的生物藥物是由釀酒酵母生產(chǎn)的。
酵母作為一種真核單細(xì)胞微生物,其培養(yǎng)方式簡(jiǎn)單、生長(zhǎng)速度快,可在60 h 內(nèi)到達(dá)平臺(tái)期,與哺乳動(dòng)物細(xì)胞培養(yǎng)相比,縮減了生產(chǎn)目的產(chǎn)品的時(shí)間和成本。1996、2009 年分別完成了釀酒酵母和畢赤酵母的基因組測(cè)序[2,3]。除作為第一個(gè)完成測(cè)序的真核生物之外,酵母也存在完整的單基因缺失文庫(kù)[4],這進(jìn)一步推進(jìn)了對(duì)酵母基因功能的研究[5-7],目前,已經(jīng)對(duì)約5 800 種蛋白質(zhì)的生物學(xué)功能有基礎(chǔ)的了解,約占總量的85%,這一比例遠(yuǎn)遠(yuǎn)高于其他真核生物。在酵母中可使用多種基因編輯系統(tǒng),如同源重組,釀酒酵母擁有極強(qiáng)的同源重組能力,40 bp 的同源序列即可完成重組,但該系統(tǒng)無(wú)法回收篩選標(biāo)記。Cre/loxP位點(diǎn)特異性重組系統(tǒng)[8]和CRISPR/Cas9 系統(tǒng)在酵母中成功構(gòu)建并解決了這個(gè)問(wèn)題,實(shí)現(xiàn)了篩選標(biāo)記的回收與利用。Dicarlo 等[9]首次在酵母中以90 bp 的雙鏈DNA 作為供體,使用CRISPR/Cas9 系統(tǒng)進(jìn)行基因的破壞和插入,均可達(dá)到近100%的效率。為了進(jìn)一步提高基因編輯的效率,衍生出CRISPR/Cas9 多基因編輯系統(tǒng),Shi 等[10]使用CRISPR/Cas9 開(kāi)發(fā)了1個(gè)Di-CRISPR平臺(tái),該平臺(tái)實(shí)現(xiàn)了總長(zhǎng)為24 kb的(R,R)-2,3-丁二醇途徑的DNA 大片段的整合。這些高效的基因編輯系統(tǒng)的構(gòu)建也進(jìn)一步推動(dòng)了酵母工程菌株的研究進(jìn)程。
酵母能夠?qū)Φ鞍踪|(zhì)進(jìn)行翻譯后修飾,如二硫鍵形成、亞基組裝、乙酰化和糖基化等[11],但對(duì)外源蛋白獨(dú)特的N-高甘露糖基化修飾方式可能會(huì)引起免疫反應(yīng),并導(dǎo)致血液中治療性蛋白質(zhì)被快速清除[12,13]等影響,限制了酵母系統(tǒng)的應(yīng)用范圍。為了進(jìn)一步發(fā)揮酵母的應(yīng)用價(jià)值,需要在酵母中引入人源糖蛋白修飾途徑,改變糖蛋白的修飾類型。本研究介紹了酵母在蛋白生產(chǎn)方面的應(yīng)用、N-糖基化修飾過(guò)程以及人源化改造的研究進(jìn)展。
1 酵母在蛋白生產(chǎn)方面的應(yīng)用
許多細(xì)菌和真核細(xì)胞被用作生產(chǎn)藥物蛋白的平臺(tái),其中原核生物大腸桿菌是最常用的系統(tǒng)之一,1982 年使用該系統(tǒng)生產(chǎn)的第一個(gè)重組胰島素的批準(zhǔn)[1]開(kāi)啟生物藥物研究的大門(mén),目前使用該系統(tǒng)產(chǎn)生的重組蛋白占總產(chǎn)量的30%以上[14]。但由于原核系統(tǒng)無(wú)翻譯后修飾進(jìn)程,不能正確形成二硫鍵的局限性,使其只能生產(chǎn)無(wú)需修飾的小型重組蛋白。而真核表達(dá)系統(tǒng)可以突破這種限制,常用的真核系統(tǒng)包括倉(cāng)鼠卵巢細(xì)胞[15]、昆蟲(chóng)細(xì)胞[16]和酵母[17]等。與其他的哺乳動(dòng)物表達(dá)系統(tǒng)相比,酵母系統(tǒng)不僅培養(yǎng)成本低,而且酵母細(xì)胞壁的存在也增加了細(xì)胞的耐受性,使其不容易受到溫度、pH 以及環(huán)境中其他物質(zhì)的影響。除此之外,酵母中各種成熟高效基因編輯系統(tǒng)的使用,簡(jiǎn)化了基因編輯的過(guò)程,縮減了工程化酵母構(gòu)建的時(shí)間,例如Horwitz 等[18]運(yùn)用酵母天然的間隙修復(fù)能力[19],將具有同源序列的gRNA 片段在菌體內(nèi)修復(fù)成完整質(zhì)粒,進(jìn)行正常CRISPR/Cas9 基因編輯進(jìn)程,敲除3 個(gè)基因,效率可達(dá)到64%,且省去了體外構(gòu)建gRNA 質(zhì)粒的時(shí)間。這一系列優(yōu)勢(shì)使酵母成為熱門(mén)的細(xì)胞工廠。
1987 年釀酒酵母生產(chǎn)的重組胰島素被正式批準(zhǔn)[1],此后以酵母為表達(dá)系統(tǒng)產(chǎn)生的一系列藥物蛋白陸續(xù)投入使用。如表1 所示,使用酵母系統(tǒng)產(chǎn)生的藥物蛋白主要包括激素(如胰島素類似物和生長(zhǎng)激素)、疫苗(如人乳頭瘤病毒疫苗和乙肝疫苗)以及血液相關(guān)因子物質(zhì)等[20]。然而,由于釀酒酵母本身特有的對(duì)蛋白的N-高甘露糖基化修飾[21]可能會(huì)減弱糖蛋白的活性、改變免疫原性并減少其半衰期。與釀酒酵母相比,畢赤酵母糖基化修飾程度和糖基化位點(diǎn)占有率有所減少,通常釀酒酵母中產(chǎn)生約50個(gè)甘露糖殘基,而畢赤酵母中產(chǎn)生約30 個(gè)甘露糖殘基。并且畢赤酵母可以進(jìn)行高密度細(xì)胞培養(yǎng)的特性能夠進(jìn)一步提高產(chǎn)品產(chǎn)量。為了減少酵母的甘露糖基化修飾程度,敲除酵母中α-1,6 甘露糖基轉(zhuǎn)移酶編碼基因OCH1,負(fù)責(zé)添加α-1,6 甘露糖主鏈的的第一個(gè)α-1,6-Man,起始甘露糖主鏈的形成[22](圖1)。在釀酒酵母中OCH1和MNN9基因的敲除使其細(xì)胞壁的完整性遭到破壞,進(jìn)而造成缺失株嚴(yán)重的生長(zhǎng)缺陷[23]。但將畢赤酵母中OCH1基因敲除之后,缺失株的生長(zhǎng)狀況沒(méi)受到顯著影響[24],并且在該菌株中引入哺乳動(dòng)物糖基轉(zhuǎn)移酶基因,成功產(chǎn)生復(fù)雜的唾液酸化糖蛋白[25,26],這使其在生產(chǎn)生物藥物方面擁有更加廣闊的前景。
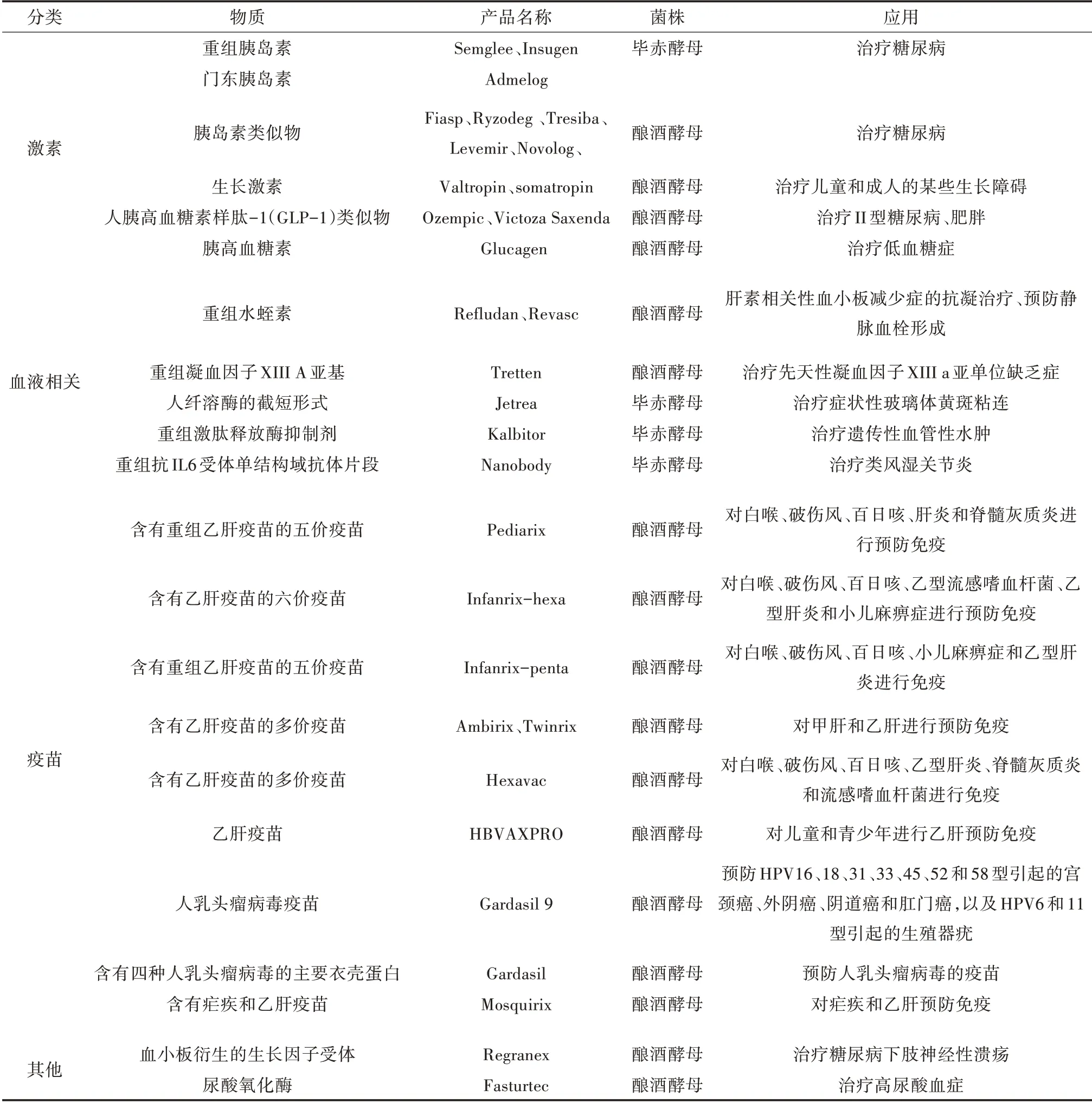
表1 使用釀酒酵母和畢赤酵母生產(chǎn)的蛋白產(chǎn)品
2 酵母的N-糖基化過(guò)程
在酵母中,蛋白的糖基化修飾分為2 種類型:N-糖基化和O-糖基化,其中N-糖基化修飾對(duì)蛋白活性的維持,促進(jìn)蛋白分泌以及維持蛋白熱穩(wěn)定性具有重要作用[26,27]。如圖1 所示,釀酒酵母的N-糖基化修飾進(jìn)程可以分為2 部分,前半部分進(jìn)程發(fā)生在內(nèi)質(zhì)網(wǎng)中,以磷酸多萜醇(Dol-P)為載體,在糖基轉(zhuǎn)移酶、甘露糖苷酶和寡糖基轉(zhuǎn)移酶等的作用下,最終形成結(jié)構(gòu)為Man8GlcNAc2寡糖鏈,并連接在蛋白質(zhì)的天冬氨酸殘基上,這一進(jìn)程在真核生物中較為保守[21]。之后該寡糖肽進(jìn)入高爾基體中,在糖基轉(zhuǎn)移酶和糖苷酶等的作用下形成高甘露糖基化的糖鏈。這一進(jìn)程與哺乳動(dòng)物相比,產(chǎn)生了明顯的差異。在哺乳動(dòng)物中,該寡糖肽經(jīng)過(guò)甘露糖苷酶修飾,形成糖鏈結(jié)構(gòu)為Man5GlcNAc2寡糖肽,之后在巖藻糖基轉(zhuǎn)移酶、半乳糖基轉(zhuǎn)移酶等酶作用下,形成雜合性或者復(fù)雜型聚糖結(jié)構(gòu)[28,29]。

圖1 酵母與人源化畢赤酵母的N-糖基化途徑
2.1 酵母內(nèi)質(zhì)網(wǎng)中寡糖結(jié)構(gòu)的組裝
在Alg7 的作用下,將GlcNAc-1-P 轉(zhuǎn)移Dol-P 載體 上 形 成Dol-PP-GlcNAc[30];在Alg13/Alg14、Alg1的作用下依次添加β-1,4-GlcNAc、β-1,4-Man 形成Dol-PP-GlcNAc2Man5;在Alg2 2 次連續(xù)作用下添加α-1,3-Man、α-1,6-Man,之后在Alg11 的作用下添加α-1,3-Man 形成Dol-PP-GlcNAc2Man5,完成寡糖鏈在內(nèi)質(zhì)網(wǎng)膜胞質(zhì)一側(cè)的組裝。在翻轉(zhuǎn)酶的作用下將與磷酸多萜醇連接的寡糖翻轉(zhuǎn)到內(nèi)質(zhì)網(wǎng)膜內(nèi)部[31],按照Alg3、Alg9、Alg12、Alg9、Alg6、Alg8、Alg10的順序在寡糖上依次添加α-1,3-Man、α-1,2-Man、
α-1,6-Man、α-1,6-Man、α-1,3-Glc、α-1,3-Glc、α-1,2 -Glc,形成Dol-PP-Man9GlcNAc2Glc3。之后磷酸多萜醇上的寡糖鏈在寡糖基轉(zhuǎn)移酶復(fù)合物的作用下(Oligosaccharyltransferase Complex,OST)與蛋白質(zhì)上特定的天冬氨酸殘基連接形成寡糖肽[32]。接下來(lái),在葡糖苷酶(Gls2、Gls2/Gtb1)、甘露糖苷酶(Mns1)作用下依次去除3 個(gè)α-Glc 和1 個(gè)α-1,2-Man,形成糖鏈結(jié)構(gòu)為Man8GlcNAc2的寡糖肽,并轉(zhuǎn)移到高爾基體中[33]。
2.2 酵母高爾基體中寡糖結(jié)構(gòu)的組裝
寡糖肽進(jìn)入高爾基體之后,甘露糖基轉(zhuǎn)移酶(Och1)將α-1,6-Man 添加到寡糖的α-1,3-Man 上,啟動(dòng)甘露糖外鏈的延伸進(jìn)程[21]。OCH1基因的敲除會(huì)導(dǎo)致酵母細(xì)胞壁的完整性被破壞,生長(zhǎng)速度降低,代謝進(jìn)程異常等影響[34]。寡糖肽在蛋白復(fù)合物Man-Pol I 和Man-Pol II 的依次作用下,在釀酒酵母中將糖鏈延伸至50 個(gè)甘露糖左右,在畢赤酵母中延伸至約30 個(gè)甘露糖殘基形成甘露糖主鏈;由Mnn2添加主鏈上第一層α-1,2-Man 側(cè)鏈,Mnn5 添加第二層α-1,2-Man,Mnn4 負(fù)責(zé)Mnn-P 結(jié)構(gòu)的添加,最后Mnn1 可以在寡糖鏈的Mnn-P 上添加α-1,3-Man[35]。敲除MNN1未對(duì)酵母生長(zhǎng)產(chǎn)生顯著影響,也未顯著降低蛋白的糖基化修飾程度[36]。
3 酵母糖基化修飾的人源化改造
酵母的糖基化修飾可以幫助蛋白折疊,但是酵母中這種獨(dú)特的N-糖基化對(duì)蛋白具有負(fù)面影響,比如抑制蛋白酶的活性或改變蛋白免疫原性等[37],因此希望構(gòu)建能夠去除酵母糖特異性糖基化修飾并生成復(fù)合型糖基化的工程酵母菌株。近些年來(lái),在酵母中進(jìn)行人源糖基化改造,基本遵循2 種主要策略,一種是消除酵母糖基轉(zhuǎn)移酶,另一種是干擾脂連接寡糖(Lipid-linked oligosaccharide,LLO)的組裝降低蛋白的糖基化修飾程度,之后引入哺乳動(dòng)物中的糖基轉(zhuǎn)移酶實(shí)現(xiàn)人源化糖鏈的合成。
近些年對(duì)酵母進(jìn)行改造及產(chǎn)生的糖鏈類型見(jiàn)表2。在酵母中進(jìn)行人源化改造的第一步,需要通過(guò)敲除酵母中在N-高甘露糖鏈合成中的關(guān)鍵基因,來(lái)降低酵母中的糖基化修飾程度,如圖1 所示,酵母中OCH1基因編碼α-1,6-甘露糖基轉(zhuǎn)移酶,是甘露糖外鏈形成的關(guān)鍵基因。在釀酒酵母中敲除OCH1基因 后,可 以 檢 測(cè) 到 糖 鏈 結(jié) 構(gòu)Man9-10GlcNAc2[36]。Mnn4 和Mnn1 分別負(fù)責(zé)Mnn-P 和最后1 個(gè)α-1,3-Man 的添加。在三重缺失釀酒酵母菌株Δoch1 Δmnn1 Δmnn4中引入來(lái)自海棗曲霉的α-1,3-甘露糖苷酶后,酵母中檢測(cè)到更接近哺乳動(dòng)物的糖鏈結(jié)構(gòu)Man5GlcNAc2[38]。但是,由于酵母細(xì)胞壁中甘露糖殘基約占細(xì)胞壁的10%~20%,該工程酵母菌株中甘露糖外鏈的缺失,導(dǎo)致酵母細(xì)胞壁完整性缺失,造成嚴(yán)重的生長(zhǎng)缺陷。研究發(fā)現(xiàn),酵母中BEM4和BEM4下游基因RHO1過(guò)表達(dá)可以在一定程度上恢復(fù)Δoch1缺失株的生長(zhǎng)缺陷[39]。其中Bem4 蛋白可能與細(xì)胞信號(hào)轉(zhuǎn)導(dǎo)途徑相關(guān),Rho1 蛋白調(diào)節(jié)蛋白激酶C(Pkc1p)和細(xì)胞壁合成酶(β-1,3-葡聚糖合酶)。推測(cè)由于BEM4和RHO1的過(guò)表達(dá)增加了β-葡聚糖的合成,修復(fù)OCH1缺失造成的細(xì)胞壁合成缺陷。因此,通過(guò)表達(dá)酵母中細(xì)胞壁合成相關(guān)的基因或與β-1,3-葡聚糖合成的相關(guān)基因,在一定程度上能夠彌補(bǔ)菌株由于OCH1缺失造成的甘露糖鏈合成缺陷的問(wèn)題。在畢赤酵母中破壞OCH1表達(dá)后,檢測(cè)到酵母細(xì)胞中主要糖鏈類型為Man8-12GlcNAc2,并且該基因的敲除未對(duì)酵母生長(zhǎng)產(chǎn)生顯著影響[40]。造成這一差異的主要原因有2 點(diǎn),一是由于與釀酒酵母相比,畢赤酵母中N-糖基化修飾位點(diǎn)減少,糖基化程度減弱,細(xì)胞壁中甘露糖含量低[11],所以糖蛋白中甘露糖含量的減少對(duì)畢赤酵母細(xì)胞壁完整性的影響較小,二是由于在Δoch1缺失菌株中檢測(cè)到截短的Och1 蛋白活性,或許該蛋白的存在維持了缺失菌株正常生命活動(dòng)[41]。之后,在該菌株中引入哺乳動(dòng)物糖基轉(zhuǎn)移酶基因,成功產(chǎn)生了復(fù)雜的唾液酸化糖蛋白[25],這使畢赤酵母菌株在生產(chǎn)生物藥物方面擁有更大的潛力。

表2 有關(guān)酵母改造及產(chǎn)生的糖鏈類型
另外,也可以通過(guò)干擾LLO 的組裝來(lái)影響高甘露糖鏈的形成,LLO 的組裝在ER 中完成。如圖1 所示,ALG3基因編碼α-1,3-甘露糖基轉(zhuǎn)移酶,負(fù)責(zé)在Dol-PP-GlcNAc2Man5的支鏈上添加1個(gè)α-1,3-Man,在酵母中該基因的敲除可以阻止PP-GlcNAc2Man6的合成,進(jìn)而影響糖基轉(zhuǎn)移酶對(duì)底物的識(shí)別。在Δoch1缺失菌株中敲除ALG3基因后,在雙缺菌株中檢測(cè)到Man5GlcNAc2糖鏈結(jié)構(gòu)[42]。另外在多形漢遜酵母(Hansenula polymorpha)中,同樣ALG11和ALG3敲除后檢測(cè)到糖鏈結(jié)構(gòu)主要為Man3GlcNAc2。這說(shuō)明通過(guò)干擾LLO 組裝的方法實(shí)現(xiàn)去糖基化具有可行性。
4 展望
1982 年,生物藥物這一概念被正式提出[1],之后大量生物藥物的出現(xiàn)改變了許多疾病的治療方法。在眾多原核和真核細(xì)胞表達(dá)系統(tǒng)中,由于對(duì)酵母的基因組有深入的了解,酵母中簡(jiǎn)便高效的基因編輯系統(tǒng)的構(gòu)建[8]以及酵母可修飾蛋白質(zhì)等優(yōu)勢(shì)的存在,促使工程化酵母研究進(jìn)程加速前進(jìn)。為了消除酵母對(duì)蛋白獨(dú)特的N-高甘露糖修飾途徑,引入人源化的N-糖基化修飾途徑,已有學(xué)者展開(kāi)了相關(guān)研究。目前,在畢赤酵母中已經(jīng)可以表達(dá)唾液酸化的糖蛋白[48],這一成果使在酵母表達(dá)系統(tǒng)中產(chǎn)生人源化蛋白成為了現(xiàn)實(shí)。但是,在酵母中實(shí)現(xiàn)人源化類型的糖基化修飾仍然面臨著許多問(wèn)題:①酵母中糖蛋白也參與細(xì)胞壁的合成和酵母生長(zhǎng)代謝進(jìn)程,酵母中糖基轉(zhuǎn)移酶的敲除破壞酵母細(xì)胞壁的完整性,影響酵母本身的正常生長(zhǎng)發(fā)育,即難以平衡酵母生長(zhǎng)狀況和人源糖基化修飾之間的關(guān)系;②工程酵母中改變糖鏈結(jié)構(gòu),造成后續(xù)糖基轉(zhuǎn)移酶、翻轉(zhuǎn)酶或糖苷酶等對(duì)底物識(shí)別能力降低,造成目的糖蛋白產(chǎn)生效率低下;③釀酒酵母作為最常用的一種酵母,仍然不能產(chǎn)生含有半乳糖或者唾液酸殘基的糖蛋白,限制了酵母表達(dá)系統(tǒng)的進(jìn)一步發(fā)展。對(duì)酵母糖基化修飾進(jìn)行人源化改造,使其產(chǎn)生更接近哺乳動(dòng)物糖基化修飾結(jié)構(gòu),有望進(jìn)一步提高酵母表達(dá)系統(tǒng)在生產(chǎn)治療蛋白方面的價(jià)值,拓展酵母作為細(xì)胞工廠的應(yīng)用范圍。

