低鹽對棕點石斑魚幼魚滲透壓調節、Na+/K+-ATPase活性及相關基因表達的影響
劉龍龍,羅 鳴,陳傅曉,劉金葉
(1.海南熱帶海洋學院,熱帶海洋生物資源利用與保護教育部重點實驗室,三亞 572022;2.海南省海洋與漁業科學院,海口 571126)
鹽度是影響魚類生長、發育和繁殖的重要環境因子[1]。廣鹽性硬骨魚可以通過有效的滲透壓調節維持體內內環境的穩定,以適應生活環境中鹽度的改變[2]。魚類的滲透壓調節作用是由一系列器官協同完成的,包括鰓、腸和腎[3]。鰓是魚類主要的滲透壓調節器官,位于鰓上皮富含線粒體的泌氯細胞是負責離子吸收和分泌的主要場所[4]。Na+/K+-ATPase是一種跨膜蛋白,是維持Na+和K+梯度的關鍵轉運酶,在離子交換和滲透壓調節中起著至關重要的作用[5]。Na+/K+-ATPase由兩個亞基(α和β)組成,它們非共價配對形成αβ-異源二聚體。在硬骨魚中發現了3種α亞型(α1、α2和α3)和4種β亞型(β1、β2、β3、β4)[6-7],Na+/K+-ATPase活性不僅受物種不同和棲息地環境差異的影響,還受到α、β亞型組成比例轉換調節的影響[8],關于不同的α及β亞型對Na+/K+-ATPase活性的影響在不同硬骨魚研究中存在爭議[3]。
棕點石斑魚(Epinephelus fuscoguttatus)又稱為褐點石斑魚,俗稱老虎斑,隸屬硬骨魚綱(Osteichthyes),鱸形目(Perciformes),鱸亞目(Percoidei),鮨 科(Serranidae),石斑魚亞科(Epinephelinae),石斑魚屬。由于其肉味鮮美、生長快、市場潛力大,養殖前景較好,近年來已經成為福建、廣東、海南等地海水養殖的重要名優品種。棕點石斑魚對鹽度耐受范圍大,在鹽度11‰~41‰水域都能生存,因此在不同鹽度水域都開展了養殖[9]。對棕點石斑魚的現有研究主要集中在生長繁育[10]、飼料營養[11-14]、養殖技術[15-16]、病害防治[17-18]等方面,關于鹽度對棕點石斑魚影響的研究相對較少,主要涉及鹽度的耐受性[9]、在鹽度22‰~28‰范圍內生長情況[19]及在不同鹽度下血清皮質醇水平及存活率[20],關于低鹽環境下棕點石斑魚滲透壓調節機制尚未見報道。本研究通過測定棕點石斑魚在低鹽條件下血清滲透壓及離子水平、鰓Na+/K+-ATPase活性及相關基因表達、鰓組織學、耗氧率的影響,探討其在低鹽環境下的滲透壓調節機制,以期為棕點石斑魚在不同鹽度水體中養殖研究提供參考。
1 材料與方法
1.1 實驗材料
實驗用棕點石斑魚幼魚在海南省海洋與漁業科學院瓊海科研基地孵化并養殖,試驗魚幼魚體質量(56.8±3.5)g。暫養在體積為800 L的玻璃鋼圓筒內,養殖期間水溫(27.5±0.5)℃、養殖水體pH(8.0±0.1)、鹽度(32±1)‰,實驗期間連續充氣,每天投喂人工配合飼料1次,投料1 h后吸凈養殖容器底部殘餌并接近全量換水。
1.2 實驗方法
1.2.1 實驗設計
實驗在瓊海科研基地室內進行,養殖容器與暫養期間一致,不同處理鹽度海水采用過濾后自來水稀釋自然海水配制而成。實驗設置鹽度6‰、12‰、24‰、32‰ 4個梯度,每個梯度設3個重復,每個重復10尾魚,實驗時將棕點石斑魚從自然海水(鹽度32‰)直接轉移到調整好的鹽度為6‰、12‰、24‰、32‰(對照)圓桶中。根據前期研究,與棕點石斑魚幼魚適應養殖環境鹽度變化相關的組織結構、生化和生理反應預計在遷移到新的鹽度條件后的10 d內已經發生[21-22],故實驗共進行10 d。在實驗結束后測定耗氧率。每組隨機抽取3尾魚,用丁香酚麻醉,尾靜脈取血,4℃下靜置分層后,再經冷凍離心機(4℃)6 000 r·min-1離心20 min,取無溶血血清用于測量血清滲透壓及離子濃度;同時取各鹽度組幼魚左側第二鰓弓上的0.1 g鰓絲經生理鹽水潤洗后置于2 mL凍存管經液氮速凍后轉入-80℃冰箱保存,用于測定鰓 Na+/K+-ATPase活性及NKAα1、NKAβ1b、NKAα2a、NKAα3基因的表達。另取鹽度6‰、12‰、32‰組幼魚右側第二鰓弓中間部位腮絲用中性組織固定液(4%多聚甲醛,PB緩沖液)固定,用于鰓絲組織切片觀察;取魚體軀干部肌肉組織,剔除魚骨、魚皮,用紙巾擦凈肌肉上的水和血,用于測量魚體肌肉含水量。
1.2.2 海水和魚血清滲透壓及離子濃度
實驗魚血清和海水滲透壓采用全自動組織滲透壓儀(Osmo210,德國)測定,血清Na+、Cl-、K+離子濃度采用全自動生化分析儀(Chemray 240,中國)測定。
1.2.3 肌肉含水量的測定
肌肉含水量的測定先稱取肌肉組織鮮重,再通過鼓風干燥箱(DHG-9076A,中國)100℃下連續烘烤48 h后稱取肌肉組織干重,計算獲得。
1.2.4 鰓Na+/K+-ATPase活性測定
鰓Na+/K+-ATPase活性采用南京建成生物工程研究所超微量Na+/K+-ATPase試劑盒測定。稱取實驗魚鰓絲樣品0.1 g加入9倍體積生理鹽水,冰浴條件下勻漿,4℃離心(2 500 r·min-1,10 min),取上清液,按照試劑盒說明書方法測定鰓 Na+/K+-ATPase活 性(超微量 Na+/K+-ATPase試劑盒,南京建成)。
1.2.5 總RNA提取及實時熒光定量PCR檢測
用總RNA抽提試劑盒(Invitrogen,美國)根據Trizol法從鰓組織提取總RNA,用紫外分光光度計檢測樣品核酸質量,用1.5%變性瓊脂糖膠測定RNA質量和產率。用無RNA脫氧核糖核酸酶處理RNA(Takara,日本),逆轉錄合成cDNA第一鏈作為基因表達分析模板(Takara,日本)。以β-actin為內參基因進行棕點石斑魚鰓組織NKAα1、NKAβ1b、NKAα2a、NKAα3基因的實時定量RT-PCR測定(ABI StepOne PULS,美國),擴增體系體積為20 μL,其中包含10 μL的SybrGreen qPCR Master Mix、0.8μL引物(10 μmol· L-1)、7.2μL的無核酸酶水和2μL的cDNA模板。實時定量RT-PCR的反應程序如下:95℃3 min,然后95℃5 s,60℃30 s,共45個循環,在最后一個PCR循環結束時制作溶解曲線,確認產物的特異性。棕點石斑魚NKAα1、NKAβ1b、NKAα2a、NKAα3和內參β-actin引物根據轉錄組序列用Primer Premier 5.0設計并驗證(表1)。用5個不同稀釋度(每個稀釋度3個重復)的cDNA樣品繪制標準曲線,并根據E=10(-1/slope)-1分析擴增效率,確保擴增效率在0.9~1.1之間。獲得CT值后代入2-ΔΔCT公式計算基因的相對表達量。

表1 基因NKAα1、NKAβ1b、NKAα2a、NKAα3和內參β-actin基因qPCR引物序列Tab.1 Primers of NKAα1、NKAβ1b、NKAα2a、NKAα3 and internal reference geneβ-actin in quantitative PCR
1.2.6 泌氯細胞數量和長徑
將用中性組織固定液固定的鰓組織樣品進行酒精梯度脫水、石蠟包埋、切片(厚度4μm)、H.E染色、掃描(Pannoramic MIDI掃描儀,匈牙利)。用CaseViewer圖像分析軟件(3DHISTECH Ltd.)分別統計鹽度6‰、12‰、32‰組試驗魚泌氯細胞數量和長徑。泌氯細胞的計數參考UCHIDA[23]及趙峰等[24]方法,隨機選取鰓絲(包含鰓小葉基部)和鰓小葉各6個部位,統計每100 μm鰓絲或鰓小葉上的泌氯細胞個數。
1.2.7 耗氧率的測定
測定前將魚禁食12 h以上確保魚活動減少,實驗設置對照組用于計算不放魚時的耗氧率變化值,將各圓桶水面用透明塑料薄膜覆蓋封閉,分別測定初始和3 h后溶解氧濃度(In-Situ SMARTROLL MP便攜式多參數監測儀,美國),耗氧率的計算公式為:RO=(Oi-Ot-Ob)V/(m·t),式中,RO為耗氧率[mg·g-1·h-1];Oi、Ot分別為初始、t時溶解氧含量(mg·L-1);Ob為空白組溶解氧含量變化值(mg·L-1);V是實驗水體體積(L);m是魚體質量(g);t為測量值之間的時間間隔(h)。
1.3 統計方法
數據以平均值±標準差(means±SD)形式表示。統計前對數據進行正態檢驗和方差同質性檢驗,用SPSS 19.0進行單因素方差分析(oneway ANOVA)和Duncan多重比較進行檢測,顯著性水平為0.05。
2 結果與分析
2.1 不同鹽度下棕點石斑魚血清滲透壓、血清離子濃度及肌肉含水量的比較
經過10 d的低鹽適應,各鹽度組棕點石斑魚血清滲透壓、血清Na+、Cl-、K+濃度及肌肉含水量如圖1所示。隨鹽度的降低,棕點石斑魚血清滲透壓呈降低趨勢,其中鹽度6‰組血清滲透壓顯著低于其他組(P<0.05);血清Na+和K+濃度隨鹽度降低有降低趨勢,其中鹽度6‰組Na+、K+濃度顯著低于對照組(P<0.05);各組間血清Cl-濃度無顯著性差異(P>0.05);肌肉含水量隨鹽度的降低有上升趨勢,但各組間無顯著性差異(P>0.05)。
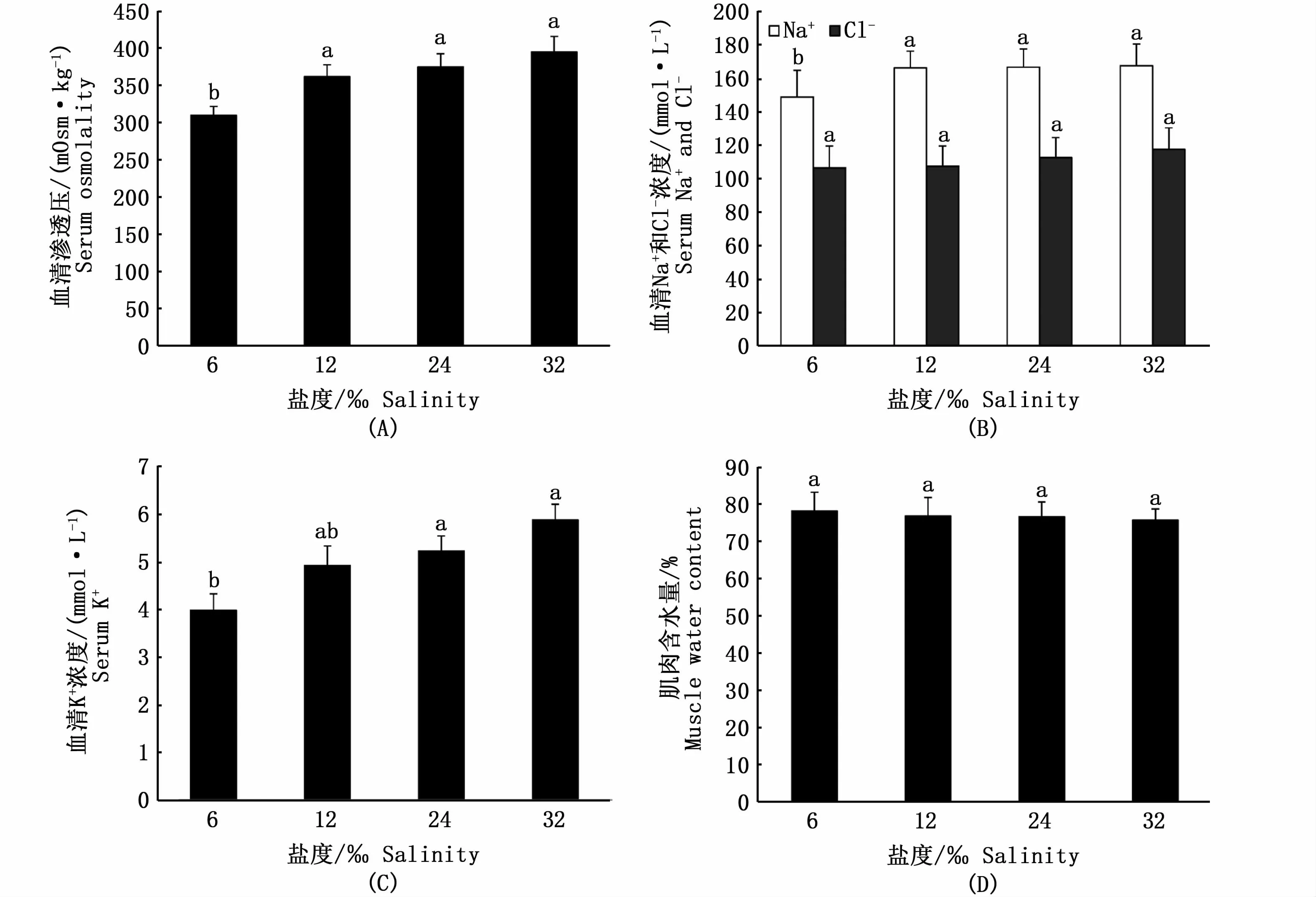
圖1 不同鹽度下棕點石斑魚幼魚血清滲透壓(A)、血清Na+、Cl-濃度(B)、血清K+濃度(C)、肌肉含水量(D)Fig.1 Serum osmolality(A),serum Na+and Cl-(B),serum K+(C),muscle water content(D)of juvenile Epinephelus fuscoguttatus at different salinities
線性回歸分析表明(圖2),血清滲透壓與環境水滲透壓呈線性相關(R2=0.82,P<0.05),回歸直線與等滲線交點為等滲點滲透壓343.73 mOsm·kg-1,所對應海水鹽度為12.59‰。
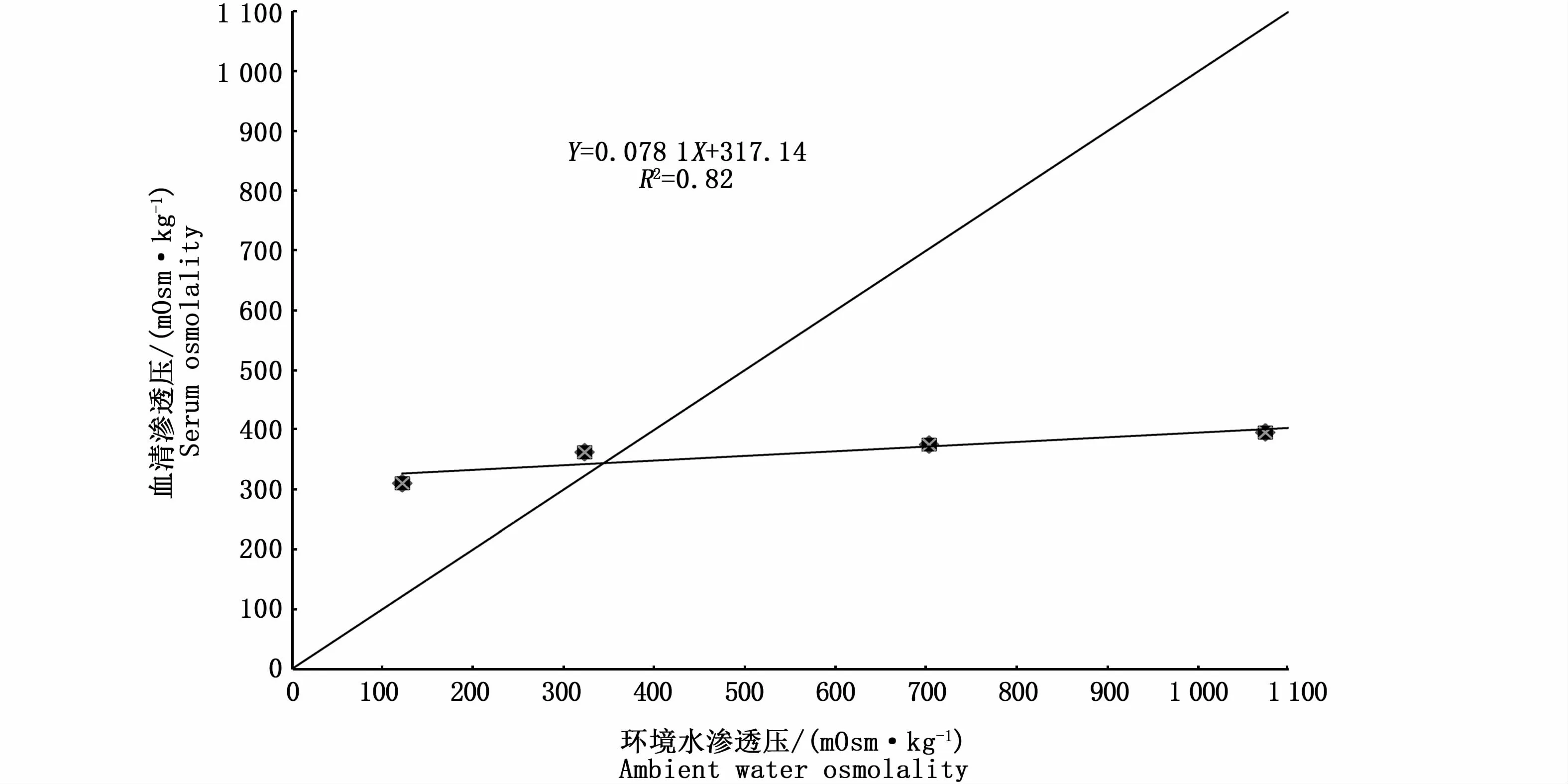
圖2 棕點石斑魚幼魚在不同鹽度下血清滲透壓和環境滲透壓的關系Fig.2 Relationship between ambient water osmolality and serum osmolality of juvenile Epinephelus fuscoguttatus
2.2 不同鹽度下棕點石斑魚的Na+/K+-ATPase活性
經10 d低鹽適應,棕點石斑魚鰓Na+/K+-ATPase活性如圖3所示,隨著鹽度的降低,鰓Na+/K+-ATPase活性先降低后上升,其中鹽度12‰組活性最低,顯著低于其他組(P<0.05)。

圖3 不同鹽度下棕點石斑魚幼魚鰓Na+/K+-ATPase活性Fig.3 Gill Na+/K+-ATPase activity of juvenile Epinephelus fuscoguttatus at different salinities
2.3 不同鹽度下棕點石斑魚的NKA基因表達
鹽度對鰓NKA基因表達影響如圖4所示,經過10 d低鹽的適應,隨鹽度的降低NKAα1基因表達量無顯著變化(P>0.05)。NKAβ1b基因表達量隨鹽度的降低先降低后升高;鹽度12‰組基因表達量最低,顯著低于其他鹽度組(P<0.05);鹽度6‰組顯著低于24‰、32‰組(P<0.05)。NKAα2a基因表達量隨鹽度的降低先升高后降低,鹽度12‰基因表達量最高且顯著高于其他鹽度組(P<0.05);鹽度6‰、24‰與對照組無顯著性差異(P>0.05)。NKAα3基因表達量隨鹽度的降低而降低,其中鹽度6‰組最低且顯著低于其他鹽度組(P<0.05),鹽度32‰組最高且顯著高于其他組(P<0.05)。

圖4 不同鹽度下棕點石斑魚幼魚鰓NKAα1、NKAβ1b、NKAα2a、NKAα3基因表達Fig.4 Expressions of NKAα1,NKAβ1b,NKAα2a,NKAα3 genes in gill of juvenile Epinephelus fuscoguttatus at different salinities
2.4 不同鹽度下棕點石斑魚泌氯細胞數量與長徑
如圖5所示,各鹽度組棕點石斑魚泌氯細胞在鰓絲及鰓小葉均有分布且主要分布在鰓絲及鰓小葉基部。不同鹽度組鰓組織泌氯細胞數量與長徑如圖6所示,隨鹽度的降低,鰓絲泌氯細胞數量先減少后增加,在鹽度12‰時最少,且顯著低于鹽度6‰、32‰組(P<0.05);鰓小葉泌氯細胞數量在鹽度32‰時最多且顯著高于鹽度6‰組、12‰組(P<0.05)。各鹽度組鰓絲、鰓小葉泌氯細胞長徑無顯著差異(P>0.05)。
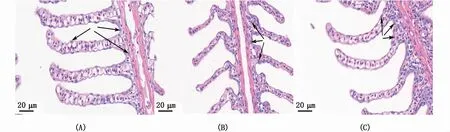
圖5 不同鹽度下棕點石斑魚幼魚鰓泌氯細胞(箭頭)Fig.5 Gill chloride cells(arrows)of juvenile Epinephelus fuscoguttatus at different salinities
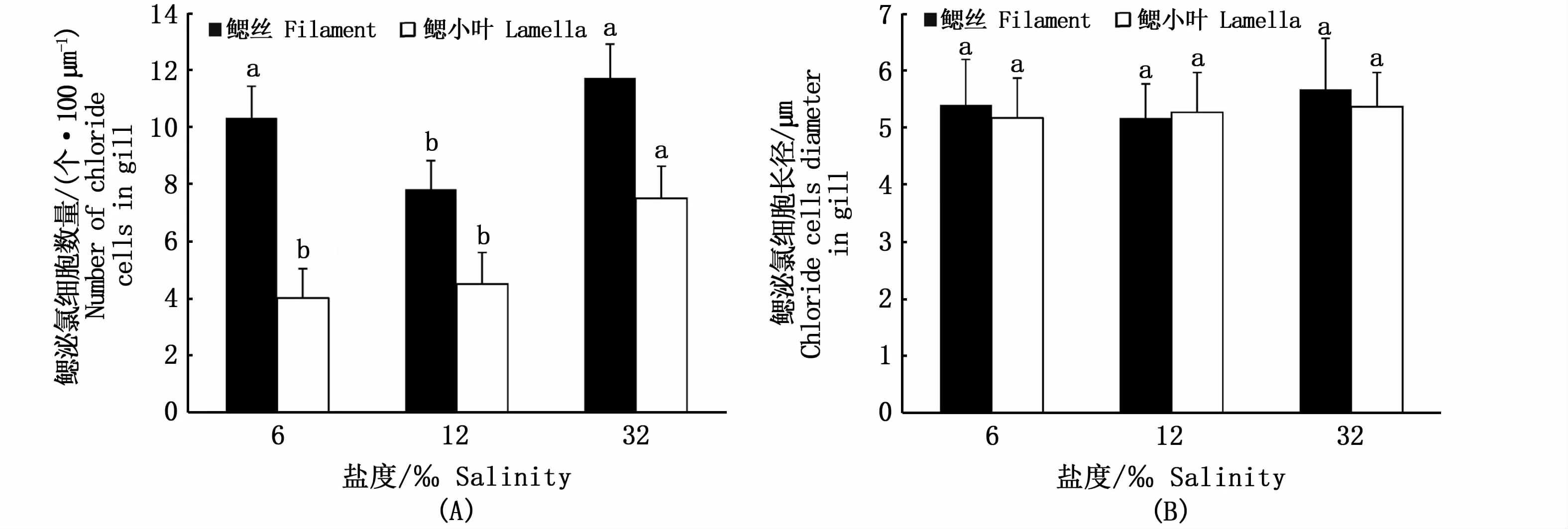
圖6 不同鹽度下棕點石斑魚幼魚鰓絲、鰓小葉泌氯細胞數量及長徑Fig.6 Number and diameter of chloride cells in filaments and lamellae of juvenile Epinephelus fuscoguttatus at different salinities
2.5 不同鹽度下棕點石斑魚的耗氧率
不同鹽度組棕點石斑魚的耗氧率如圖7所示。經過10 d的低鹽馴化,鹽度的降低導致棕點石斑魚耗氧率呈上升趨勢,在鹽度32‰時最低,且顯著低于6‰組、24‰組(P<0.05);鹽度6‰組、12‰組、24‰組之間耗氧率無顯著性差異(P>0.05)。
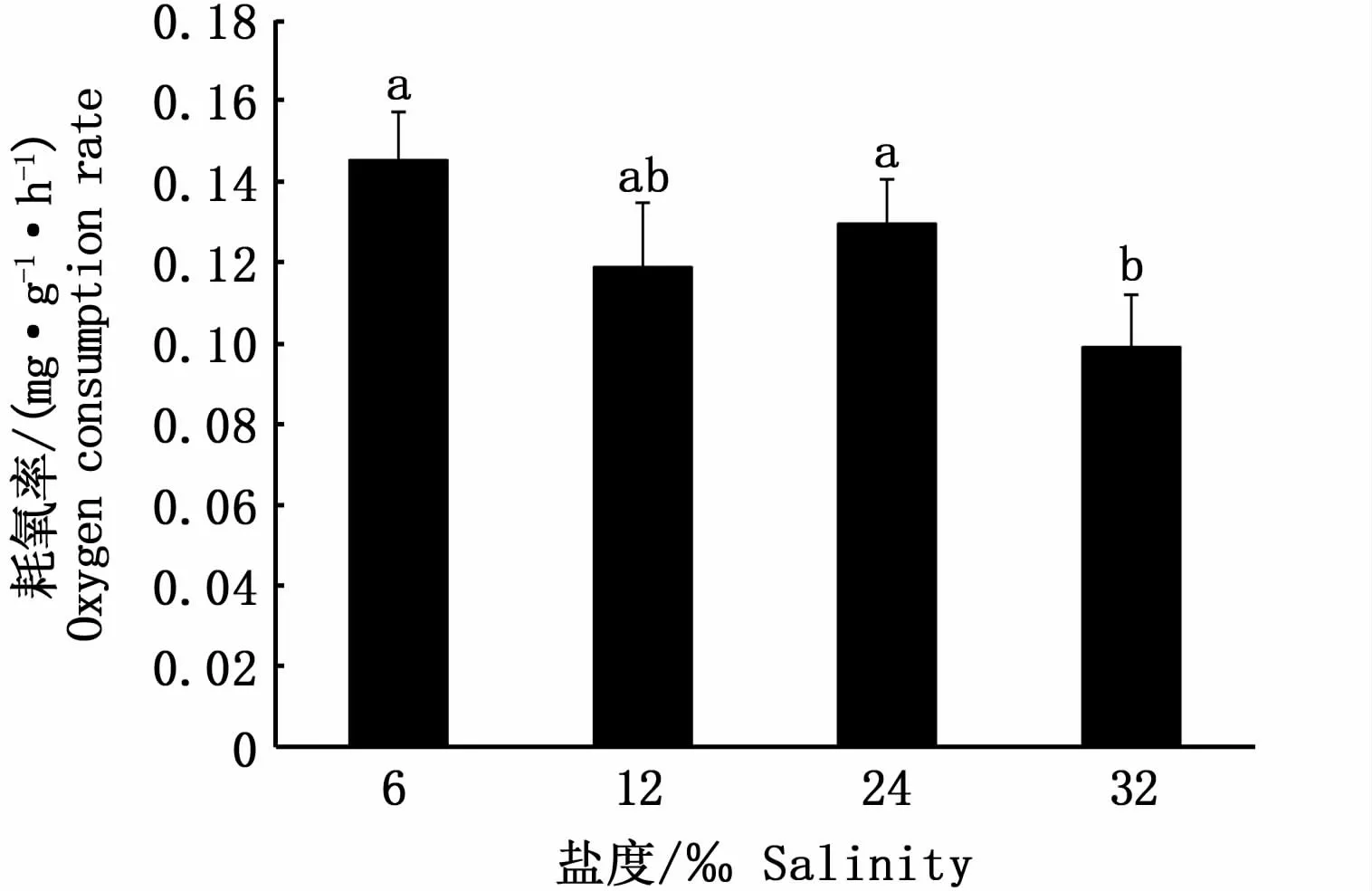
圖7 不同鹽度下棕點石斑魚的耗氧率Fig.7 Oxygen consumption rate of Epinephelus fuscoguttatus at different salinities
3 討論
3.1 鹽度對棕點石斑魚血清滲透壓調節的影響
當機體處于低滲或高滲環境時,血漿內環境與外界水環境之間存在一定的滲透壓差,機體通過調節離子平衡來維持體內滲透壓的穩定[25]。不同廣鹽性硬骨魚的肌肉含水量通常在環境鹽度的耐受范圍內發生較小變化,黑鯛(Mylio macrocephalus)從海水轉移到淡水后肌肉含水量增加[26],青鳉(Oryzias latipes)從淡水轉移到海水后肌肉含水量暫時下降,并在適應7 d后恢復[27]。本研究中棕點石斑魚經過10 d的適應,各鹽度組肌肉含水量并無顯著性差異,這表明在6‰~32‰鹽度條件下棕點石斑魚能夠對體內離子環境進行有效的調控。
血漿Cl-濃度會影響血漿的酸堿平衡,在低鹽水體中,當血漿Na+的降低速度高于血漿Cl-的降低速度時,有可能導致魚類發生短暫的代謝性酸中毒[28],本研究中棕點石斑魚從鹽度32‰自然海水轉移到鹽度32‰、24‰、12‰、6‰環境中適應10 d后,鹽度6‰組魚血清Cl-濃度并沒有隨血清Na+、K+濃度的降低而降低,這預示著在該鹽度下棕點石斑魚可能會發生輕微的代謝性酸中毒。環境鹽度的變化不僅會影響魚類的體內離子平衡,并可能影響魚類的生理狀態,如游泳、食欲等[29],在本研究中鹽度6‰組棕點石斑魚攝食幾乎停止,活動量降低,這表明盡管在10 d時間內棕點石斑魚能應對鹽度6‰的水環境變化,但在該鹽度環境中已經受到了低鹽脅迫影響,可以預測,如果棕點石斑魚長期暴露于鹽度6‰下可能會對血清滲透壓和離子平衡產生更嚴重的影響。
狹鹽性海洋硬骨魚的血漿滲透壓為370~480 mOsm·kg-1,而狹鹽性淡水硬骨魚的血漿滲透壓為260~330 mOsm·kg-1[30],本研究中棕點石斑魚血清滲透壓隨鹽度的降低而降低,其滲透壓變化范圍介于兩類之間,這表明棕點石斑魚具有廣鹽性,經回歸分析估算棕點石斑魚等滲點343.73 mOsm· kg-1,所對應海水鹽度為12.59‰,這與大部分廣鹽性硬骨魚類等滲點相似[21]。
3.2 鹽度對棕點石斑魚鰓Na+/K+-ATPase活性及耗氧率的影響
鰓Na+/K+-ATPase是硬骨魚類適應外界鹽度變化、進行滲透壓調節的關鍵酶,鰓Na+/K+-ATPase活性能反映機體對離子轉運相關的能量需求[31]。不同魚類鰓Na+/K+-ATPase活性與鹽度變化的關系不同,主要有兩種類型:1)一種是溯河性魚類存在的線性關系,即隨鹽度的升高Na+/K+-ATPase活性隨著增加[23];2)多數廣鹽性魚類存在“U”型關系,即鰓Na+/K+-ATPase在中等鹽度下活性較低,在低鹽和高鹽下活性較高。在本研究中,棕點石斑魚經過10 d的適應,隨鹽度的降低,Na+/K+-ATPase酶活性先降低后上升,符合“U”型變化,且在等滲點附近時具有較低的酶活性,這與軍曹魚(Rachycentron canadum)[32]、褐牙鲆(Paralichthys olivaceus)[33]、珍珠龍膽石斑魚(E.lanceolatus×E.fuscoguttatus)[22]等相似,這是由于在等滲點環境細胞外液和環境水之間的離子梯度最小,保持離子平衡所需能量更少。
鰓Na+/K+-ATPase活性受基因表達變化的調控,許多研究表明,環境鹽度變化不僅影響魚鰓Na+/K+-ATPase活性,而且也影響NKA基因表達和蛋白的合成[34]。Na+/K+-ATPase具有復雜的分子異質性,有α和β類多種亞型表達。經10 d的低鹽馴化,4種NKA亞型(α1,β1b,α2a和α3)中有3種亞基對低鹽環境響應存在差異:NKAβ1b基因表達量隨鹽度的降低先降低后升高;NKAα2a基因表達量隨鹽度的降低先升高后降低;NKAα3基因表達量隨鹽度的降低而降低,這表明不同鹽度環境下Na+/K+-ATPase分子結構存在差異,并可能在不同的鹽度環境中發揮特定的作用[7]。有研究認為,NKAα1是影響Na+/K+-ATPase活性關鍵基因,經過一段時間適應后NKAα1基因表達量的變化與Na+/K+-ATPase活性變化一致[35-36]。也有研究表明,NKAβ基因表達量變化與Na+/K+-ATPase活性變化相一致[37]。在本研究中,各鹽度組NKAα1基因表達量無明顯變化,不同鹽度Na+/K+-ATPase活性變化與NKAβ1b基因表達量變化趨勢相似。有研究認為,魚鰓表達多種α和β亞型,多亞型異構體可能會改變以適應鹽度轉移過程中外界水環境離子的變化[7],并且β糖基化位點的突變可以改變酶的活性[38],后續研究將關注此方面的內容。
鰓重構是鰓組織的形態學變化,由細胞活動所致,當硬骨魚面臨外環境鹽度變化時經常發生,其典型特征就是細胞數量或大小發生變化[39-40]。魚類在適應鹽度變化過程中會引起泌氯細胞的改變或重塑,如中華鱘(Acipenser sinensis)幼魚在半咸水條件下與在淡水條件下相比,鰓上皮泌氯細胞數量和大小均顯著增加[24];珍珠龍膽石斑魚隨鹽度的降低,泌氯細胞長徑變小,數量也略有減少[41]。這些改變對魚類適應外界環境鹽度變化有重要意義[42-43],鰓Na+/K+-ATPase活性的變化可能受泌氯細胞數量或大小的變化影響而不僅是基因表達的變化[7]。在本研究中鰓泌氯細胞數量隨鹽度的降低先減少后增加,鰓小葉泌氯細胞在鹽度32‰時最多,而各鹽度組泌氯細胞的長徑并無顯著差異,這表明泌氯細胞的數量可能是影響鰓Na+/K+-ATPase活性變化的重要因素。
耗氧率反映了魚類在靜息狀態所消耗的氧氣,包括用于維持離子和滲透壓調節、蛋白質結構轉換和基本的心肺功能等的消耗量[44]。滲透壓調節是一個耗能的過程,能量動態變化與平衡能準確反映魚類對不同環境條件的適應性[45],大部分魚類總能量預算的20%~50%用于滲透壓調節[46]。許多研究通過不同鹽度下耗氧率來估算離子和滲透壓調節成本[47],但并沒有形成共識。ERN和ESBAUGH[47]對美國紅魚(Sciaenops ocellatus)研究后認為,滲透調節的成本是基礎代謝的次要組成部分,滲透壓調節能量成本不能用全動物耗氧量來檢測。在本研究中,隨鹽度的降低耗氧率有升高趨勢,且在鹽度32‰時最低,而在等滲點附近(鹽度12‰)時耗氧率并沒有明顯降低,這表明在一定鹽度范圍內鰓Na+/K+-ATPase進行滲透壓調節所消耗能量可能只是棕點石斑魚總代謝的一個相對較小的組成部分。MUHAMMADAR等[19]通過研究棕點石斑魚在鹽度22‰、28‰、32‰水體中生長速度,認為棕點石斑魚在鹽度32‰條件生長速度最佳;TAHIR等[20]研究認為,與31‰鹽度相比,棕點石斑魚在5‰~15‰鹽度時血清皮質醇水平及死亡率增加;MORGAN和IWAMA[48]研究認為,魚類對鹽度變化的代謝反應,在很大程度上取決于其生活史階段,即物種在自然棲息地環境代謝率最低,比較適合其生長。該批棕點石斑魚從孵化到養成一直生活在鹽度32‰自然海水中,且在鹽度32‰時耗氧率最低,這可能是長期鹽度適應的結果。
本實驗通過對棕點石斑魚低鹽適應10 d后血清滲透壓、血清Na+、Cl-、K+濃度、鰓Na+/K+-ATPase活性及相關基因表達、鰓組織學及耗氧率等變化綜合分析,在10 d時間內棕點石斑魚能有效應對鹽度6‰的水環境鹽度變化,但已經受到了低鹽脅迫,長期暴露于這種鹽度可能會對血清滲透壓和離子平衡產生更嚴重的影響。鰓Na+/K+-ATPase活性的變化不僅受NKA基因表達量影響,也受到了細胞數量變化的影響。研究同時發現,棕點石斑魚在鹽度12‰時鰓Na+/K+-ATPase活性最低,但代謝率在鹽度32‰即自然棲息地鹽度環境時最低,這表明在一定鹽度范圍內,鰓Na+/K+-ATPase滲透壓調節所消耗能量可能只是棕點石斑魚總代謝的一個相對較小的組成部分。

