地西他濱聯(lián)合CAG方案治療中高危骨髓增生異常綜合征的效果觀察
方 敏
黑龍江省佳木斯市中心醫(yī)院血液內(nèi)科 154002
骨髓增生異常綜合征(MDS)是常見的造血系統(tǒng)腫瘤性疾病,其特點(diǎn)包括髓系細(xì)胞發(fā)育異常、造血功能衰竭、無效造血、難治性血細(xì)胞減少等,30%~40%可轉(zhuǎn)化為急性髓系白血病(AML)[1]。MDS以老年患者居多,當(dāng)前尚缺乏標(biāo)準(zhǔn)治療方案,主要采用異基因造血干細(xì)胞移植(allo-HSCT)、化療以及去甲基化治療等[2]。其中,allo-HSCT是當(dāng)前唯一可根治MDS的手段,但老年人由于生理機(jī)能衰退、免疫力減弱等影響難以承受allo-HSCT。阿糖胞苷(Ara-C,C)+阿克拉霉素(Acla,A)+重組人粒細(xì)胞刺激因子(G-CSF,G)即CAG化療方案是當(dāng)前常用的化療手段,但單一的CAG化療方案預(yù)后并不滿意。地西他濱(DAC)可通過封閉DNA甲基轉(zhuǎn)移酶,阻滯細(xì)胞周期而促進(jìn)腫瘤細(xì)胞凋亡。研究發(fā)現(xiàn),乳酸脫氫酶(LDH)、β2微球蛋白(β2-MG)、鐵蛋白(SF)與MDS的國際預(yù)后評分系統(tǒng)(IPSS)危險分層、死亡風(fēng)險相關(guān),可用于輔助評估治療效果及預(yù)后[3]。本文探討了D-CAG化療方案治療中高危MDS的效果及對患者血清LDH、β2-MG、SF水平的影響,現(xiàn)報道如下。
1 資料與方法
1.1 一般資料 選取2019年4月—2021年4月本院收治的84例中高危MDS患者作為觀察對象。納入標(biāo)準(zhǔn):經(jīng)血常規(guī)、血生化、骨髓細(xì)胞學(xué)、免疫表型、染色體核型等檢查確診,且診斷符合《骨髓增生異常綜合征中國診斷與治療指南(2019年版)》[4]標(biāo)準(zhǔn)。排除標(biāo)準(zhǔn):合并有白血病、再生障礙性貧血等可引起病態(tài)造血或血細(xì)胞減少的原發(fā)疾病者;合并感染與出血者;合并其他造血與免疫系統(tǒng)疾病、重要臟器功能異常及精神病患者。采用隨機(jī)數(shù)字表法將患者分為兩組,各42例。對照組:男27例,女15例;年齡65~84歲,平均年齡(74.01±6.27)歲;IPSS危險分層:中危19例,高危23例。觀察組:男29例,女13例;年齡62~83歲,平均年齡(73.87±6.28)歲;IPSS危險分層:中危18例,高危24例。兩組一般資料比較,差異無統(tǒng)計學(xué)意義(P>0.05),有可比性。
1.2 方法 對照組給予CAG化療方案:Ara-C(哈爾濱萊博通藥業(yè)有限公司,國藥準(zhǔn)字H23021806,50mg)10mg/m2,1次/12h ,第1~14天時皮下注射;Acla(江蘇聯(lián)環(huán)藥業(yè)股份有限公司,國藥準(zhǔn)字H10920075,20mg)20mg/d,第1、3、5天時靜脈滴注;G-CSF(科興生物制藥股份有限公司,國藥準(zhǔn)字S20010016,150μg)300μg/d,第1~7天時皮下注射。觀察組在CAG方案的基礎(chǔ)上于化療第1~5天給予DAC(山東新時代藥業(yè)有限公司,國藥準(zhǔn)字H20173051,10mg)15mg/(m2·d),連續(xù)靜脈滴注3h以上。以28d為1個療程,兩組均治療2個療程。
1.3 觀察指標(biāo) (1)療效評定:完全緩解(CR):骨髓原始細(xì)胞≤5%,且所有細(xì)胞系成熟正常,維持≥4周;骨髓完全緩解(mCR):骨髓原始細(xì)胞≤5%,且減少≥50%;部分緩解(PR):骨髓原始細(xì)胞減少≥50%,但仍>5%,且維持≥4周;血液學(xué)進(jìn)步(HI):血液改善,但未達(dá)PR標(biāo)準(zhǔn);疾病穩(wěn)定(SD):未達(dá)到PR的標(biāo)準(zhǔn)但至少8周以上無疾病進(jìn)展證據(jù);疾病進(jìn)展(PD):轉(zhuǎn)化為AML[4]。總反應(yīng)率(ORR)=(CR+mCR+PR+HI)例數(shù)/總例數(shù)×100%。(2)記錄兩組治療期間不良反應(yīng)發(fā)生率。(3)血清細(xì)胞因子檢測:治療前后,取兩組靜脈血4ml,以3 000r/min 離心10min,離心半徑6cm,取血清,以酶聯(lián)免疫吸附法(ELISA)檢測白細(xì)胞(IL)-4、IL-10、γ干擾素(IFN-γ)水平。(4)血清LDH、β2-MG、SF水平檢測:以“(3)”中方法制備血清,以ELISA檢測LDH、β2-MG、SF水平。

2 結(jié)果
2.1 兩組療效比較 觀察組ORR為83.33%,高于對照組的61.90%(χ2=4.792,P=0.029<0.05),見表1。

表1 兩組療效比較[n(%)]
2.2 兩組不良反應(yīng)比較 兩組不良反應(yīng)總發(fā)生率比較差異無統(tǒng)計學(xué)意義(χ2=0.436,P=0.509>0.05),見表2。

表2 兩組不良反應(yīng)比較[n(%)]
2.3 兩組血清細(xì)胞因子比較 治療后,兩組血清IL-4、IL-10、IFN-γ水平均較治療前降低,且觀察組均低于對照組(P<0.05),見表3。

表3 兩組血清細(xì)胞因子比較
2.4 兩組血清LDH、β2-MG、SF水平比較 治療后,兩組血清LDH、β2-MG、SF水平均較治療前降低,且觀察組均低于對照組(P<0.05),見表4。
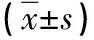
表4 兩組血清LDH、β2-MG、SF水平比較
3 討論
MDS是一種異質(zhì)性髓系克隆性疾病,常以慢性進(jìn)行性貧血癥狀如臉色蒼白、氣短、乏力等為表現(xiàn),隨著疾病進(jìn)展,一旦出現(xiàn)血小板或粒細(xì)胞嚴(yán)重減少,則可導(dǎo)致反復(fù)發(fā)熱、感染、出血等癥狀,并可向AML轉(zhuǎn)化[5]。CAG化療方案為當(dāng)前MDS的常用化療手段,其中Ara-C主要作用于增殖旺盛的細(xì)胞,特別是S期細(xì)胞,可抑制DNA聚合酶的活性,以此阻止DNA合成,并促進(jìn)癌細(xì)胞凋亡;Acla可影響DNA、RNA、蛋白質(zhì)合成,并可在G1晚期、S晚期阻滯細(xì)胞周期而促進(jìn)癌細(xì)胞凋亡;G-CSF可提升化療藥物的抗腫瘤效應(yīng),且可刺激粒、單核巨噬細(xì)胞成熟并向外周血釋放[6]。但單一CAG化療方案的整體預(yù)后仍欠佳。
DAC為天然2’-脫氧胞苷酸的腺苷類似物,可抑制DNA甲基化轉(zhuǎn)移酶,減少DNA的甲基化,抑制腫瘤細(xì)胞增殖;同時,可激活沉默腫瘤抑癌基因,增強(qiáng)分化基因等調(diào)控基因的表達(dá),從而阻止惡性細(xì)胞增生,并促進(jìn)腫瘤細(xì)胞凋亡[7]。本文中,觀察組ORR高于對照組,且兩組不良反應(yīng)總發(fā)生率比較無顯著差異,與單坤生等[8]的文獻(xiàn)報道一致,表明D-CAG化療方案可提升中高危MDS的治療效果,且并未增加不良反應(yīng)。原因是DAC聯(lián)合CAG方案具有協(xié)同增效作用,且DAC可增強(qiáng)CAG方案中Ara-C的細(xì)胞毒作用,進(jìn)一步提升抗腫瘤效應(yīng)[9]。
研究發(fā)現(xiàn),MDS患者的骨髓造血微環(huán)境常呈免疫抑制狀態(tài),造成造血細(xì)胞異常克隆增多,從而加速疾病進(jìn)展[10]。IL-4是Th2細(xì)胞因子,可促進(jìn)腫瘤增殖和存活,同時可誘導(dǎo)T細(xì)胞無反應(yīng)性或其介導(dǎo)的細(xì)胞毒性喪失,以促進(jìn)腫瘤與疾病進(jìn)展。IL-10是調(diào)節(jié)性B細(xì)胞(Breg)因子,屬于抑制性細(xì)胞因子,可產(chǎn)生免疫抑制效應(yīng),有效抑制CD4+T細(xì)胞,從而促進(jìn)腫瘤轉(zhuǎn)移。IFN-γ是由M1型巨噬細(xì)胞分泌的細(xì)胞因子,發(fā)揮促腫瘤作用。本文中,治療后,觀察組血清IL-4、IL-10、IFN-γ均低于對照組,提示D-CAG化療方案可下調(diào)IL-4、IL-10、IFN-γ過表達(dá),糾正免疫紊亂。原因是DAC可促使CD4+T細(xì)胞分化為CD4+調(diào)節(jié)性T細(xì)胞,促進(jìn)穩(wěn)定的調(diào)節(jié)性T細(xì)胞系的形成,從而能夠減輕對細(xì)胞免疫的抑制,糾正免疫紊亂,有效調(diào)控細(xì)胞因子分泌,增強(qiáng)機(jī)體抗腫瘤作用[11]。
LDH是一種糖酵解酶,通常在機(jī)體損傷或者代謝紊亂時分泌,在惡性腫瘤細(xì)胞中呈高表達(dá)。β2-MG是一種球蛋白,通常在惡性腫瘤細(xì)胞或者炎癥應(yīng)激狀態(tài)時異常表達(dá),參與MDS惡性克隆增殖的調(diào)控。SF是一種可溶性鐵蛋白,過高的鐵負(fù)荷會增加毒性活性氧,造成造血干細(xì)胞衰老、死亡。陳春平等[12]的研究證實,LDH、β2-MG、SF在MDS患者血清中呈高表達(dá),且隨IPSS評分等級增加呈上升趨勢,同時,SF水平是影響MDS患者死亡的獨(dú)立危險因素。本文中,治療后觀察組血清IL-4、IL-10、IFN-γ水平均低于對照組,提示D-CAG化療方案可改善MDS患者預(yù)后。
綜上所述,D-CAG化療方案可提升中高危MDS患者的治療效果,改善預(yù)后,其機(jī)制可能與下調(diào)IL-4、IL-10、IFN-γ過表達(dá)有關(guān)。

