例談有關離子反應的新題型
周永波
(安徽省亳州市第二中學)
有關離子反應的試題是以元素化合物知識為載體,考查考生的基礎知識與基本技能,體現了“宏觀辨識與微觀探析”“變化觀念與平衡思想”等化學學科核心素養,因此在歷年各地高考中備受青睞.
1 通過實驗情境分析離子反應的本質
例1(2021 年北京卷)使用如圖1 所示裝置(攪拌裝置略)探究溶液離子濃度變化,燈光變化不可能出現“亮→暗(滅)→亮”現象的是( ).
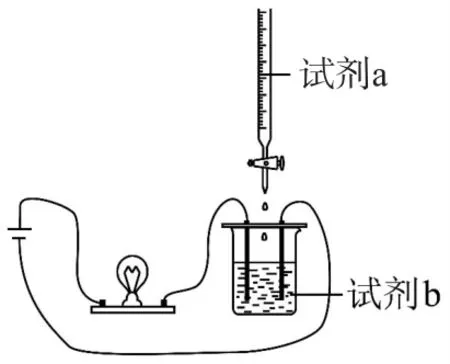
圖1
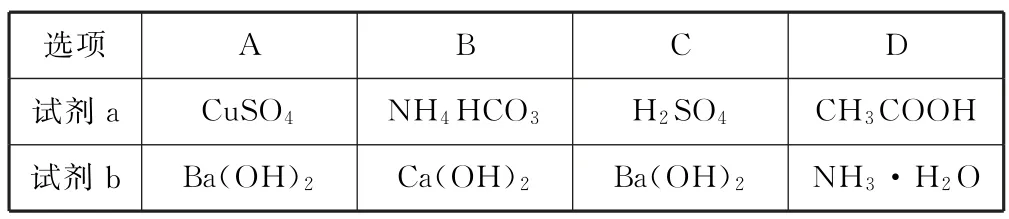
分析Ba(OH)2與CuSO4發生離子反應:Ba2++2OH-+Cu2++=BaSO4↓+Cu(OH)2↓,隨著反應的進行,溶液中自由移動的離子濃度減小,燈泡變暗,當二者恰好反應時,溶液中幾乎不存在自由移動的微粒,燈泡完全熄滅;當CuSO4溶液過量時,其電離產生的Cu2+導電,又使燈泡逐漸變亮,選項A 不符合題意.Ca(OH)2與NH4HCO3發生離子反應:Ca2++2OH-+=CaCO3↓+H2O+NH3·H2O,隨著反應的進行,溶液中離子濃度逐漸減小,燈泡逐漸變暗,當二者恰好反應時,溶液中離子濃度最小,燈泡變暗.當NH4HCO3溶液過量時,其電離產生的導電,使燈泡逐漸又變亮,選項B不符合題意.Ba(OH)2與H2SO4發生離子反應:Ba2++2OH-+2H++=BaSO4↓+2H2O,隨著反應的進行,溶液中離子濃度減小,燈泡變暗,當二者恰好反應時,溶液中離子濃度最小,燈泡變暗,當H2SO4溶液過量時,其電離產生的H+、導電,又使燈泡逐漸變亮,選項C 不符合題意.CH3COOH 與氨水發生離子反應:CH3COOH +NH3·H2O=CH3COO-++H2O,反應后離子濃度增大,溶液導電能力增強,燈泡更明亮,不能出現亮→滅(或暗)→亮的變化,選項D 符合題意.故答案為D.

本題通過真實的實驗情境,考查離子反應的本質.一般復分解反應向著離子濃度減小的方向進行,如生成沉淀、氣體、水等弱電解質等.2021年北京高考這道題對離子反應的考查,充分體現了“宏觀辨識與微觀探析”的化學學科核心素養在學科教學中的落實情況,這也對考生樹立“微粒觀”提出了新的要求.
2 通過模塊融合判斷離子反應的正誤
例2不能正確表示下列變化的離子方程式的是( ).
A.(2021年1月浙江卷)銅片上電鍍銀的總反應(銀作陽極,硝酸銀溶液作電鍍液):

B.(2021年6月浙江卷)鋅溶于氫氧化鈉溶液:
Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑
C.(2019年新課標Ⅱ卷)向Mg(OH)2懸濁液中滴加足量FeCl3溶液出現紅褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.(2020年天津卷)C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O=2C6H5OH+
分析銀作陽極,陽極的電極反應式為Age-=Ag+,銅片作陰極,陰極的電極反應式為Ag++e-=Ag,總反應為Ag(陽極Ag(陰極),選項A正確.鋅與氫氧化鈉溶液反應生成偏鋅酸鈉和氫氣,反應的離子方程式為Zn +2OH-+2H2O =[Zn(OH)4]2-+H2↑,選項B 正確.向Mg(OH)2懸濁液中滴加足量FeCl3溶液,會發生沉淀的轉化,化學方程式為3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2,選項C 正確.C6H5ONa中通入少量或過量CO2都生成C6H5OH 和NaHCO3,C6H5OH 的 酸 性弱于H2CO3強于,正確的離子方程式為C6H5O-+CO2+H2O=C6H5OH+,選項D錯誤.答案為D.

對比近幾年有關離子方程式正誤判斷的高考試題可以發現,離子反應已經不再局限于常見元素及其化合物的性質反應,而是通過不同模塊融合在一起,如涉及?化學反應原理?模塊的電解與電鍍、原電池的電極反應、沉淀的轉化反應、鹽類的水解與弱電解質的電離反應等;涉及?物質結構與性質?模塊的配合物形成的反應、?有機化學基礎?的常見有機物性質的反應等,體現高考化學試題的綜合性與應用性,因此在復習備考中要打破模塊的界限,強化基礎知識與基本技能的培養.
3 通過同一情境判斷離子能否共存
例 3(2016年江蘇卷) 制備(NH4)2Fe(SO4)2·6H2O 的實驗中,需對過濾出產品的母液(pH<1)進行處理.常溫下,分別取母液并向其中加入指定物質,反應后的溶液中主要存在的一組離子正確的是( ).


2016年江蘇卷的離子共存題打破以往離子共存題的形式(給出4 種并列無聯系的選項,然后根據給定條件分別予以常規的判斷),而把問題設置在同一情境之下,問題設置既可圍繞主題并存發散,涉及相關問題的方方面面,也可以層層遞進,將問題的探究逐步引向深入,契合高考化學試題問題情境化的要求,這樣創設主題式化學知識考查的新情境,整體感強烈,體現了命題者的巧妙構思與匠心獨運,這也是未來高考命題的重要特征和發展趨勢,應引起足夠的重視.
4 通過表格對比分析離子能否共存
例4下列離子能大量共存,且加入相應試劑后發生反應的離子方程式書寫正確的是( ).
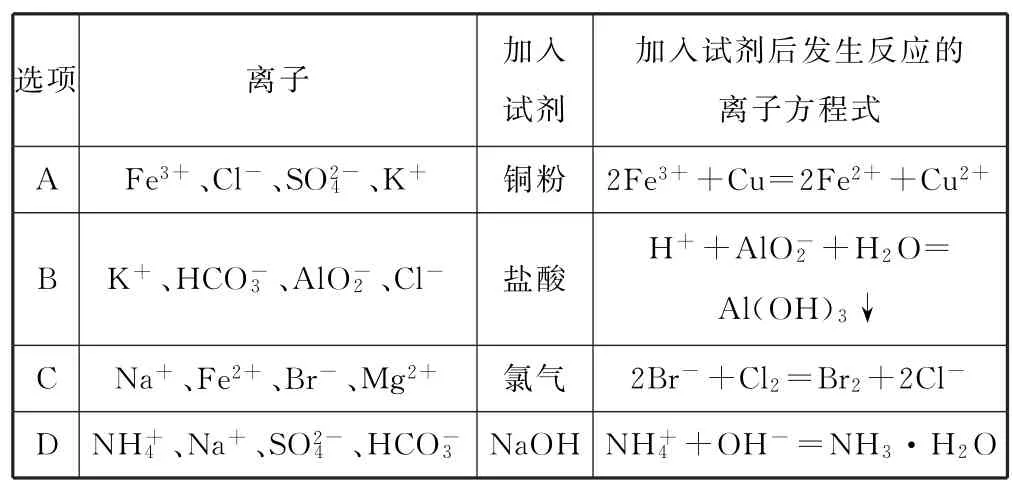


通過圖形、表格等形式將相關的信息對比呈現,在近年來高考化學試題中高頻出現,體現了?中國高考評價體系?的要求,本題將離子能否大量共存通過信息呈現然后進行分析,能有效地考查考生的對比分析判斷的能力,契合了新高考由知識立意向能力立意的要求.
每年的高考化學試題都會在傳承的基礎上進行變化與創新,因此我們在備考時要夯實基礎,抓住知識的本質,厘清知識的脈絡,學會變通,這樣才能以“不變”應“萬變”.
(完)

