LVEF、NT-proBNP聯合cTnI對先天性心臟病患兒術后低心排血量綜合征的預測價值*
莫李媚,趙麗,吳鴻雁,王冰冰,邢存喬
(上海兒童醫學中心三亞市婦女兒童醫院兒童重癥監護室,海南三亞 572000)
先天性心臟病屬于一種常見的先天性畸形,是在胚胎發育時期,由于心臟及大血管形成障礙、或出生后應自動關閉的通道未能閉合而引起的一組心臟局部解剖結構異常的疾病[1-2]。全身麻醉體外循環下先天性心臟病矯正術是治療該病的主要術式,手術成功率高,但由于患兒術前心功能受損,加之體外循環易導致心肌能量供需失衡,造成缺血-再灌注損傷、心排血量急劇降低、心肌鈍抑,從而誘發低心排血量綜合征、急性呼吸窘迫綜合征等并發癥[3-4]。國外研究[5]發現,先天性心臟病患兒心臟直視手術的術后低心排血量綜合征發生率高達25%~60%,其不僅會造成重要組織器官處于低灌注狀態,加重諸多臟器的損傷,且是導致患兒術后死亡的主要原因之一。因此,早期識別、防治是預防術后低心排血量綜合征發生、降低病死率的關鍵。由于超聲心動圖的結果易受患者心率及操作醫師綜合知識水平、技能等因素影響,評估心臟功能存在一定限制[6],故急需一種客觀、快速、操作簡便的評估方法。本研究分析左心室射血分數(left ventricular ejection fraction,LVEF)、N-末端腦鈉肽前體(N-terminal pro-brain natriuretic peptide, NT-proBNP)聯合心肌肌鈣蛋白I(cardiac troponin I, cTnI)對先天性心臟病患兒術后低心排血量綜合征的預測價值,旨在為臨床早期識別高危人群提供依據。
1 資料與方法
1.1 一般資料
選取2019年6月—2021年9月于上海兒童醫學中心三亞市婦女兒童醫院接受體外循環下先天性心臟病矯正術的121 例患兒。其中,男性70 例,女性51 例;年齡1~10 歲,平均(5.26±2.02)歲;體重8~27 kg,平均(18.63±2.42)kg;先天性心臟病類型:室間隔缺損50 例,房間隔缺損30 例,法洛四聯癥10 例,完全肺靜脈異位引流6 例,動脈導管未閉14 例,肺動脈瓣狹窄9 例,右室雙出口1 例,完全性大動脈轉位1 例。納入標準:經心臟超聲證實為先天性心臟病,且符合體外循環下先天性心臟病矯正術適應證;患兒家屬知情同意并自愿簽署知情同意書。排除標準:術中或術后48 h 內死亡;腎功能嚴重不全;嚴重心律失常;甲狀腺疾病;先天性代謝缺陷、多畸形綜合征;有癥狀的原發性肺部疾病,需接受長期皮質激素、茶堿等治療;急診手術;近期接受外科手術或存在外傷;感染性疾病。本研究已獲醫院醫學倫理委員會審核批準。
1.2 方法
1.2.1 低心排血量綜合征診斷標準[7]①收縮壓比術前降低>20%或收縮壓<90 mmHg;②心臟指數<2 L/(min·m2);③尿量<0.5 mL/(kg·h),連續超過2 h;④四肢冰冷,中心溫度與外周溫度相差>5℃;⑤中心靜脈壓>15 cmH2O。符合2 項及以上即為低心排血量綜合征。
1.2.2 分組按術后是否發生低心排血量綜合征分為低心排血量綜合征組和非低心排血量綜合征組。比較兩組的性別、年齡、體重、主動脈阻斷時間、體外循環時間、機械通氣時間、血管活性藥物評分及先天性心臟病類型。其中,血管活性藥物評分=多巴酚丁胺[μg/(kg·min)]+多巴胺[μg/(kg·min)]+100×腎上腺素[μg/(kg·min)]+10×米力農[μg/(kg·min)]+100×去甲腎上腺素[μg/(kg·min)]+10 000×垂體后葉素[u/(kg·min)]。
1.2.3 LVEF選用GE Vivid 7 Dimension 型超聲診斷儀(美國GE 公司),配備3 V 矩陣探頭,探頭頻率為1.5~4.0 MHz。術前,取所有患兒左側位,取心尖四腔心切面,通過改良Simpson 單平面法計算LVEF,取3 個心動周期的平均值。
1.2.4 血漿NT-proBNP、cTnI 水平檢測術前2 h采集所有患兒靜脈血3 mL,3 000 r/min 離心5 min,離心半徑為8 cm,取上清液。采用自動電化學發光免疫分析法測定血漿NT-proBNP、cTnI 水平,試劑盒購自上海羽哚生物科技有限公司。
1.3 統計學方法
數據分析采用SPSS 23.0 統計軟件。計量資料以均數±標準差(±s)表示,比較采用t檢驗;計數資料以構成比或率(%)表示,比較采用χ2檢驗;繪制ROC 曲線;影響因素的分析用多因素Logistic回歸模型。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組一般資料、圍手術期指標比較
121 例體外循環下先天性心臟病矯正術患兒術后發生低心排血量綜合征39 例,發生率為32.23%。兩組患兒的性別、體重、血管活性藥物評分及先天性心臟病類型比較,差異均無統計學意義(P>0.05);兩組患兒的年齡、主動脈阻斷時間、體外循環時間、機械通氣時間比較,差異均有統計學意義(P<0.05),低心排血量綜合征組的年齡小于非低心排血量綜合征組,主動脈阻斷時間、體外循環時間、機械通氣時間長于非低心排血量綜合征組。見表1。
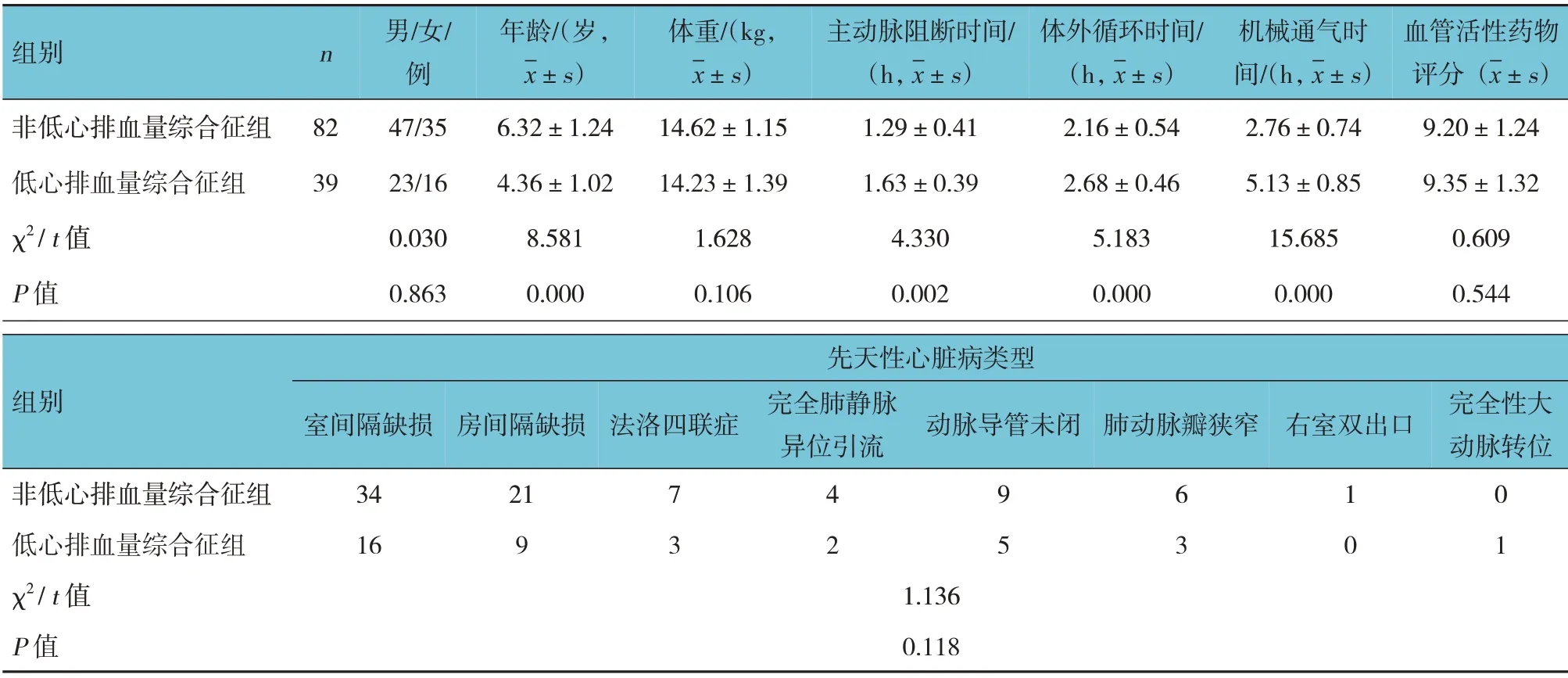
表1 兩組患兒一般資料、圍手術期指標比較
2.2 兩組術前LVEF及血漿NT-proBNP、cTnI比較
兩組術前LVEF 及血漿NT-proBNP、cTnI 比較,差異均有統計學意義(P<0.05),低心排血量綜合征組的LVEF 低于非低心排血量綜合征組,NTproBNP、 cTnI 高于非低心排血量綜合征組。見表2。
表2 兩組患兒術前LVEF及血漿NT-proBNP、cTnI比較 (±s)

表2 兩組患兒術前LVEF及血漿NT-proBNP、cTnI比較 (±s)
組別非低心排血量綜合征組低心排血量綜合征組t 值P 值n 82 39 LVEF/%52.10±4.84 42.54±7.33 7.413 0.000 NT-proBNP/(μg/L)524.82±88.57 731.06±90.62 9.149 0.000 cTnI/(mg/L)12.22±1.84 15.93±3.56 7.567 0.000
2.3 先天性心臟病患兒術后低心排血量綜合征發生的影響因素
將先天性心臟病患兒術后是否發生低心排血量綜合征作為因變量(1 =發生,0 =未發生),將單因素分析中差異有統計學意義的指標作為自變量,采用多因素Logistic 回歸分析,結果:年齡[=0.436(95% CI:0.186,0.769)]、 LVEF[=0.877(95% CI:0.779,0.987)]是先天性心臟病患兒術后低心排血量綜合征發生的保護因素(P<0.05),主動脈阻斷時間[=3.652(95% CI:1.425,7.002)]、體外循環時間[=3.702(95% CI:1.463,8.652)]、機械通氣時間[=2.025(95% CI:1.165,5.385)]、NT-proBNP[=1.005(95% CI:1.003,1.007)]、cTnI[=3.758(95% CI:1.549,9.121)]是先天性心臟病患兒術后低心排血量綜合征發生的危險因素(P<0.05)。見表3。
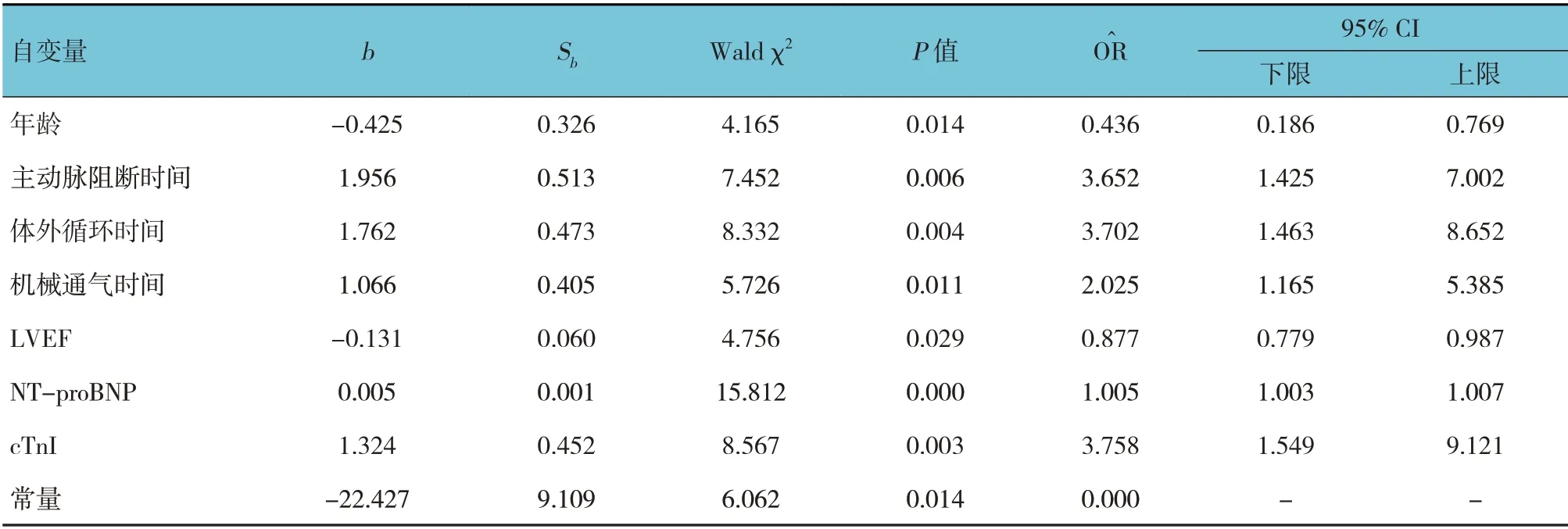
表3 兒童先天性心臟病術后低心排血量綜合征發生影響因素的Logistic回歸分析參數
2.4 LVEF、NT-proBNP、cTnI 及三者聯合對低心排血量綜合征發生的預測效能
將LVEF、NT-proBNP、cTnI 作為狀態變量,低心排血量綜合征發生狀態作為檢驗變量(0 =未發生,1 =發生),繪制ROC 曲線,結果顯示,LVEF、NT-proBNP、cTnI 及三者聯合預測先天性心臟病患兒術后低心排血量綜合征發生的敏感性分別為76.5%(95%CI:0.682,0.875)、81.2%(95%CI:0.751,0.932)、78.6%(95% CI:0.693,0.887)、86.5%(95% CI:0.793,0.932),特異性分別為73.5%(95% CI:0.602,0.835)、79.6%(95% CI:0.693,0.900)、75.5% (95% CI:0.659,0.861)、84.2%(95%CI:0.782,0.935)。見表4和圖1。

圖1 LVEF、NT-proBNP、cTnI及三者聯合預測ROC圖

表4 LVEF、NT-proBNP、cTnI及三者聯合對低心排血量綜合征發生的預測效能分析
3 討論
先天性心臟病矯正術中進行體外循環時,患兒機體處于“控制性休克”狀態,體外循環時間過長可減少全身臟器的有效血流灌注,導致缺血-再灌注損傷、心肌能量供需失衡,增加機體總氧需求量,嚴重影響正常的氧輸送、氧合功能及心排血量[8-9]。同時,手術創傷、心肌缺血再灌注及體外循環等均可能誘發全身炎癥反應,激活內皮細胞,促進一氧化氮、內毒素、補體等因子釋放,造成心肌舒張功能、收縮功能發生障礙,從而增加術后低心排血量綜合征的發生風險[10-11]。
LVEF 是監測低心排血量綜合征較為敏感的參數,也是評估左心功能的可靠指標。DING 等[12]研究發現,術前LVEF 值較低的患者心臟儲備功能相對較弱,在經歷術中心肌缺血后發生低心排血量綜合征等術后并發癥的風險更高。MAGANTI 等[13]研究發現,術前LVEF<40%是影響瓣膜病患者二尖瓣修復或置換術后低心排血量綜合征發生的危險因素。劉海淵等[14]研究報道,LVEF< 45%是冠狀動脈粥樣硬化性心臟病患者體外循環下冠狀動脈旁路移植術后低心排血量綜合征的獨立危險因素。本研究結果發現,低心排血量綜合征組術前LVEF比非低心排血量綜合征組低,且LVEF 是先天性心臟病患兒術后低心排血量綜合征發生的保護因素,證實低LVEF 值可能會增加術后低心排血量綜合征的發生風險。其原因可能在于LVEF 與心肌收縮力呈正相關,心肌收縮力越弱,心臟每搏排出量越小,則LVEF 越低。當患兒LVEF 值降低時意味著心肌收縮功能嚴重受損,心肌纖維化加重,心室重構加快,左心功能減弱甚至失代償,而體外循環后血流動力學恢復,心臟負荷增加,導致心臟每搏排血量急劇降低,影響心肌傳導、收縮力及電活動,故增加圍手術期低心排血量綜合征的發生風險[15]。
腦鈉尿肽分泌增加的主要刺激因素在于心臟前后負荷增加而致的心室壁張力上升,其可通過降低外周小血管阻力、擴血管、抑制腎素-血管緊張素-醛固酮系統等途徑而發揮改善心功能的作用[16-17]。而NT-proBNP 是腦鈉尿肽激素原分裂后的N-端片段,具有更高的血漿穩定性。cTnI 是肌鈣蛋白-肌球蛋白調節復合物中的蛋白之一,與心肌鈣離子共同參與心肌收縮活動,可發揮預防心肌收縮的作用。當心肌細胞出現脂質過氧化、線粒體DNA 獲得性損傷時,心肌細胞內線粒體腫脹變性、肌原纖維溶解及細胞水腫等變化可導致血漿cTnI 升高[18-19]。作為反映心臟功能的生化指標,NT-proBNP、cTnI 在成人心臟衰竭的綜合治療管理、危險分層及診斷中發揮重要作用。GAO 等[20]研究發現,NT-proBNP、cTnI 水平與慢性心力衰竭患者的左心室功能密切相關,且可指導臨床治療方案的調整。BLANCO 等[21]研究證實,NT-proBNP、cTnI 水平與急性心力衰竭患者的預后有關,可有效預測主要心血管不良事件發生。吳海榮等[22]研究報道,NT-proBNP 可用于慢性肺源性心臟病患者右心結構、肺動脈壓力變化的評估中。但關于先天性心臟病患兒NT-proBNP、cTnI 的變化及與心功能相關性的研究較少。本研究中,低心排血量綜合征組NT-proBNP、cTnI 比非低心排血量綜合征組高,NT-proBNP、cTnI 是術后低心排血量綜合征發生的危險因素,可見血漿NT-proBNP、cTnI 水平與先天性心臟病患兒術后低心排血量綜合征的發生密切相關,其發生機制可能在于:①由于先天性心臟病患兒心臟結構生長發育異常,長期存在左向右分流的血流動力學異常,進而增加心臟房室壓力負荷、容量,導致心臟舒張功能及收縮功能降低,誘發低心排血量綜合征。而壓力負壓過大及心肌重構加重,可激活腎素-血管緊張素-醛固酮系統,誘導心室肌細胞分泌BNP,從而導致血漿NTproBNP 水平上升。②當心肌細胞壞死或損傷時,cTnI 可經受損的心肌細胞膜依次進入細胞間質、血管及淋巴管內,且cTnI 水平與心肌細胞缺血缺氧呈正相關。本研究ROC 曲線分析發現,LVEF、NT-proBNP、cTnI 及三者聯合預測先天性心臟病患兒術后低心排血量綜合征發生的AUC 分別為0.798、0.872、0.838、0.903,可見三者聯合可有效預測術后低心排血量綜合征發生,故臨床應密切監測先天性心臟病患兒圍手術期LVEF、NT-proBNP、cTnI變化,以進一步防治低心排血量綜合征。
綜上所述,LVEF、NT-proBNP、cTnI 是先天性心臟病患兒術后低心排血量綜合征發生的獨立預測因子,且三者聯合可有效預測低心排血量綜合征的發生。但本研究樣本來源單一、樣本量相對較小均可能造成結果產生偏倚,未分析其他影響低心排血量綜合征發生的危險因素,只采集術前即刻的數據,未比較圍術期LVEF、NT-proBNP、cTnI 指標的變化,且未明確三者之間相關性及作用機制,故后期將會以上述不足作為重點,進一步開展大樣本量、多中心的研究。

