不同新生兒敗血癥病原菌、耐藥性及影響因素研究
徐俊芳,平莉莉,翟淑芬
(邯鄲市中心醫院新生兒科,河北 邯鄲 056001)
新生兒敗血癥是一種全身感染中毒性疾病,其感染途徑以產前感染、產時感染及產后感染較為常見[1]。盡管近年來,圍產醫學及新生兒危重癥急救技術進一步發展,使早產極低出生體重兒或超低體重兒的成活率大大提高,但因早產兒抵抗力弱和各種侵襲性操作,為新生兒敗血癥的發生提供了有利條件[2]。另外,新生兒敗血癥具有較高的死亡率,若是一味地采用抗生素治療,極易產生耐藥菌株,加重病情惡化。有研究指出,不同地區、不同時期的新生兒敗血癥致病菌分布也會有所不同,但臨床上關于邯鄲地區新生兒敗血癥病原菌分布等文獻資料較少,故本文選取214例患有敗血癥新生兒與538例無敗血癥新生兒的臨床資料進行回顧性分析,旨在分析邯鄲地區新生兒敗血癥的臨床特點、感染現狀、危險因素,對臨床指導用藥有重大意義。
1資料與方法
1.1一般資料
回顧性分析2018年5月至2020年5月于邯鄲市中心醫院診治的214例敗血癥新生兒與538例無敗血癥新生兒的臨床資料。診斷標準:符合《新生兒敗血癥診斷及治療專家共識(2019年版)》中診斷標準[3],經血培養或無菌體腔內培養出致病菌,同時新生兒根據發病時間分為早發型組(出生72h內,n=134)與晚發型組(出生72h后,n=80)。納入標準:①臨床資料完整,均經病原菌、耐藥分析等;②所有研究對象的監護人均知情同意自愿參與研究。排除標準:①心功能不全或合并其他感染性疾病;②合并先天性腸梗阻;③新生兒窒息。752例受檢人員中男性384例,女性368例;年齡1~28d,平均值(14.23±2.32)d;足月兒579例,早產兒173例。
1.2研究方法
1.2.1調查內容及其方法
設計統一的病例調查表,由專業醫師收集752例新生兒的臨床資料,包括性別、有無早產、分娩方式、出生體重、有無新生兒窒息、Apgar評分、有無胎膜早破、有無宮內窘迫、有無臍帶繞頸、有無羊水污染、孕產婦有無發熱、有無臍部感染、有無肺部感染及是否行有創操作等。
1.2.2病原菌培養及藥敏試驗
收集所有研究對象的病原菌培養和藥敏試驗檢查資料。檢查步驟如下:取研究對象股靜脈血作為標本,采用Bact/Alert3D 60全自動培養儀培養標本;采用VITEK 2 Compact 全自動細菌鑒定應用系統對病原菌進行鑒定及耐藥性分析。
1.3觀察指標
觀察早發型與晚發型新生兒敗血癥病原菌分布情況;分析表皮葡萄球菌、大腸埃希菌的耐藥性;分析新生兒并發敗血癥的危險因素。
1.4統計學方法
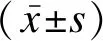
2結果
2.1本研究病原菌分布情況
214例新生兒敗血癥患兒均為單一細菌感染。其中,早發型敗血癥致病菌中革蘭陽性菌與革蘭陰性菌各67株(50.00%),以大腸埃希菌、表皮葡萄球菌、其他凝固酶陰性葡萄球菌(coagulase-negative staphylococcus,GNS)最為常見;晚發型敗血癥致病菌中革蘭陽性菌共68株(85.00%),革蘭陰性菌共12株(15.00%),以表皮葡萄球菌、其他GNS、金黃色葡萄球菌較為多見,見表1。

表1 早發型與晚發型新生兒敗血癥病原菌分布[n(%)]
2.2主要病原菌的耐藥性分析
藥敏結果顯示,表皮葡萄球菌對青霉素的耐藥率最高,其次為氨芐西林;大腸埃希菌對阿莫西林/克拉霉素耐藥性最高,其次為氨芐西林、頭孢唑林,見表2。

表2 表皮葡萄球菌、大腸埃希菌的耐藥性分析[n(%)]
2.3影響新生兒敗血癥的單因素分析
單因素分析結果顯示,晚發型及早發型組出現早產、低出生體重、新生兒窒息、胎膜早破、宮內窘迫、羊水污染、孕產婦發熱、臍部感染、肺部感染、有創操作的占比較高,差異均有統計學意義(χ2值介于77.522~283.621之間,P<0.05);三組在性別、剖宮產、Apgar評分、臍帶繞頸指標比較中差異無統計學意義(P>0.05),見表3。

表3 影響新生兒敗血癥的單因素分析[n(%)]

指標分組晚發型組(n=80)早發型組(n=134)對照組(n=538)χ2P孕產婦發熱有25(31.25)12(8.96)17(3.16)無55(68.75)122(91.04)521(96.84)83.218<0.001臍部感染有18(22.50)43(32.09)4(0.74)無62(77.50)91(67.91)534(99.26)155.257<0.001肺部感染有45(56.25)36(26.87)8(1.49)無35(43.75)98(73.13)530(98.51)235.470<0.001有創操作有8(10.00)35(26.12)17(3.16)無72(90.00)99(73.88)521(96.84)77.522<0.001
2.4影響新生兒敗血癥的多因素Logistic回歸分析
多因素Logistic回歸分析顯示,早發型敗血癥的危險因素為新生兒窒息、宮內窘迫、羊水污染、孕產婦發熱、肺部感染(OR值介于24.753~187.485之間,P<0.05);晚發型敗血癥的危險因素為早產、低出生體重、臍部感染、有創操作(OR值介于7.772~52.949之間,P<0.05),見表4。

表4 新生兒敗血癥早發型與晚發型的多因素Logistic回歸分析
3討論
3.1新生兒敗血癥的一般情況及發病率、病死率分布
新生兒敗血癥為臨床常見病、多發病,也是新生兒期危重急癥。流行病學調查發現,新生兒敗血癥發生率約占活產嬰兒的1.0%~10.0%[4]。又有數據統計,新生兒敗血癥多見于極低出生體重兒,其發病率約占全部新生兒敗血癥的16.4%[5]。有研究表示,長期住院的新生兒患有敗血癥的概率更高,可高達30.0%[6]。根據其發病時間的不同,臨床上將新生兒敗血癥分為早發型與晚發型兩種。其中,前者的發生與產前、產時感染有關;而后者的發生與院內感染或社區獲得性感染有關。早產兒自身抵抗力比足月兒弱,且應用抗生素時間長及各種導管、插管等侵襲性操作,均會在一定程度上增加條件致病菌、厭氧菌和真菌感染,導致醫源性感染敗血癥明顯增多[7]。盡管上述兩種類型的敗血癥病因不同,但均由細菌或真菌感染所致,即病原體進入血液循環后,通過生長繁殖,產生毒素,引起全身感染中毒性疾病,且常合并化膿性腦膜炎及感染性休克等并發癥,故其病死率較高[8-9]。據數據統計,早產兒敗血癥的死亡率高達30%,即使治愈后,仍有部分患兒遺留神經系統后遺癥[10]。基于此,早診斷、早治療對于改善敗血癥預后意義重大。
3.2早發型與晚發型新生兒敗血癥的病原菌、耐藥性分布
近年來,隨著大量抗菌藥物、激素類藥物、免疫抑制劑的使用,耐藥率呈逐年增長趨勢,但不同地區、不同時期致病菌分布也會有所不同,例如表皮葡萄球菌對青霉素耐藥性最強,能引起嚴重醫院內感染事件的發生。因此在為患兒藥物治療前檢測敗血癥菌群分布情況和耐藥情況尤為重要[11-13]。在本研究新生兒敗血癥病原菌分布中,早發型敗血癥致病菌以大腸埃希菌、表皮葡萄球菌、其他GNS最為常見;而晚發型敗血癥致病菌以表皮葡萄球菌、其他GNS、金黃色葡萄球菌多見。基于上述分析,可見條件致病菌為引發新生兒敗血癥的主要致病菌,故本文認為應盡量減少對新生兒行侵入性操作,且嚴格執行消毒、隔離制度,以此減少條件致病菌入侵的概率[14-15]。另外,在藥敏結果分析中,發現表皮葡萄球菌對青霉素的耐藥率最高,其次為氨芐西林;而大腸埃希菌對阿莫西林/克拉霉素耐藥性最高,其次為氨芐西林及頭孢唑林。基于敗血癥致病菌對上述藥物的耐藥性,臨床應加以重視,避免廣譜抗生素長期使用引起耐藥菌株增加的情況。
3.3早發型與晚發型新生兒敗血癥發生的危險因素
有研究指出,早發型敗血癥的發生與宮內窘迫、羊水污染、孕產婦發熱等因素有關[16]。也有研究指出,晚發型敗血癥的發生與早產、低出生體重、有創操作等有關[17]。為了進一步確定其危險因素,本文建立Logistic回歸模型,將早產、剖宮產、低出生體重、新生兒窒息、胎膜早破、宮內窘迫、臍帶繞頸等多項因素納入模型中分析,結果顯示新生兒窒息、宮內窘迫、羊水污染、孕產婦發熱、肺部感染為早發型敗血癥的危險因素;早產、低出生體重、臍部感染、有創操作為晚發型敗血癥的危險因素。分析原因可能為早發型敗血癥的出現通常是由產前、產時感染所致,而晚發型敗血癥的發生通常是由院內感染所致[18]。針對該情況,加強醫務人員手部消毒和重癥監護室、各種導管、器械的清潔十分重要。此外,臨床醫生需根據致病菌培養結果和藥敏結果選擇合適抗菌藥物治療,以此減少產時感染和醫院感染的發生。
綜上所述,新生兒敗血癥應根據發病類型、病原菌和藥敏結果選擇合適的抗菌藥物治療,不僅有利于減少耐藥菌的產生,還能提高治療效果。

