副豬嗜血桿菌血清7型菌株毒力及耐藥性分析
王治方,徐引弟,朱文豪,張青嫻,焦文強,李海利,王克領
(河南省農業科學院畜牧獸醫研究所,鄭州 450002)
副豬嗜血桿菌(Haemophilusparasuis,Hps)是一種革蘭氏陰性、形態多變、NAD依賴型細小桿菌,可長期寄生于豬的上呼吸道中,是當前規模化豬場主要的細菌性病原之一。當機體抵抗力降低時,可感染不同年齡、品種的豬,臨床上斷奶前后和保育仔豬發病率、死亡率較高,主要表現為多發性纖維素性漿膜炎、關節炎等病癥[1]。該病呈世界范圍內流行,每年給養豬行業帶來巨大的經濟損失。
Hps致病機制非常復雜,臨床可單獨感染發病,更多是作為繼發病原與豬繁殖與呼吸綜合征病毒、豬圓環病毒、豬流感病毒等病原引發混合感染,加重病情和危害程度。其臨床血清型較多,已鑒定出15個血清型,還有20%左右的臨床菌株無法分型。Hps不同血清型的毒力及致病性存在較大差異,甚至同一血清型不同菌株的致病力也有一定差異,發病情況也不盡相同[2-3]。菌株毒力與其攜帶的毒力基因有密切關系。有資料表明,Hps血清1、5、10、13、14型為高毒力,2、4、15型為中等毒力,其他血清型劃分為無毒力[4-6]。但最近幾年,本實驗室在臨床典型病例中不斷分離出Hps血清7型菌株,證明Hps血清7型在臨床感染率越來越高。為了解河南地區Hps血清7型流行菌株的相似性、毒力和耐藥性,本研究以Hps血清7型參考菌株為對照,對6株Hps血清7型臨床菌株進行16S rRNA基因擴增、測序分析、毒力基因檢測、致病性試驗和藥敏試驗研究,以期為Hps血清7型的流行病學研究及臨床防控提供參考依據。
1 材料與方法
1.1 材料
1.1.1 菌株 6株Hps血清7型受試菌株由本實驗室臨床分離鑒定并保存,菌株信息見表1。Hps血清7型參考菌株,編號0007,由華中農業大學動物醫學院農業微生物國家重點實驗室惠贈。

表1 菌株信息
1.1.2 主要試劑及儀器 胰蛋白胨大豆瓊脂(TSA)、胰蛋白胨大豆肉湯(碧迪醫療器械(上海)有限公司);犢牛血清、50×TAE 濃縮液瓊脂糖和DNA提取試劑盒(生工生物工程(上海)股份有限公司);煙酰胺腺嘌呤二核苷酸(輔酶Ⅰ,NAD)(Roche公司);PremixTaqTM(TaKaRaTaqTMVersion 2.0 Plus Dye)、DL2000 DNA Marker、DNA提取試劑盒(寶生物工程(大連)有限公司);藥敏片(杭州濱河微生物試劑有限公司)。
Thermo 5020 PCR擴增儀、Thermo 1300SERIES A2生物安全柜(賽默飛世爾科技(中國)有限公司);電泳儀(DYY-6型) (北京市六一儀器廠);凝膠成像系統(沙船(天津)生物科技發展有限公司);5418臺式高速離心機(Eppendorf公司)。
1.1.3 試驗動物 7周齡體重約250 g健康雄性豚鼠40只,購自鄭州大學實驗動物中心。
1.2 方法
1.2.1 菌株DNA提取 將參考菌株和6株臨床菌株分別接種于TSA平板(含5%的犢牛血清,0.001% NAD)上,于37 ℃、5% CO2培養箱培養36 h,挑取典型菌落,按照DNA提取試劑盒說明書分別提取菌株的DNA,分裝備用。
1.2.2 菌株鑒定及序列分析 參照文獻[7-10]設計合成Hps 16S rRNA基因特異性引物和Hps血清7型引物,引物信息見表2。引物均由北京擎科生物科技有限公司合成。以提取的菌株DNA為模板,對受試菌株進行PCR擴增鑒定。PCR反應體系25 μL:2×PremixTaqTM13 μL,模板DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 8 μL。PCR反應條件:95 ℃預變性3 min;95 ℃變性1 min,退火(退火溫度見表2)1 min,72 ℃延伸30 s,共40個循環;72 ℃延伸10 min。反應完成后,取10 μL PCR擴增產物進行1.0%瓊脂糖凝膠電泳檢測,紫外成像系統觀察結果、拍照。

表2 Hps 16S rRNA及血清7型引物信息
將菌株16S rRNA基因PCR擴增產物送北京擎科生物科技有限公司測序,利用DNAStar、Mega 6.0軟件將菌株16S rRNA基因測序結果與GenBank數據庫中獲取的相近的參考菌株基因序列進行比對分析,構建系統進化樹。參考菌株信息見表3。
表3 參考菌株信息

續表
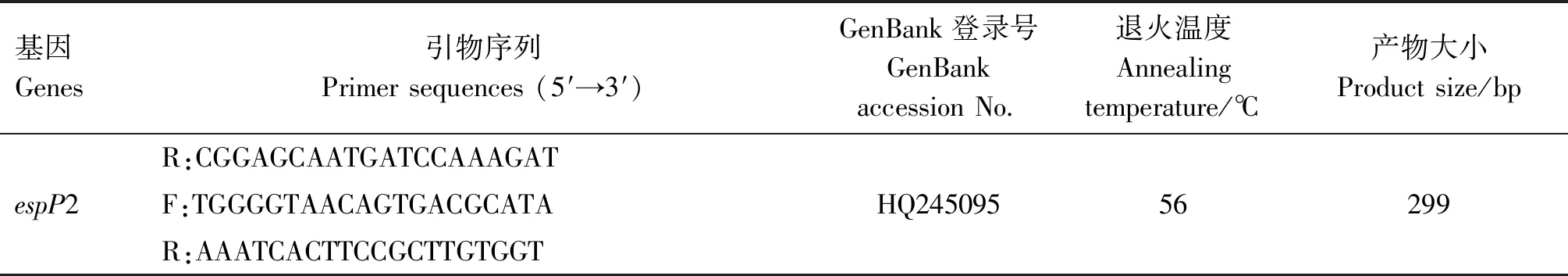
1.2.3 毒力基因檢測 參照文獻[11-13]合成副豬嗜血桿菌相關毒力基因的引物,引物信息見表4。以提取的菌株DNA為模板,進行菌株毒力基因PCR擴增檢測,鑒定菌株攜帶毒力基因情況。PCR反應體系25 μL:2×PremixTaq13 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 2 μL,ddH2O 8 μL。PCR反應條件:95 ℃預變性5 min;95 ℃變性1 min,退火(退火溫度見表4)1 min,72 ℃延伸30 s,共35個循環;72 ℃延伸5 min。反應完成后,取10 μL PCR擴增產物進行1.0%瓊脂糖凝膠電泳檢測,紫外成像系統觀察結果、拍照。

表4 毒力基因引物信息
續表
1.2.4 致病性試驗 將40只試驗豚鼠隨機分為試驗組和對照組,試驗組7組,對照組1組,每組5只。挑選純化好的單個菌落接種于TSB(含5%的新生牛血清和0.001% NAD)液體培養基中,37 ℃振蕩培養24 h,計數備用。調整菌液濃度至2.0×109CFU/mL,試驗組豚鼠腹腔注射調整好的菌液0.5 mL/只;對照組豚鼠腹腔注射生理鹽水0.5 mL/只。接種后仔細觀察記錄每組發病情況,連續觀察10 d,對發病豚鼠進行細菌分離鑒定。
1.2.5 藥敏試驗 采用紙片擴散法對受試菌株和參考菌株進行藥敏試驗。將參考菌株和6株臨床菌株分別接種于TSA平板(含5%的犢牛血清,0.001% NAD)上,于37 ℃、5% CO2培養箱培養24 h,分別挑取各菌株的典型菌落,用滅菌PBS液制成濃度為0.5麥氏單位的菌懸液,用滅菌棉簽蘸取細菌懸液,均勻涂滿TSA平板(含5%的新生牛血清,0.001% NAD)表面;用滅菌鑷子夾取藥敏紙片均勻貼于TSA平板上,置于5% CO2培養箱37 ℃培養36 h,測量抑菌圈直徑大小,參照藥敏片說明書進行結果判定,包括敏感、中介和耐藥。
2 結 果
2.1 菌株鑒定和分型鑒定
PCR擴增結果顯示,參考菌株和6株臨床菌株均擴增出1 090和490 bp 2條條帶,大小和Hps、Hps血清7型目的條帶一致(圖1),表明6株菌株均為Hps,血清型為7型。
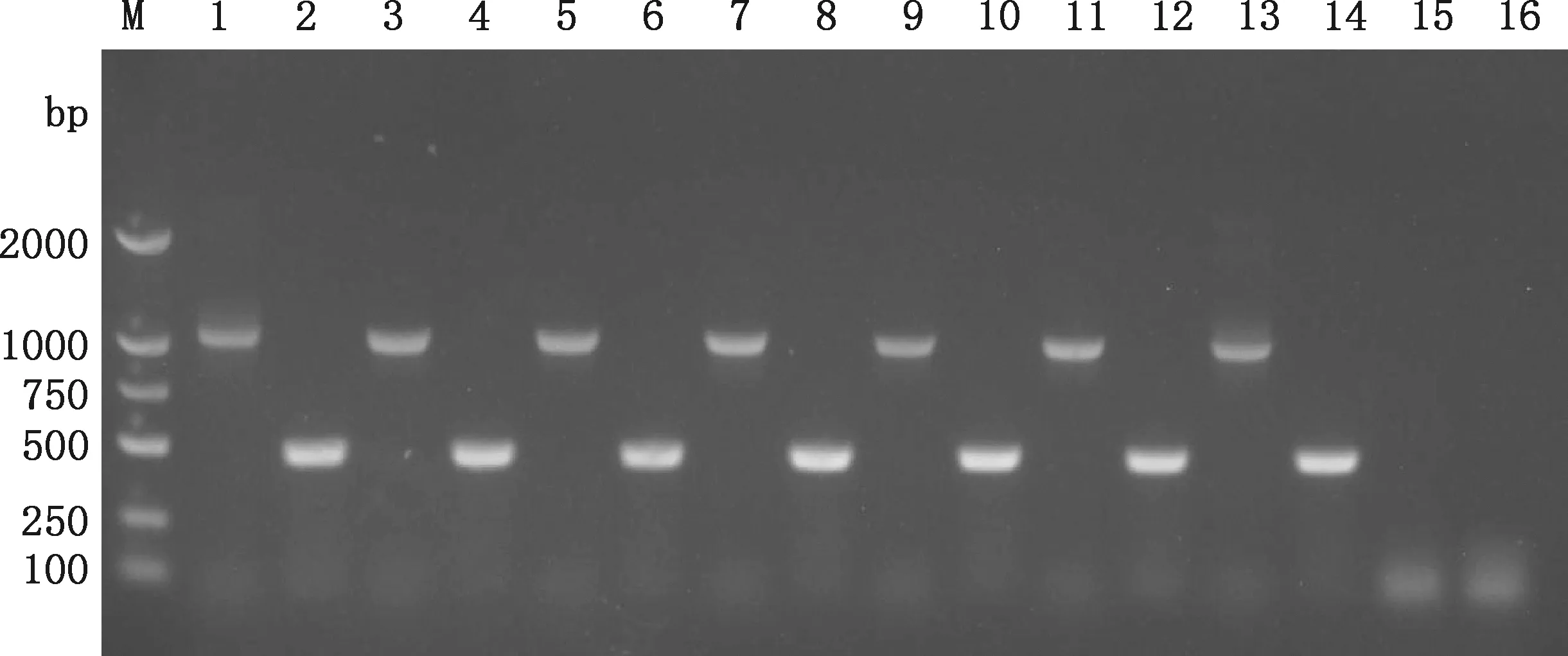
M,DL2000 DNA Marker;1、2,菌株0007;3、4,菌株1436;5、6,菌株1437;7、8,菌株1532;9、10,菌株1565;11、12,菌株1624;13、14,菌株1678;15、16,陰性對照M,DL2000 DNA Marker;1 and 2,Strain 0007;3 and 4,Strain 1436;5 and 6,Strain 1437;7 and 8,Strain 1532;9 and 10,Strain 1565;11 and 12,Strain 1624;13 and 14,Strain 1678;15 and 16,Negative control圖1 菌株血清型PCR鑒定Fig.1 Identification of serotype of strains by PCR
利用Mega 6.0軟件,將受試菌株16S rRNA基因測序結果與GenBank數據庫中獲取的相近的基因序列進行比對分析,結果見圖2。由圖2可知,受試菌株與參考菌株0007核苷酸相似性在98.6%以上,與其他參考菌株核苷酸相似性在97.7%以上。菌株1436 與參考菌株0007核苷酸相似性最高,達100%;菌株1624與菌株1678核苷酸相似性最低,為97.7%。

圖2 菌株16S rRNA基因核苷酸序列相似性分析Fig.2 Similarity analysis of the 16S rRNA gene nucleotide sequence of strains
由16S rRNA基因序列的系統發育樹可知,菌株1624與其他菌株親緣關系較遠,單獨構成一個分支;菌株1436、1437、1532、1565、1678和參考菌株0007及參考菌株在同一個大分支中,菌株1436與參考菌株0007親緣關系最近;菌株1437、1532與參考菌株0007在一個小分支中,親緣關系較近;菌株1565和1678親緣關系較近,這2菌株分別與西班牙的CD7-3、CD8-1株親緣關系近(圖3)。說明,同一血清型不同菌株親緣關系存在一定差異性。

圖3 基于16S rRNA基因序列的系統發育樹Fig.3 Phylogenetic tree based on 16S rRNA gene sequence
2.2 毒力基因測定結果
通過毒力基因PCR擴增,臨床菌株和參考菌株檢測出了vta1、vta2、vta3、wza、nanH、ompP2、cdtA、cdtB、cdtC和espP2毒力基因(圖4),其中臨床菌株1565和參考菌株0007毒力基因型一致,為vta1+vta2+vta3+wza+nanH+cdtA+cdtB+cdtC+espP2+;另外5株臨床菌株毒力基因型一致,為vta1+vta2+vta3+wza+ompP2+nanH+cdtA+cdtB+cdtC+espP2+(表5)。

M,DL2000 DNA Marker;1~13,capd、vta1、vta2、vta3、wza、hhdA、hhdB、ompP2、nanH、cdtA、cdtB、cdtC和espP2基因M,DL2000 DNA Marker;1-13, capd,vta1,vta2,vta3,wza,hhdA,hhdB,ompP2,nanH,cdtA,cdtB,cdtC and espP2 genes,respectively圖4 毒力基因PCR檢測結果Fig.4 PCR results of virulence genes

表5 毒力基因檢測結果
2.3 致病性試驗結果
由表6可知,接種后,參考菌株0007組5只豚鼠均未表現任何臨床癥狀,生長狀態良好;1436株、1437株、1532株、1678株組均有1只出現被毛粗亂、反應遲鈍、蜷縮發抖等癥狀,未發生死亡。1565株、1624株組有2只出現癥狀,未發生死亡;生理鹽水對照組未出現任何癥狀;至試驗結束后對發病豚鼠剖檢,可見腹腔內有腹水、纖維素性滲出,程度不一。用心臟血液、肝臟觸片,革蘭氏染色鏡檢,均發現革蘭氏陰性、長短不一的細絲狀菌體。無菌采集試驗組發病豚鼠的心臟血液、肝臟接種TSA平板(含5%的新生牛血清,0.001%的NAD),37 ℃培養30 h后,分離獲得和接種菌株相一致的單一細菌。

表6 致病性試驗結果
2.4 藥敏試驗結果
選用18種常用抗菌藥對參考菌株和受試菌株進行藥敏試驗,結果見表7。參考菌株和臨床菌株表現出不同的耐藥譜,均表現出多重耐藥。所有菌株對頭孢他啶和頭孢噻呋敏感性好,只有1株臨床菌株對頭孢噻呋表現為中介;對強力霉素、氟苯尼考、氧氟沙星、恩諾沙星敏感性較好,分別有1~3株表現為中介或耐藥;對青霉素、氨芐西林、阿莫西林、卡那霉素、紅霉素、土霉素、四環素、環丙沙星、諾氟沙星敏感性差,均有3株以上菌株表現為中介或耐藥;對新霉素、阿米卡星、替米考星敏感性最差,無菌株表現為敏感。

表7 藥敏試驗結果
3 討 論
副豬嗜血桿菌病是養豬行業的重要細菌性病原之一,可單一病原感染發病,更多是作為繼發病原感染豬群,引起混合感染,給養豬行業造成巨大經濟損失[14]。Hps臨床血清型較多,不同血清型菌株的毒力及致病性不同,臨床感染發病情況也不盡相同。河南地區主要流行菌株為4、5、13和7型[15],4、5和13型相關報道也較多,而先前普遍認為血清7型菌株為無毒力菌株,相關報道較少。近年來,Hps血清7型在臨床病例中分離率明顯增多,可能與Hps血清7型菌株在臨床自然進化過程中菌株毒力增強有關。本試驗以Hps血清7型參考菌株為對照,對河南地區6株Hps血清7型臨床菌株進行分型鑒定、相似性分析、毒力基因、藥敏試驗及豚鼠致病性研究,與參考菌株相比,臨床菌株在毒力基因、耐藥表型方面均表型出一定的差異。分析可能是臨床菌株受自然環境和宿主體內某些變化影響,導致菌株在宿主體內感染過程中個別毒力基因表達出現上調或下調;同時由于國內抗生素使用不規范,同一血清型不同菌株在不同豬場受到抗生素選擇壓力差異較大,導致同一血清的不同菌株臨床耐藥表型出現一定的差異。
通過16S rRNA基因序列相似性比對及發育樹構建發現,6株Hps血清7型菌株與參考菌株相似性及親緣關系表現出有一定的差異性,其中菌株1436與參考菌株相似性達100%,親緣關系最近;菌株1624與參考菌株的相似性為98.6%,親緣關系相對較遠。這充分說明同一血清型同一地域分離的菌株也存在一定的差異性。
Hps的致病過程包括感染黏附、侵入宿主、逃避宿主的防御機制、在宿主體內繁殖并對組織產生損傷。該過程是菌體攜帶所有毒力基因協同參與的復雜過程,每個或每類毒力基因功能作用尚未研究清楚。本試驗篩選檢測的13個毒力基因是Hps的部分致病關鍵因子。capd基因編碼一種多糖合成蛋白,與菌體莢膜的生物學功能有關。vta1、vta2、vta3屬于三聚體自轉運蛋白,與病原體逃避宿主免疫系統監視密切關系[16-18]。wza是與Hps莢膜多糖輸出蛋白相關的基因,在菌株莢膜多糖轉運過程中起重要作用,與菌體黏附和抗吞噬方面有重要關聯。神經轉氨酶nanH基因與細菌的氧化耐受能力有關,在細菌感染宿主過程重要作用。hhdA、hhdB基因是溶血素修飾蛋白基因,主要參與溶血素的分泌與修飾[16-17]。cdtA、cdtB、cdtC是細胞膨脹毒素,誘導細胞膨脹、細胞核擴大并最終凋亡,是Hps菌株直接發揮細胞毒性的重要武器。ompP2是一種孔蛋白,在Hps外膜中含量最多,與細菌抗吞噬、抗補體介導的血清殺菌作用有關。胞外絲氨酸蛋白酶espP2基因屬于自轉運蛋白基因,與細菌的黏附、入侵和細胞毒性有關,可介導生物被膜形成和血清抗性的產生等[18]。6株Hps血清7型共檢測出2種毒力基因型,其中1株臨床菌株與參考菌株相同,為vta1+vta2+vta3+wza+nanH+cdtA+cdtB+cdtC+espP2+;另外5株臨床菌株毒力基因型相同,為vta1+vta2+vta3+wza+ompP2+nanH+cdtA+cdtB+cdtC+espP2+。該結果與張青嫻等[19]報道有一定差異。臨床菌株ompP2基因表達出現明顯上調,該基因主要與細菌抗吞噬、抗補體介導的血清殺菌有關,這可能與近年來Hps血清7型臨床分離率增多有一定關聯。6株臨床菌株均分離于典型病例,說明菌株具有一定的致病性;豚鼠致病性試驗也表明,6株臨床菌株均可感染豚鼠發病,發病率為20%~40%,但死亡率為0。與張青嫻等[20]報道Hps血清5型攜帶14個毒力基因,感染豚鼠發病率80%,死亡率40%比較,Hps血清7型對豚鼠有一定的致病性,但毒力明顯較弱,與陶偉杰等[21]試驗結果基本一致。毒力基因檢測結合致病性試驗,攜帶10種毒力基因的菌株與攜帶9種毒力基因的菌株相比,在致病性上沒有明顯差異,說明Hps的致病性不是毒力基因簡單的累加,而是多個毒力基因協同參與復雜的動態結果,除本次檢測的毒力基因外,可能還有其他毒力基因參與,同時細菌毒力基因在感染過程中啟動表達會有一定差異,致病表型也會出現差異。毒力表型與毒力基因型有一定的相關性,但不完全一致,致病機制十分復雜,需更多試驗進行深入研究。
抗生素仍是當前防控副豬嗜血桿菌病的有效途徑,但由于養殖過程中抗生素長期濫用或不規范使用,導致細菌耐藥性越來越嚴重,使得藥物抗菌效果越來越差。從藥敏試驗結果可看出,菌株1678與參考菌株0007耐藥譜相近外,其他菌株耐藥譜均有一定差異。總體來說,參考菌株和臨床菌株均對頭孢他啶和頭孢噻呋敏感性好,這與史開志等[22]報道結果較一致;而對青霉素、氨芐西林等β-內酰胺類藥物敏感性差,這與陶偉杰等[21]和田昊倫等[23]結果一致,而與Miani等[24]、鄧同煒等[25]報道結果不同;對氟苯尼考敏感性較好,這與田昊倫等[23]、Zhao等[26]結果一致。受試菌株對氨基糖苷類、大環內酯類敏感性最差。此外,參考菌株和臨床菌株均表現出耐3種以上藥物的多重耐藥現象。因此,生產實踐中對臨床分離菌株進行及時、準確的耐藥性檢測,篩選敏感藥物,對防治該病具有重要意義。
4 結 論
Hps血清7型臨床菌株和參考菌株表現出2種毒力基因型,臨床菌株較參考菌株毒力有一定的增強,可引起20%~40%豚鼠感染發病,表現一定的臨床癥狀,但不能致死豚鼠。臨床菌株和參考菌株均對頭孢他啶和頭孢噻呋敏感性好;對強力霉素、氟苯尼考敏感性較好;但對新霉素、阿米卡星、卡那霉素、紅霉素、替米考星耐藥性較強,且均表現明顯的多重耐藥現象。該研究為Hps血清7型流行病學、致病機制研究奠定了基礎,為Hps血清7型的臨床防控提供了參考依據。

