脛骨骨膜牽張術治療糖尿病足的短期療效分析
陳健,劉康,張錫平,王鏢,楊新佑,邱爾鉞
(中南大學湘雅醫學院附屬株洲醫院創傷骨科,湖南 株洲 412007)
糖尿病足(diabetic foot ulcers,DFUs)潰瘍是導致下肢截肢的主要原因,也是糖尿病最重要和最嚴重的并發癥之一[1-2]。其發展是由周圍血管疾病、周圍神經病變、輕微腳部創傷、腳部畸形和感染引起的缺氧共同造成[3-4]。相關文獻統計,DFUs患病率為4%~10%,終身發病率高達25%[5]。糖尿病足的治療方法包括血管再通技術、慢性創面皮瓣修復、干細胞移植治療、細胞因子應用等,但總體來說效果欠佳,潰瘍復發率較高[6-7]。近年隨著Ilizarov技術的引進與發展,以Ilizarov原理為基礎的脛骨橫向骨搬移技術廣泛應用于下肢缺血性疾病的治療,在重建下肢血運、促進創面愈合方面療效顯著。但該技術存在創傷大、有骨折風險、費用昂貴、患者痛苦等弊端。而脛骨膜牽張術具有操作簡單、費用低、患者舒適等特點,但其臨床效果有待驗證。本研究分析2020年1月2021年1月中南大學湘雅醫學院附屬株洲醫院采取脛骨骨膜牽張術進行保肢治療的19例Wagner 2~4級的糖尿病足患者,探討其臨床療效,現報告如下。
1 資料與方法
1.1 一般資料 納入標準:(1)所有患者均符合糖尿病的診斷標準;(2)患糖尿病足病,且Wagner評分2級(較深的,穿透性潰瘍,合并軟組織感染,但無骨髓炎或深部膿腫)及以上;(3)術前CT血管造影術(computed tomography angiography,CTA)、血管超聲提示膝下動脈狹窄或閉塞,遠端至少有單只小腿自體血管通暢(脛前動脈、脛后動脈、腓動脈之一);(4)流入道無≥50%的扭曲或閉塞(股動脈、髂動脈之一);(5)年齡在50~80周歲之間。排除標準:(1)合并血栓閉塞性脈管炎(常有吸煙史,30%~50%患者反復發作游走性血栓性淺靜脈炎)所致的足部潰瘍患者;(2)心腦血管意外急性期;(3)全身條件不佳無法耐受手術者;(4)有精神疾病、無自制力以及無手術意愿的患者。
本研究納入19例患者,其中男13例,女6例;年齡50~80歲,平均(58.84±5.80)歲;糖尿病病程(9.63±2.31)年,糖尿病足潰瘍病程(9.47±3.29)周。無全身并發癥2例,兩種以上并發癥12例;其中最常見并發癥為高血壓12例,尿毒癥2例,冠心病5例,視網膜病變5例,血脂異常7例。
1.2 手術方式
1.2.1 術前處理 (1)內分泌會診指導降血糖治療,將患者血糖控制在餐前小于7.8 mmol/L、餐后小于10.0 mmol/L;糾正低蛋白血癥及貧血;(2)術前常規完善患足X線片、下肢CTA、下肢血管多普勒超聲、踝肱指數等檢查;取傷口壞死組織,完善細菌培養及藥敏;(3)術前視傷口情況對傷口清洗換藥處理,必要時局部清創引流。
1.2.2 手術過程 常規硬膜外麻醉,術者在患肢脛骨中上段內側作長15~20 mm縱向切口,切開皮膚及皮下組織,鈍性分離皮下組織,充分暴露骨膜(見圖1a)。隨后在脛骨表面作長約10 mm的橫向切口,切開骨膜組織,并用骨膜剝離尺在骨膜下建立適合骨膜牽張板的通道(見圖1b)。提起骨膜組織,用直徑2.0 mm的克氏針或鉆頭在脛骨表面不同位置鉆孔(鉆孔數不少于4個)進行必要的髓腔減壓處理。骨膜下通道中置入牽張板(見圖1c),牽張板鎖定孔居于骨膜切口中央,置入空心螺釘,并用1.2 mm克氏針通過空心螺釘孔對牽張板進行固定(見圖1d)。逐層縫合并包扎傷口。同時對足部潰瘍進行適當的清創處理,取深部壞死組織完善細菌培養及藥敏,切除壞死的足趾及合并骨髓炎的骨組織。

a 暴露骨膜組織 b 建立骨膜下通道 c 通道下置入牽張板 d 置入空心螺釘
1.2.3 術后處理 術后第3天起旋動空心螺釘,使骨膜牽張板以每天0.75 mm(分2~4次完成)的速度緩慢向外牽張骨膜組織。3周后復查X線片,若傷口愈合良好則拆除骨膜牽張裝置;若傷口愈合緩慢則增加一個周期的治療。整個療程共4~6周。期間術后釘道用生理鹽水清洗預防感染,常規傷口換藥、抗感染、控制血糖等處理。
1.3 評價指標 (1)記錄手術時間(包括傷口清創時間)、術中失血量(包括傷口清創失血量)。(2)術前、術后采用雙下肢CTA檢查評估血管的鈣化程度、膝下動脈閉塞情況;記錄足溫:室溫條件下,使用紅外線測溫儀測量第1及第5足趾腹側、足背、內外踝處皮溫,取其平均值,足趾缺如時,數據進行相應的減少;記錄趾端血氧飽和度:室溫25℃左右,使用指夾式血氧儀檢測第1足趾的血氧飽和度,當第1足趾缺失時,依次序檢測下位足趾。(3)采用踝肱指數及Wagner分級評估療效,采用疼痛視覺模擬評分(visual analogue scale,VAS)評估靜息疼痛改善情況,采用健康調查簡表(the MOS item short from health survey,SF-36)評價患者術后生活質量改善情況。(4)評估術后并發癥情況,包括釘道感染、皮膚壞死、骨不連、骨髓炎、外固定松動、骨折等手術不良反應。
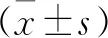
2 結 果
2.1 臨床資料比較 19例患者均順利完成手術,手術時間為(41.32±1.97)min,術中失血量為(50.21±6.69)mL。
與術前相比,術后3個月患者踝肱指數明顯改善,趾端血氧飽和度明顯上升,靜息疼痛明顯改善,足溫顯著提高,Wagner分級情況明顯改善(見表1)。

表1 手術前后足溫、趾端血氧飽和度、踝肱指數、VAS、Wagner分級結果
與術前相比,術后3個月患者在生理機能、生理職能、軀體疼痛、健康狀況、精力評估、社會功能、情感職能、精神健康等方面明顯改善(P<0.05),生活質量明顯提高(見表2)。

表2 手術前后SF-36評分情況(分)
2.2 雙下肢CTA 術前CTA檢查均發現,患者下肢動脈血管存在不同程度的血管鈣化,部分膝下動脈閉塞。其中血管粥樣硬化和狹窄甚至閉塞最常見于膝下脛前動脈和脛后動脈,而在膝上流入道血管(如腘動脈、股動脈、髂動脈)中極少見。末次隨訪時CTA檢查發現,90%的患者可見下肢遠端小血管生成和牽張區域側枝循環的形成,部分血管向遠端延伸。
2.3 并發癥 患者均未并發骨折、骨髓炎情況,2例患者術后出現釘道感染。
2.4 典型病例 59歲男性患者,因“右足足母趾破潰伴膿腫形成16 d”入院,既往Ⅱ型糖尿病10余年。入院時右足足母趾腫脹,局部皮膚破潰,有膿性滲出物,糖尿病足Wagner 3級,術前右下肢CTA可見脛前動脈、腓動脈堵塞。行右足足母趾清創+脛骨骨膜牽張術(0.75 mm/d)治療。術后1周復查X線片未見明顯骨折,骨膜牽張裝置被頂起;術后1個月傷口愈合;術后3個月CTA可見右下肢脛后動脈沿足底延伸至遠端,脛前動脈、腓動脈均有一定延伸。手術前后影像學資料見圖2~6。

圖2 術前右下肢大體照 圖3 術前CTA示脛前動脈、腓動脈堵塞 圖4 術后1周X線片示骨膜被頂起,無明顯骨折 圖5 術后1個月傷口大體照 圖6 術后3個月CTA示脛后動脈、脛前動脈、腓動脈均有延伸
3 討 論
Ilizarov脛骨橫向骨搬移技術的原理是通過反復刺激脛骨骨髓組織,使血管內皮細胞有絲分裂和組織再生,從而重建下肢血液循環,改善微循環血運,促進潰瘍愈合和抑制局部感染,避免截肢[8],同時可以在一定程度上再生骨骼、肌肉、神經、皮膚等組織。該技術通過對患肢脛骨行“開窗”手術,可以有效降低脛骨髓腔內的壓力,緩解髓腔內中小動脈痙攣的發生,這對改善下肢疼痛、肢體麻木等癥狀有很大價值[9]。同時,截骨塊的搬移也可有效緩解下肢靜息疼痛和局部腫脹,改善皮膚顏色,這與下肢新生血管的重建和側循環的形成有關[10]。此外,結合外固定技術,在治療期間截骨塊的搬移可以反復調整,從而有利于微循環的重建[11],且有利于清創、換藥、觀察創面,減少術后感染等并發癥[12]。2020年版的專家共識肯定了該技術誘導下肢微血管網的重建、促進傷口愈合,避免截肢的功效[13]。但該技術存在創傷大、骨折風險、費用昂貴、患者痛苦等弊端,盡管部分學者通過縮小截骨面積、導板截骨、經皮微創截骨等手段來減少手術創傷,但仍無法避免對脛骨進行截骨,截骨區域仍存在繼發骨折的風險;同時由于外固定架體積較大、佩戴不便,導致患者行動不便、舒適度低、遵醫性較差。
目前大部分研究都強調了骨膜在牽拉成骨過程中的重要性,相關動物實驗也發現,在搬移截骨塊的過程中新生骨的周圍存在豐富的新生血管網[14]。Choi等[15]開展的動物研究表明,在牽拉大鼠脛骨骨塊的過程中,可見骨膜血管增生明顯,且與周圍軟組織血管網形成側枝循環。另外,Schmidt等[16]及劉亞等[17]開展的研究發現,單純牽拉兔頜骨上的骨膜組織可明顯促進牽拉區域毛細血管網增生。牽張骨膜組織同樣可以促進牽張區域血管網增生及側枝循環的建立,這為脛骨骨膜牽張技術提供了必要的理論基礎。近期,曾納新教授等[18]開展的相關動物實驗表明,單純牽張家犬脛骨骨膜組織,可以促進牽張區域及遠端毛細血管網再生;并提出脛骨骨膜牽張技術治療糖尿病足的新方案,且成功地將該技術應用于糖尿病足患者的臨床治療,療效顯著。
本研究采用脛骨骨膜牽張技術治療糖尿病足患者,術后均隨訪3個月。手術時間為(41.32±1.9)min,術中失血量為(50.21±6.69)mL,考慮為脛骨骨膜牽張技術無需對脛骨進行截骨開窗,無需置入特制的外固定架,只需要在骨膜下建立通道,置入牽張板。局部鉆孔減壓即可,故可以極大地縮短手術時間,同時可以避免脛骨截骨所致的術中出血,減少患者的術后創傷應激反應。同時術后3個月VAS評分、足溫、踝肱指數、趾端血氧飽和度、Wagner分級較術前明顯改善,這可能與機體干細胞動員(骨髓間充質干細胞、血管內皮祖細胞等)而且多在牽張后迅速達到高水平所致的血管再生以及術后應激反應相關[19]。術后末次隨訪CTA檢查可發現90%的患者可見下肢遠端小血管生成和牽張區域側枝循環的形成,部分血管向遠端延伸,足以表明脛骨骨膜牽張技術同樣可以促進下肢周圍微循環重建及實現遠端部分血管再通的能力。
清創術是外科控制感染的基礎手術,也是糖尿病足創面處理的第一要素。本研究患者術中均對創面行清創術,清除壞死或失活組織,去除濕性壞疽的足趾及合并骨髓炎的骨組織,這一過程有助于肉芽組織的形成和上皮再生,并減少足底胼胝區域的壓力[20]。清創術在感染控制中也起著重要的作用,因為失活組織為細菌增殖提供了場所及養料,同時對抗生素起著物理屏障的作用,限制了機體的抗感染能力[21]。美國感染病學會和傷口愈合學會推薦對DF創面行銳利清創,而非局部清創(即自溶敷料或生物清創)[22]。有效、及時的清創手術可降低糖尿病足患者的截肢率[23],特別是累及到骨組織的深部傷口,更加需要早期積極地清創手術[24]。
基于牽拉組織再生原理的脛骨骨膜牽張技術,衍生于脛骨橫向骨搬移技術,具有微創、裝置操作簡約、便于術后管理,手術操作簡約、學習曲線短、便于臨床推廣,住院費用低、住院時間短,患者更易接受、依從性更高等特點。隨著該技術的逐漸推廣,有望成為治療Wagner 2~4級糖尿病足的首選外科治療方案。
目前脛骨骨膜牽張技術也存在一些不足:(1)缺乏多中心臨床研究數據的支撐,目前尚且在少數醫院推廣該技術;(2)該術式適應證還不夠完整,據報道對于合并心功能衰竭及腎衰的患者療效不理想[25];(3)目前該技術主要應用于臨床治療,其確切的作用機制有待進一步的基礎研究;(4)血栓閉塞性脈管炎是一種臨床診斷,做出該診斷的前提是排除其他可能的診斷,需要排除的血管疾病主要包括動脈硬化性疾病、血栓栓塞類疾病、腘動脈夾閉綜合征、系統性紅斑狼瘡或系統性硬皮病引起的閉塞性血管病或白塞病等[26]。本研究主要通過是否存在吸煙史、反復發作游走性血栓性淺靜脈炎及雙下肢CTA是否存在鈣化斑來初步剔除血栓閉塞性脈管炎患者,存在一定不足。
綜上所述,脛骨骨膜牽張技術可以改善糖尿病足患肢的缺血癥狀及周圍神經病變,促進潰瘍創面的愈合,改善生活質量。且該技術對組織結構損傷小、更加微創、手術時間更短、操作簡單、費用低、術后并發癥少、患者舒適度高,極大豐富了糖尿病足手術干預治療手段。

