楊桃根多糖醇沉工藝優化研究*
廖彭瑩,陳敏玉,孫雪芹
(廣西中醫藥大學藥學院,廣西 南寧 530200)
楊桃根系酢漿草科植物楊桃(AverrhoacarambolaL.)的根,在我國主要分布于福建、臺灣、云南、廣西、廣東等地[1],其味酸、澀,性平,具有祛風除濕、行氣止痛、澀精止帶的功效[2]。研究表明楊桃根具有多種藥理活性,如楊桃根醇提取物對CCl4誘導的肝纖維化大鼠肝臟細胞具有保護作用[3],具有降低血壓的作用[4],可以緩解氧化應激對腎組織造成的損傷,起到改善糖尿病小鼠腎損傷的作用[5],能夠調節糖尿病小鼠的糖代謝酶活性,降低血糖,提高糖耐量和糖尿病小鼠肝臟的抗氧化能力[6]。
多糖類成分近年來備受關注,許多植物多糖已被證實具有多種生物活性,如香菇多糖自1968年提取出來就受到研究人員的持續關注,并已開發成多種相關產品[7],花椒葉多糖具有抗菌活性[8],蘆筍皮多糖具有免疫調節活性[9]等。楊桃根多糖具有抗氧化、降糖降血脂活性[10-13],課題組在前期研究中采用單因素實驗法和正交實驗法優化了楊桃根多糖的熱水提取工藝[10],但關于楊桃根多糖的醇沉工藝未見相關研究。多糖是極性物質,不溶于醇等有機溶劑,常采用水提醇沉工藝進行制備[11-12]。水提醇沉工藝簡便易行,不需要額外設備,成本較低[14]。研究人員曾采用單因素實驗法優化了荔枝核多糖、人參多糖和大蒜多糖的醇沉工藝,減少了有效成分損耗,多糖質量分數和產量均有所提高[14-16]。
本研究采用單因素結合響應面試驗優化了楊桃根多糖的醇沉工藝,為楊桃根活性多糖的深入研究提供了科學依據。
1 材料與方法
1.1 材料與試劑
楊桃根于2018年3月采于廣西南寧,經廣西中醫藥大學朱意麟實驗師鑒定為酢漿草科五斂子屬植物楊桃(AverrhoacarambolaL.)的根部,粉碎過40目篩后備用;濃硫酸(98%)、鹽酸、苯酚、D-(+)-葡萄糖,國藥集團化學試劑有限公司;所有化學試劑均為分析純;水為純化水。
1.2 儀器與設備
BS2204S型電子分析天平,北京賽多利斯儀器系統有限公司;8453紫外可見分光光度計,美國安捷倫科技公司;SHB-III型循環水式多用真空泵,武漢亨泰達儀器設備有限公司;數顯恒溫水浴鍋,金壇市醫療儀器廠;KQ-500DA型超聲波清洗機昆山市超聲儀器有限公司;EPED-E2-20TS型超純水儀,南京易普達科技發展有限公司。
1.3 方 法
1.3.1 多糖提取與含量測定
稱取楊桃根粗粉500 g,按優化工藝[10]進行提取,將所得藥液濃縮至一定體積,于4 ℃下加入95%乙醇,靜置一定時間后,抽濾,所得沉淀用乙醚、丙酮洗滌,減壓干燥,得到多糖。精密稱取多糖用超純水溶解,配制成一定濃度溶液,按照文獻[10]方法操作,測定吸光值,按下式計算溶液中多糖含量。采用苯酚-硫酸法測定樣品溶液中多糖含量[10]。
多糖含量%=[(C × V ×D)/M]×100%
(1)
式中,C為樣品溶液中多糖的濃度,mg/mL;V為樣品溶液的體積,mL;D為稀釋倍數;M為楊桃根多糖質量,mg。
1.3.2 醇沉工藝優化
準確稱取500 g楊桃根粗粉,按“2.1”項下操作進行提取,將提取液分成若干等份,每份50 mL,考察醇沉濃度、醇沉時間和提取液濃度對多糖含量的影響,即設置醇沉濃度分別為40%、50%、60%、70%和80%,靜置12 h;醇沉濃度為60%,設置醇沉時間分別為4、8、12、16和20 h;醇沉濃度為60%,醇沉時間為12 h,設置提取液濃度分別為5.00、3.33、2.50、2.00和1.67 g/mL。在單因素實驗基礎上,進一步采用采用Design Expert 8.0.6軟件設計三因素三水平響應面試驗,進行醇沉工藝優化,并進行驗證實驗。
2 結果與分析
2.1 單因素試驗
單因素實驗結果見圖1所示。由圖1(A)可知,醇沉濃度為40%~60%時,多糖含量與醇沉濃度呈正相關,在60%時含量最高,可達53.59%。肖瓊等研究表明[17],醇沉過程中存在臨界乙醇量值,當乙醇總量低于該值時,醇溶物的量與乙醇用量成正比,高于該值時,增加趨勢減緩直至不再增加。綜合考慮乙醇用量及多糖含量,選擇60%乙醇為響應面試驗醇沉濃度的中心點。
由圖1(B)可知,醇沉時間為4~12 h時,多糖含量與醇沉時間呈正相關,在12 h時含量最高,可達36.58%,醇沉時間超過12 h,隨著醇沉時間增加,含量呈下降趨勢。可能的原因是隨著醇沉時間增加,蛋白質、淀粉等大分子沉降顆粒之間互相作用、互相交聯,形成更大顆粒,沉降速度加快[18]。隨著醇沉時間增加,沉淀越多,但多糖含量減少,選擇12 h作為響應面試驗醇沉時間的中心點。
由圖1(C)可知,提取液濃度在1.67~5.00 g/mL范圍內,多糖含量與提取液濃度呈正相關,在2.50 g/mL時含量最高,可達30.49%,而提取液濃度超過2.50 g/mL后,隨著提取液濃度增大,含量呈下降趨勢。這可能是由于提取液濃度過高時,藥液黏稠度增大,乙醇與藥液難以充分接觸,易溶于乙醇的大分子雜質易沉淀,導致沉淀中多糖含量減少[19],故選擇2.50 g/mL作為響應面試驗提取液濃度的中心點。
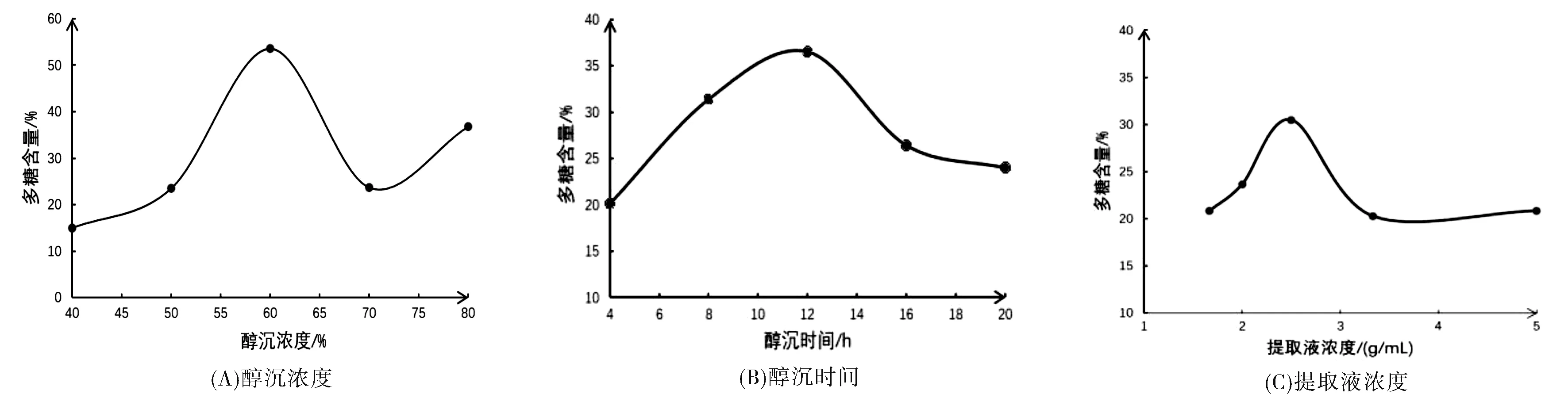
圖1 單因素試驗結果
2.2 響應面試驗
根據單因素試驗結果,以醇沉濃度(A)、醇沉時間(B)和提取液濃度(C)為因素,以多糖含量(Y)為響應值,采用Design Expert 8.0.6軟件設計三因素三水平響應面試驗,進行醇沉工藝優化。因素與水平見表1所示,試驗方案與結果見表2所示。
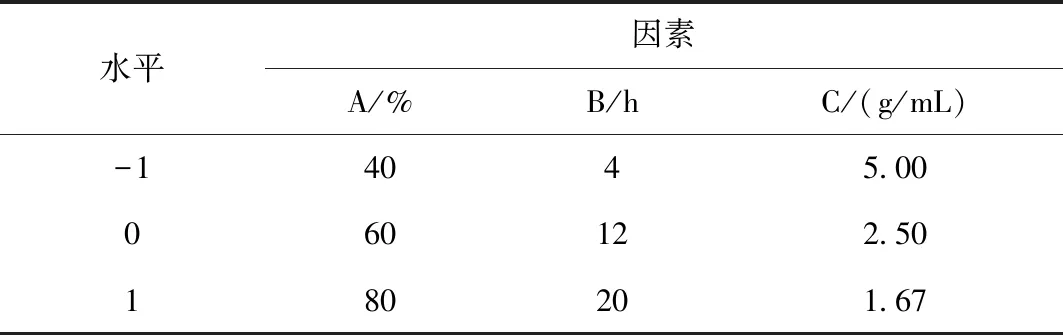
表1 響應面試驗因素與水平表
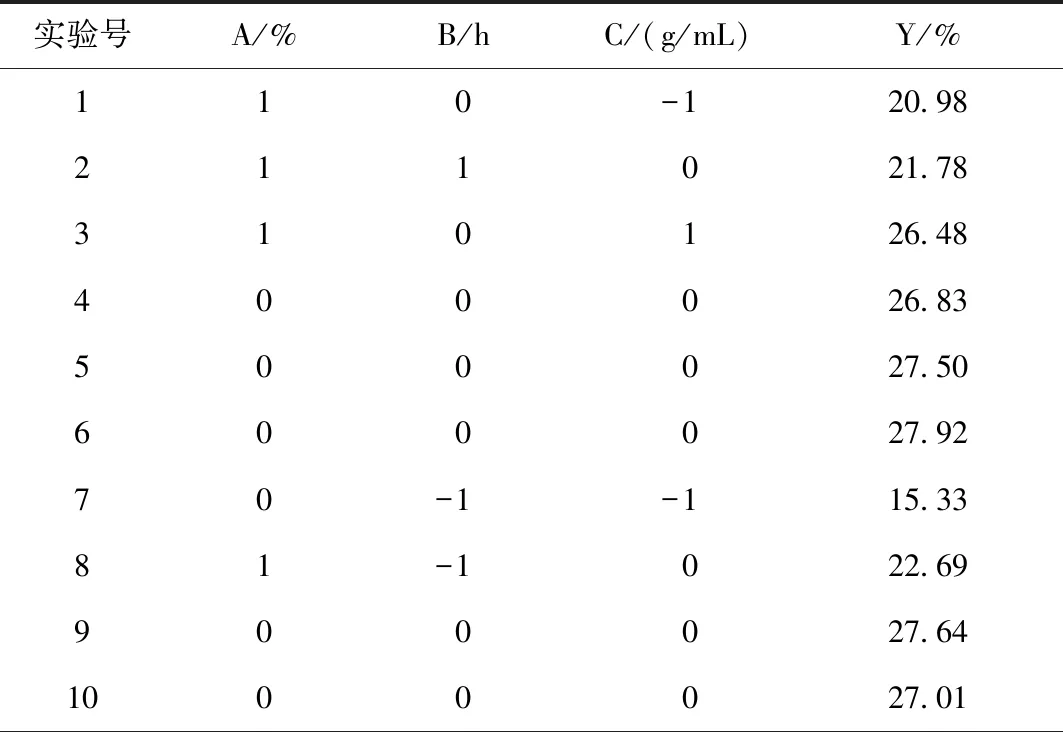
表2 響應面試驗設計及其結果

續表2
對表2中的數據進行回歸分析,得到二元多次回歸方程:
Y=27.38+2.04A+0.68B+1.10C-1.00AB+1.97AC
-1.95BC-2.50A2-4.94B2-2.94C2
(2)
對其進行方差分析,結果見表3所示。
為進一步評價A、B、C之間的交互作用對多糖含量的影響并確定各因素的最佳水平范圍,繪制了等高線圖和響應面圖,結果見圖2所示。由圖2可知,當醇沉濃度一定時,隨著醇沉時間延長,多糖含量先增加后減小;當醇沉時間一定時,隨著醇沉濃度增加,多糖含量呈先增加后減小趨勢。響應曲面坡度相對較平,表明醇沉濃度和醇沉時間的交互作用對多糖含量的影響較弱。當醇沉濃度固定時,隨著提取液濃度增大,多糖含量呈現先增加后減小的趨勢;當提取液濃度固定時,隨著醇沉濃度增加,多糖含量呈先增加后減小趨勢。響應曲面坡度相對陡峭,表明醇沉濃度和提取液濃度的交互作用對多糖含量影響較大。當醇沉時間固定時,隨著提取液濃度增加,多糖含量先增加后減小;當提取液濃度固定時,隨著醇沉時間延長,多糖含量呈先增加后減小趨勢。響應曲面坡度相對陡峭,表明醇沉時間和提取液濃度的交互作用對多糖含量的影響較大。根據試驗模型得到醇沉工藝最優條件為:醇沉濃度68.95%,醇沉時間12.57 h,提取液濃度2.23 g/mL,預測多糖含量為28.06%。結合實際,將醇沉工藝優化為醇沉濃度69.00%,醇沉時間 13 h,提取液濃度為2.22 g/mL。
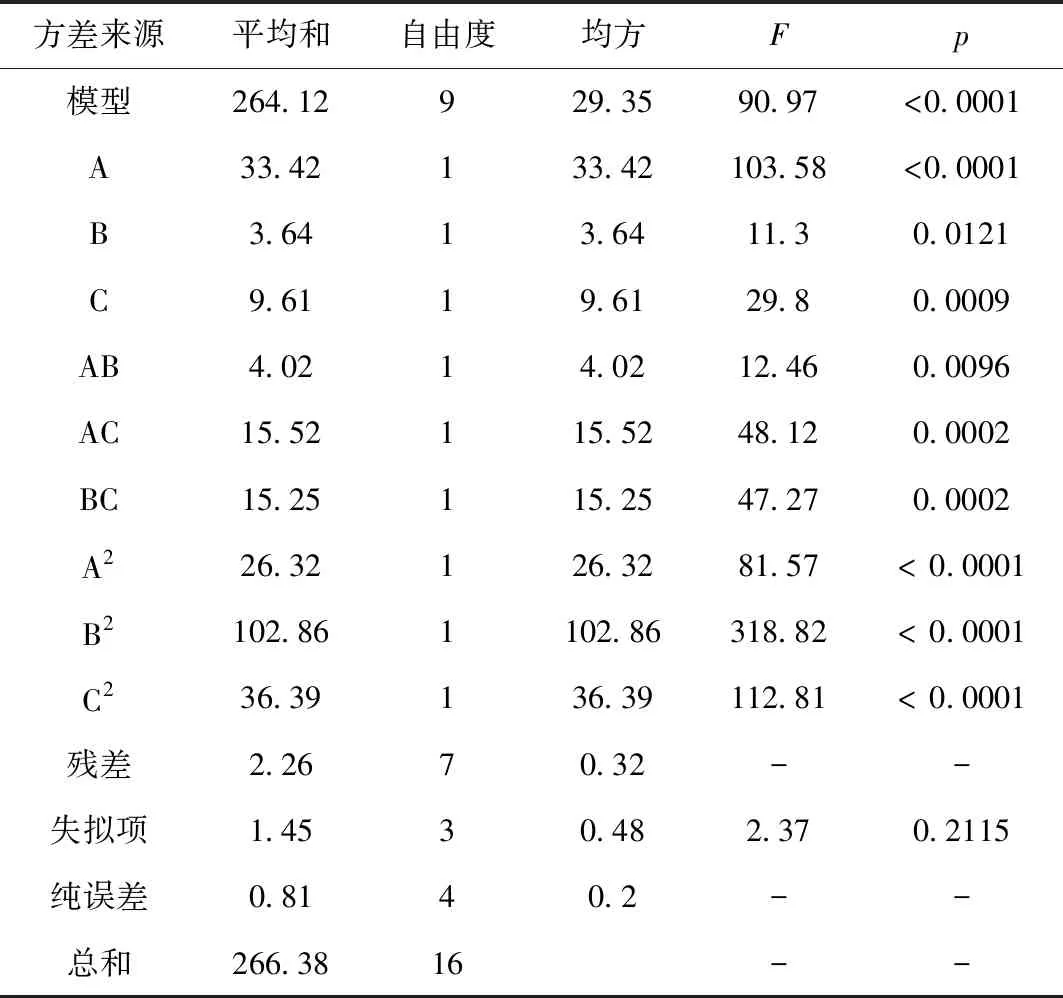
表3 方差分析結果
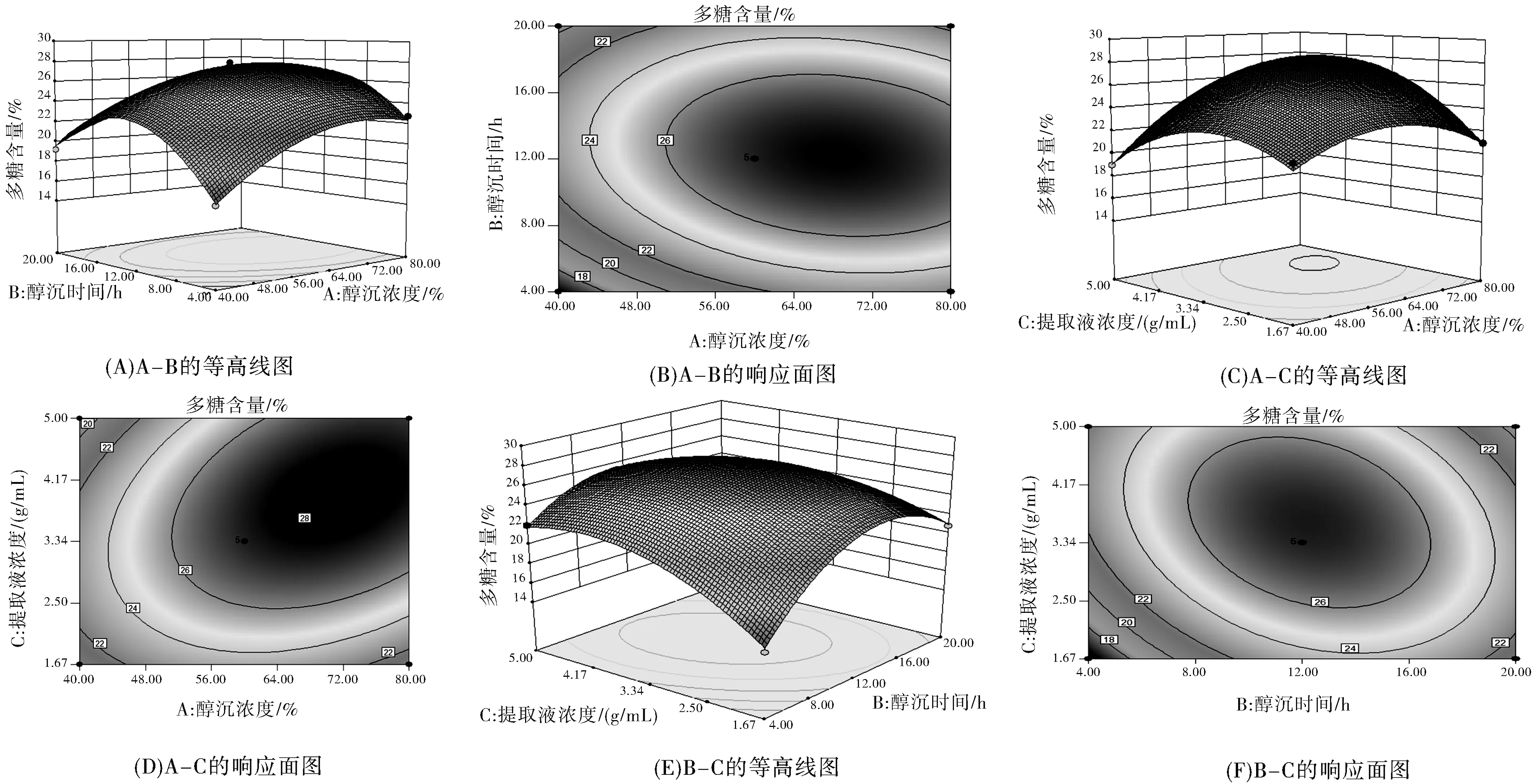
圖2 各因素交互作用對多糖含量的效應曲面圖和等高線
2.3 驗證試驗
根據優化醇沉工藝,進行3次平行驗證試驗,所得多糖含量分別為28.20%,27.85%和27.78%,平均值為27.94%(RSD=0.81%,n=3),與預測值28.06%相近,表明該模型預測性良好,優化工藝穩定可行。
3 結 論
植物多糖常用提取方法很多,本研究選擇水提醇沉法,該法對儀器設備要求不高、操作簡單,不需要對提取液進行加熱,避免了對多糖結構的破壞,避免多糖裂解。本研究在單因素試驗基礎上利用響應面法優化了醇沉工藝,影響多糖含量的各因素排序為:醇沉濃度>提取液濃度>醇沉時間,優化醇沉工藝為醇沉濃度68.95%,醇沉時間12.57 h,提取液濃度為 2.23 g/mL,結合實際,調整為醇沉濃度69%,醇沉時間13 h,提取液濃度為2.22 g/mL。在此條件下所得楊桃根多糖含量為27.94%,與理論值28.06%接近,說明響應面法優化多糖醇沉工藝穩定可靠,可為其高效制備工藝開發提供研究依據。優化工藝常用方法有正交設計與響應面設計,其中響應面法采用非線性模型,得到的預測模型是連續的,而正交設計法是用線性數學模型進行設計,只對孤立的點進行實驗分析,不能在整個區域上找到因素的最佳組合。故本論文采用響應面法進行了優化。

