淫羊藿苷對TGF-β1誘導的腎小管上皮細胞上皮間質轉分化的作用及機制*
王申偉 ,王瓊 ,陳軍童 ,趙艷艷
(1.河南科技大學附屬許昌市中心醫院腎內科,許昌 461000;2.鄭州大學第一附屬醫院內分泌科,鄭州 450000)
腎間質纖維化是各種慢性腎臟病進展到終末期腎病的主要病理特征,其輕重程度是各種腎臟疾病向腎功能的惡化程度的關鍵因素,成為了威脅世界公共健康的主要疾病之一[1-2]。腎小管上皮細胞向上皮-間質轉化是腎間質纖維化的發病關鍵環節,主要是上皮細胞的黏附能力降低,α-平滑肌肌動蛋白(α-SMA)的表達增加,基底膜破壞以及細胞侵襲和遷移能力增加[3-4]。上皮質間質轉化受許多細胞因子的調控,如轉化生長因子-β1(TGF-β1),是一種致纖維化因子,研究表明其對腎小管上皮細胞上皮間質轉化至關重要[5]。因此,阻斷或抑制TGF-β1的作用已成為防治腎間質纖維化的重要靶點。
淫羊藿苷是淫羊藿中重要有效成分,具有補肝腎、強筋骨和祛風濕等作用[6]。研究表明,淫羊藿苷對肝、腎等臟器具有保護作用,對防治腎纖維化具有較好的療效[7]。但淫羊藿苷對腎小管上皮細胞的上皮間質轉化的作用尚不明確。基于此,本研究采用人腎皮質近曲小管上皮細胞(HK-2),通過TGF-β1誘導后,分別采用不同濃度的淫羊藿苷干預后,觀察細胞的增殖,遷移和侵襲能力,以及上皮間質轉化的相關因子α-SMA、上皮細胞鈣黏蛋白(ECad)、波形蛋白(Vim)以及Samd信號通路的變化。
1 材料與方法
1.1 細胞、主要試劑及試劑盒 HK-2細胞購自中科院上海細胞庫。FBS胎牛血清、DMEM/F12培養基和 0.05%的胰蛋白酶(Gibco,Waltham,MA);淫羊藿苷(Sigma-Aldrich);TGF-β1(廣州聚研生物有限公司);Trizol試劑和 BCA 試劑(Invitrogen;Thermo Fisher Scientific,lnc.);CCK-8 試劑盒(北京索萊寶科技有限公司);0.25%甲紫溶液(索萊寶科技有限公司);Transwell小室(密理博科技有限公司);PrimeScriptTM RT 試劑盒(Takara Biotechnology);SYBR-Green qPCR Master Mix(北京康潤誠業生物科技有限公司);RIPA緩沖液、一抗稀釋液、二抗稀釋液、SDS-PAGE和PVDF膜(上海碧云天生物技術有限公司);鼠抗人 α-SMA、E-cadherin、vimentin、Smad2/3、p-Smad2/3和 GAPDH單分子抗體(Abcam);兔抗鼠二抗(Cell Signaling Technology);超敏發光液ECL(北京四正柏生物科技有限公司)。
1.2 實驗方法
1.2.1 細胞培養 HK-2細胞通過常規復蘇后,用含10%FBS的DMEM/F12培養液,于37℃恒溫,5% CO2的培養箱中進行培養。隔日進行傳代1次,實驗使用的細胞為對數生長期的細胞。
1.2.2 細胞轉染和分組 將HK-2細胞接種于6孔板,待其長至密度40%~50%后,將其分為空白對照組、TGF-β1 組、TGF-β1+淫羊藿苷(10、20、40μmol/L)組。TGF-β1組是將10 μg/L的TGF-β1干預HK-2細胞 24 h。TGF-β1+淫羊藿苷(10、20、40 μmol/L)組是 HK-2細胞在 10 μg/L TGF-β1誘導 24 h后,換成 10、20、40 μmol/L 的淫羊藿苷干預 24 h。空白對照組是未干預的HK-2細胞。
1.2.3 細胞增殖 將空白對照組、TGF-β1組、TGF-β1+淫羊藿苷(10、20、40 μmol/L)組在鋪于96孔板內,每孔細胞數量為5 000個/孔。每1組均需要設立6個復孔用于計算該組平均值。在各組藥物干預過后,添加CCK-8試劑,每孔10 μL/孔。在37℃孵育2 h,放入酶標儀內,450 nm檢測各孔OD值,分析各組細胞增殖情況。實驗均獨立重復3次。
1.2.4 細胞劃痕實驗 待空白對照組、TGF-β1組、TGF-β1+淫羊藿苷(10、20、40 μmol/L) 組的 HK-2細胞長至80%~90%,用10 μL槍頭尖端在培養皿中央垂直劃一道痕跡,用PBS洗去脫壁的細胞,于培養箱培養0、24 h后,放于倒置顯微鏡觀察劃痕兩側細胞遷移的距離,遷移率=(劃痕寬度0 h-劃痕寬度12 h/24 h)/劃痕寬度0 h×100%。該實驗需獨立重復3次。
1.2.5 Transwell小室檢測細胞侵襲能力 實驗分為空白對照組、TGF-β1組、TGF-β1+淫羊藿苷(10、20、40 μmol/L)組。TranswellTM 小室上層表面加入100 μL 的基質膠(Matrigel),搖勻后放置培養箱40 min。將100 μL不含血清培養基稀釋淫羊藿苷分別至 10、20、40 μmol/L 以及添加 10 μg/L TGF-β1,調整HK-2細胞密度至每毫升3×105個,取500 μL接種至上層。每組設立3個復孔。培養箱培養12 h后,將小室取出,用甲醇固定15 min后,風干后,再向孔內添加2.5 mL/L甲紫溶液染色30 min。將小室放在倒置顯微鏡下隨機選取5個視野(×200),拍照記錄遷移下室的細胞總數。該實驗需獨立重復3次。
1.2.6 實時熒光定量PCR法檢測相關基因mRNA表達水平 將空白對照組、TGF-β1組、TGF-β1+淫羊藿苷(10、20、40 μmol/L)組的細胞收集后,通過Trizol試劑分別提取各組總RNA。通過NanoDrop 2000分光光度計檢測RNA純度和濃度,使用總RNA逆轉錄擴增為cDNA(反轉錄條件:37℃ 60 min,85 ℃ 5 min)。20 μL PCR 反應體系:0.4 μL 目的模板cDNA,10 μL SYBR-Green qPCR Master Mix 和對應的上下游引物各 0.4 μL,8.8 μL ddH2O。PCR 擴增條件為:95℃預變性2 min,95℃變性15 s,60℃退火 45 s,72℃ 延伸 30 s,共計 40個循環,在 ABI 7500 fast儀器中進行。以GAPDH作為mRNA的標準內參,基因表達結果均以2-ΔΔCt進行統計。本實驗所有PCR引物序列見表1。
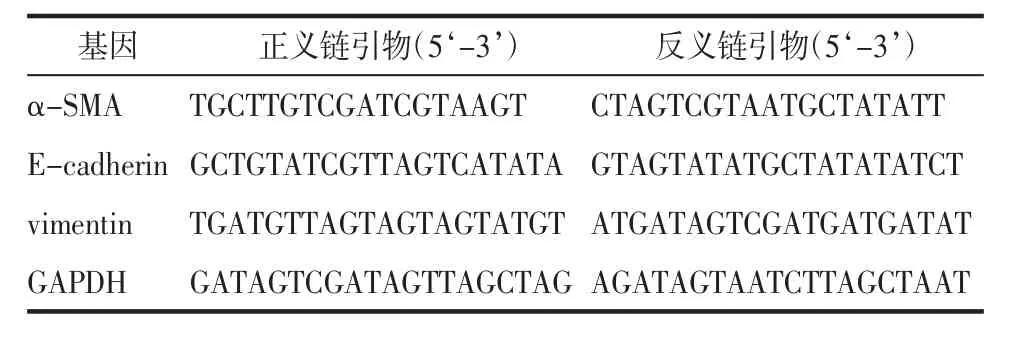
表1 實時熒光定量PCR所需的引物序列
1.2.7 蛋白質印跡法檢測相關蛋白表達水平 將空白對照組、TGF-β1 組、TGF-β1+淫羊藿苷(10、20、40 μmol/L)組細胞液氮碾磨后,用 RIPA 緩沖液和PMSF抑制蛋白降解液(100∶1)將樣本裂解后提取各組總蛋白。通過BCA試劑檢測蛋白質的總濃度,將各組的總蛋白濃度調為一致,將其于100℃進行變性后保存至-20℃。SDS-PAGE電泳分離總蛋白后,將其轉膜至PVDF膜。然后用5%脫脂牛奶封閉2 h,TBST洗滌3次,每次10 min后,將其放入對應的一抗(α-SMA、E-cadherin、vimentin、Smad2/3、p-Smad2/3 和 GAPDH)和一抗稀釋混懸液(1∶1 000)中,4℃孵育過夜。再用TBST洗滌3次,放入二抗和二抗稀釋液(1∶4 000)混懸液中,室溫孵育 2 h。TBST洗滌3次,每次10 min,將超敏發光液ECL滴在膜上,放入化學發光成像儀(Invitorgen,USA)進行蛋白顯影。通過Image J軟件進行分析結果,相對蛋白表達以GAPDH標準化。
1.3 統計學方法 應用SPSS 20.0軟件進行數據分析,計量資料以均數±標準差(±s)表示,各組間比較采用單因素方差分析,組間兩兩比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 淫羊藿苷抑制TGF-β1誘導的HK-2增殖能力 CKK-8的結果表明,與空白對照組比較,TGF-β1組的細胞增殖水平顯著增加(P<0.05)。與TGF-β1組比較,隨著淫羊藿苷干預濃度的增加,細胞增殖水平的差異無統計學意義(P>0.05)。見表2。
表2 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞增殖影響(±s)

表2 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞增殖影響(±s)
注:與空白對照組比較,*P<0.05;與 TGF-β1 組比較,#P<0.05。
組別 數量 增殖水平,OD值空白對照組 3 1.042±0.065 TGF-β1 組 3 1.863±0.094*淫羊藿苷組(10 μmol/L) 3 1.316±0.081#淫羊藿苷組(20 μmol/L) 3 1.259±0.082#淫羊藿苷組(40 μmol/L) 3 1.221±0.062#
2.2 淫羊藿苷抑制TGF-β1誘導的HK-2侵襲能力 Transwell侵襲實驗結果表明,TGF-β1組侵襲細胞數顯著高于空白對照組(P<0.05)。TGF-β1+淫羊藿苷(10、20、40 μmol/L)組侵襲細胞數顯著低于TGF-β1組(P<0.05),隨著淫羊藿苷干預濃度增加,細胞侵襲數量的差異無統計學意義(P>0.05)。見圖1A和表3。
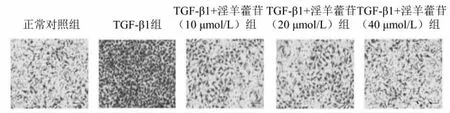
圖1 5組HK-2細胞的侵襲情況(×200)
表3 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞侵襲能力影響(±s)

表3 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞侵襲能力影響(±s)
注:5組HK-2細胞侵襲數量的柱狀圖分析(與空白對照組比較,*P<0.05;與 TGF-β1 組比較,#P<0.05)。
組別 數量 侵襲數量,個空白對照組 3 71.2±5.12 TGF-β1組 3 201.1±9.24*淫羊藿苷組(10 μmol/L) 3 141.8±7.81#淫羊藿苷組(20 μmol/L) 3 112.3±6.28#淫羊藿苷組(40 μmol/L) 3 99.4±4.17#
2.3 淫羊藿苷抑制TGF-β1誘導的HK-2遷移能力 劃痕實驗結果顯示,與空白對照組比較,TGF-β1組在24 h內遷移率顯著增加(P<0.05)。與TGF-β1 組比較,TGF-β1+淫羊藿苷(10、20、40 μmol/L)組在24 h內遷移率顯著下降(P<0.05)。隨著淫羊藿苷增加,遷移率差異無統計學意義(P>0.05)。見圖2A和表4。

圖2 24 h 5組HK-2細胞的遷移情況(×40)
表4 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞侵襲能力影響(±s)%
注:5組24 h HK-2細胞劃痕率的柱狀圖分析(與空白對照組比較,*P<0.05;與 TGF-β1 組比較,#P<0.05)。
組別 數量 遷移率空白對照組 3 42.5±3.27 TGF-β1組 3 68.1±2.41*淫羊藿苷組(10 μmol/L) 3 48.3±1.19#淫羊藿苷組(20 μmol/L) 3 44.3±1.83#淫羊藿苷組(40 μmol/L) 3 43.7±2.71#
2.4 淫羊藿苷抑制TGF-β1誘導的HK-2上皮間質轉化能力 實時定量PCR和Western blot結果顯示,與空白對照組比較,TGF-β1組的 α-SMA、vimentin蛋白和mRNA的表達量顯著增加(P<0.05),而E-cadherin蛋白和mRNA表達量顯著降低(P<0.05)。與 TGF-β1組比較,TGF-β1+淫羊藿苷(10、20、40 μmol/L) 組的 α-SMA、vimentin 蛋白和mRNA的表達量顯著降低(P<0.05),E-cadherin蛋白和 mRNA 表達量顯著增加(P<0.05),TGF-β1+淫羊藿苷(10、20、40 μmol/L)組組間比較,差異無統計學意義(P>0.05)。見圖 3A 和表 5、6。
表5 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞中α-SMA、vimentin、E-cadherin 蛋白表達情況的影響(±s)
注:與空白對照組比較,*P<0.05;與 TGF-β1 組比較,#P<0.05。
組別 數量 α-SMA vimentin E-cadherin空白對照組 3 0.171±0.041 0.221±0.036 1.150±0.095 TGF-β1 組 3 0.761±0.078*1.052±0.096*0.123±0.018*淫羊藿苷組(10 μmol/L) 3 0.421±0.056#0.398±0.059#0.942±0.048#淫羊藿苷組(20 μmol/L) 3 0.362±0.049#0.371±0.079#0.891±0.078#淫羊藿苷組(40 μmol/L) 3 0.331±0.059#0.302±0.094#0.921±0.099#
表6 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞中α-SMA、vimentin、E-cadherin 基因表達情況的影響(±s)

表6 不同濃度淫羊藿苷對TGF-β1誘導的HK-2細胞中α-SMA、vimentin、E-cadherin 基因表達情況的影響(±s)
注:與空白對照組比較,*P<0.05;與 TGF-β1 組比較,#P<0.05。
組別 數量 α-SMA vimentin E-cadherin空白對照組 3 0.326±0.097 0.301±0.036 1.000±0.080 TGF-β1 組 3 0.612±0.096*0.735±0.038*0.452±0.018*淫羊藿苷組(10 μmol/L) 3 0.333±0.056#0.401±0.059#0.812±0.058#淫羊藿苷組(20 μmol/L) 3 0.362±0.037#0.399±0.079#0.851±0.078#淫羊藿苷組(40 μmol/L) 3 0.328±0.031#0.362±0.044#0.892±0.048#
2.5 淫羊藿苷阻礙TGF-β1誘導的HK-2中Smad信號通路 Western blot結果顯示,與空白對照組比較,TGF-β1組的p-Smad2/3/Smad2/3蛋白比值顯著增加(P<0.05)。與 TGF-β1組比較,TGF-β1+淫羊藿苷(10、20、40 μmol/L)組的 p-Smad2/3/Smad2/3蛋白顯著降低(P<0.05)。與 TGF-β1+淫羊藿苷(20 μmol/L)組比較,TGF-β1+淫羊藿苷(40 μmol/L)組和 TGF-β1+淫羊藿苷(10 μmol/L)組的 p-Smad2/3/Smad2/3蛋白比值差異無統計學意義(P>0.05)。見圖4和表7。

圖4 不同濃度的淫羊藿苷對Smad信號通路Smad2/3和p-Smad2/3蛋白表達情況
表7 不同濃度的淫羊藿苷對p-Smad2/3/Smad2/3蛋白比值比較(±s)

表7 不同濃度的淫羊藿苷對p-Smad2/3/Smad2/3蛋白比值比較(±s)
注:與空白對照組比較,*P<0.05;與 TGF-β1 組比較,#P<0.05。
組別 數量 p-Smad2/3/Smad2/3空白對照組 3 0.421±0.079 TGF-β1 組 3 0.875±0.082*TGF-β1+淫羊藿苷(10 μmol/L)組 3 0.484±0.023#TGF-β1+淫羊藿苷(20 μmol/L)組 3 0.503±0.048#TGF-β1+淫羊藿苷(40 μmol/L)組 3 0.442±0.052#
3 討論
近年來,盡管慢病腎臟病的治療效果取得進展,但仍合適的藥物和方法對慢病腎臟病患者進行有效的根治,由于腎間質內的纖維化加劇,最終發展為終末期腎病[8]。腎小管上皮細胞的上皮間質轉化是活化的肌成纖維細胞的重要來源,其主要表現為上皮細胞的黏附性降低,α-SMA的表達能力減低以及細胞的遷移和侵襲能力增加[4,10]。上皮間質轉化的發生過程需要多種分子參與,如TGF-β1,其作為最強的促纖維化因子,在腎臟纖維化中表達量增加,可通過Smad信號通路介導上皮間質轉化過程[11-12]。在TGF-β1的誘導下,腎小管上皮細胞表型發生變化,上皮間質轉化的標志性蛋白E-cadherin表達量減少,間充質標志性蛋白α-SMA的表達量增加,其機制主要是由于TGF-β1激活轉錄因子Smad2/3磷酸化,繼而與Smad4共同活化形成低聚復合體,啟動核轉錄信號,最終調控腎臟上皮間質轉化相關因子的表達[5,13]。本研究結果顯示,與空白對照組比較,TGF-β1誘導后,HK-2細胞的增殖,遷移和侵襲能力明顯增加,并且α-SMA、vimentin蛋白和mRNA表達量增多,E-cadherin蛋白和基因表達量減少,表明TGF-β1刺激后HK-2細胞發生了EMT,提示構建成功腎小管上皮細胞上皮間質轉化模型。進一步研究結果顯示,TGF-β1誘導后,HK-2細胞中Smad信號通路被激活,p-Smad2/3與Smad2/3的比值明顯增加,這說明,TGF-β1誘導HK-2細胞中可能是通過激活Smad信號通路而影響其上皮間質轉化能力。
淫羊藿苷作為淫羊藿主要的有效成分之一,具有滋腎壯陽,保護腎臟等功能[14]。研究表明:淫羊藿苷對減輕慢性腎衰竭大鼠的腎臟組織纖維化,抑制腎小管萎縮[15]。淫羊藿苷可抑制由TGF-β1刺激的腎成纖維細胞的增殖和內源性TGF-β1的表達,對腎纖維化具有較好的效果[16]。本實驗結果顯示,10、20、40 μmol/L的淫羊藿苷均可以抑制 TGF-β1誘導的HK-2細胞的增殖,遷移和侵襲能力,并且隨著淫羊藿苷濃度的增加,其對TGF-β1誘導的HK-2細胞的抑制能力無明顯變化。本實驗Western blot和qPCR結果顯示,α-SMA、vimentin蛋白和基因表達量減少,E-cadherin蛋白和基因表達量增加,說明淫羊藿苷可抑制TGF-β1誘導的HK-2細胞的上皮間質轉化能力,但不會隨著淫羊藿苷濃度增加而抑制能力增加。為了進一步探究淫羊藿苷對HK-2細胞的作用機制,本研究檢測Smad信號通路的變化。實驗結果顯示,10、20、40 μmol/L 的淫羊藿苷均能抑制TGF-β1誘導HK-2細胞的Smad信號通路的傳導,主要是p-Smad2/3與Smad2/3蛋白比值明顯降低。
綜上所述,TGF-β1可誘導腎小管上皮細胞的上皮間質轉化,其可通過激活Smad2/3的磷酸化,從而引起上皮間質轉化的相關因子表達發生變化。淫羊藿苷能顯著逆轉TGF-β1誘導腎小管上皮細胞的上皮間質轉化以及增殖,侵襲和遷移能力,本研究也證實淫羊藿苷可通過抑制Smad2/3的磷酸化,從而調控上皮間質轉化相關因子α-SMA、vimentin和E-cadherin的表達,從而影響腎小管上皮細胞的增殖、遷移、侵襲和上皮間質轉化能力。由于腎纖維化形成的機制十分復雜,與多種細胞因子和信號通路相關,因此,淫羊藿苷對治療腎纖維化的效果和作用仍需進一步實驗驗證。

