假腸膜明串珠菌GX-3 產胞外多糖條件優化及其理化性質研究
唐華英,羅欣錦,張云野,楊睿睿,葉廣彬,王長麗
(右江民族醫學院基礎醫學院,廣西百色 533000)
0 引 言
乳酸菌(lactic acid bacteria, LAB)胞外多糖(expolysaccharides, EPS)是由乳酸菌在生長代謝過程中發酵產生并分泌到細胞外的黏液或莢膜多糖,是常滲入培養基中的一種糖類化合物[1]。根據合成位點和模式的不同,乳酸菌EPS 可以分為同型多糖和異型多糖[2]。
乳酸菌是公認安全的食品級微生物,EPS 作為乳酸菌重要的次生代謝產物,具有很高的研究和利用價值。與其他微生物多糖相比,乳酸菌EPS 不僅具有改善腸道微生態、抗腫瘤、免疫調節、降血糖等生物活性[3-5]。還具有良好的流變學特性,能改善發酵乳的風味、質地和性質,使產品增稠、乳化,質地細膩均勻,口感潤滑[6]。產EPS 的乳酸菌主要有乳桿菌屬、鏈球菌屬、乳球菌屬、明串珠菌屬及雙歧桿菌屬等[7]。不同乳酸菌菌株產生的EPS 量不同,其形成的多糖種類也有差別。培養條件、培養基成分及相關酶類都可以影響乳酸菌EPS 的產量[8]。因此,本研究以能夠產EPS 的一株乳酸菌為出發菌株,利用單因素試驗和正交試驗優化菌株產EPS 條件,并探究該EPS 的乳化性和黏度穩定性。本研究成果可以為乳酸菌EPS 食品添加劑的開發提供理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
假腸膜明串珠菌GX-3 分離自東北自然發酵酸菜樣品。
1.1.2 儀器與設備
LS-B50L 立式壓力蒸汽滅菌鍋,上海化縣醫療有限公司;DNP-9082 電熱恒溫培養箱,上海精宏實驗設備有限公司;HH-B11-420-S 恒溫培養振蕩器,上海躍進醫療器械廠;UVmini-1240 紫外可見分光光度計,島津國際貿易上海有限公司;TGL-16G 離心機,上海安亭科學儀器廠;FE20 pH 計,梅特勒-托利多(上海)有限公司;PL1501 電子分析天平,梅特勒-托利多公司;LVDV-C 旋轉數顯黏度計,美國Brookfield博勒飛公司。
1.1.3 培養基
MRS 培養基(w/v):葡萄糖2%、胰蛋白胨1%、牛肉膏1%,酵母提取物0.5%,K2HPO40.2%,無水乙酸鈉0.5%,檸檬酸銨0.2%,MgSO4·7H2O 0.058%,MnSO4·H2O 0.025%,吐溫80 1 mL,用于供試菌活化及種子液制備;產糖培養基:用蔗糖代替MRS 培養基中的葡萄糖。
1.2 方法
1.2.1 制備種子液
取50 μL 甘油管保存的菌液接種于30 mL MRS液體培養基中,30 ℃靜止培養12 h,為種子液。
1.2.2 EPS 的提取
將種子液以2%(體積比)的接種量接種于100 mL產糖培養基中,30 ℃靜止培養48 h 后,將發酵液在4 ℃4 000 g 條件下離心60 min,取上清[9]。上清液加入100 mL 10%(質量分數)三氯乙酸,4 ℃條件下攪拌4 h 后,4 ℃12 000 g 離心40 min 取出沉淀。收集上清液加入3 倍體積的預冷95%乙醇,4 ℃過夜沉淀后,4 ℃12 000 g 離心40 min 收集EPS 沉淀,并溶于20 mL 超純水中,裝入透析袋(截留分子量14 000 u)中,4 ℃透析2 d,每8 h 換一次水。
1.2.3 EPS 的測定
采用苯酚-硫酸法測定提取的EPS,以葡萄糖為標準制作標準曲線[10]。
1.2.4 單因素法優化產糖條件
通過單因素試驗,調整產糖培養基中的蔗糖濃度、胰蛋白胨濃度、牛肉膏濃度,酵母提取物濃度,K2HPO4濃度,無水乙酸鈉濃度,檸檬酸銨濃度、初始pH 值和培養溫度,考察這9 個因素對產糖的影響。
1.2.5 正交試驗法優化產糖條件
在單因素試驗的基礎上,選擇4 個對菌株產糖起顯著影響的因素,進行4 因素3 水平正交試驗,優化產糖發酵條件。
1.2.6 產糖發酵進程測定
將種子液以2%(體積比)的接種量分別接種于初始MRS 培養基和優化后的MRS 培養基中,30 ℃靜止培養60 h,每個6 h 取樣,測定EPS 含量。
1.2.7 EPS 乳化能力測定
分別取2.5 mL 汽油、柴油、煤油、棕櫚油、葵花油和大豆油與2.5 mL 50 mg/mL 的EPS 溶液振蕩混勻,于4 ℃條件下靜止放置12 h 后,利用游標卡尺測定乳化層的高度,計算乳化能力。
1.2.8 EPS 的黏度穩定性
取2.5 g EPS 溶于50 mL 去離子水或緩沖液(0.1 mol/L)中,選擇合適的轉子及轉速,利用旋轉數顯黏度計測定不同條件下EPS 的黏度。主要考察不同溫度(4、20、30、40 ℃)和不同pH 值(3、6、9)對EPS 溶液黏度的影響。
1.2.9 數據處理
每個試驗處理均設置3 個重復,數據以均值±標準差形式表示,統計檢驗的顯著水平設定為0.05,極顯著水平設定為0.01。利用JMP(Version 9.0.2,SAS,Inc)軟件進行方差分析及多重比較,并用Sigmaplot(Version 10.0,Systat Software,Inc)軟件繪圖。
2 結果與分析
2.1 單因素試驗分析
2.1.1 底物濃度對菌株發酵產EPS 的影響
當蔗糖濃度如圖1(a)為5%時,EPS 含量最高(19.17 ± 1.23 g/L)。研究表明,蔗糖不僅作為底物被乳酸菌利用產EPS,同時作為誘導劑提高葡聚糖蔗糖酶的活性,進而提高催化合成效率[11]。然而,高濃度的蔗糖并不能促進EPS 的產生,是因為EPS具有高黏度的特性,使得菌株表面被覆蓋,菌株活性降低,葡聚糖蔗糖酶不能有效的釋放至培養基中。因此,適宜濃度的蔗糖是菌株高產EPS 的重要前提。
當胰蛋白胨濃度如圖1(b)、牛肉膏濃度圖1(c)和酵母提取物圖1(d)濃度分別為1.2%、0.8%和0.6%時,EPS 的含量分別為20.56±1.38 g/L、21.79±1.02 g/L和25.17±2.04 g/L,其中酵母提取物可以顯著提高EPS 的含量。而Xing 等優化Leu. mesenteroides DRP105產EPS,發現,胰蛋白胨對菌株產EPS 影響顯著[12]。產生這樣的差異,可能是因為菌株來源和生長特性不同所致。
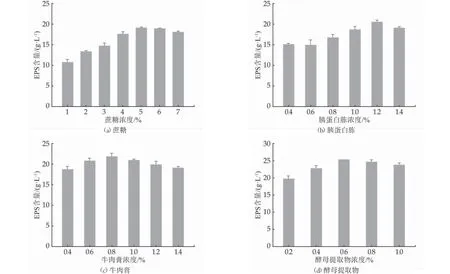
圖1 底物濃度對菌株發酵產EPS 的影響
2.1.2 無機鹽離子濃度對菌株發酵產EPS 的影響
當K2HPO4濃度圖2(a)、無水乙酸鈉濃度圖2(b)和檸檬酸銨濃度圖2(c)分別為0.25%、0.4%和0.25%時,EPS 的含量分別為26.54 ± 1.51 g/L、30.42 ± 2.71 g/L和32.72 ± 1.24 g/L,其中無水乙酸鈉可以顯著提高EPS 的產量。雖然這3 個因素在原始培養基中的含量不多,但不同的菌株對生長條件要求不同,使得發酵產EPS 的條件存在差異。

圖2 無機鹽離子濃度對菌株發酵產EPS 的影響
2.1.3 培養條件對菌株發酵產EPS 的影響
隨著pH 值圖3(a)的升高,EPS 的產量呈現先升高后降低的趨勢,在強酸性環境下EPS 的含量低于堿性環境,在pH 值為6 時,EPS 含量最高,為38.87 ±2.92 g/L。研究表明,葡聚糖蔗糖酶一般在中性或弱酸性的環境下活性較高,可以催化蔗糖生成EPS[13]。因此pH 值對菌株產EPS 具有重要的影響。
當溫度圖3(b)為30 ℃時,EPS 的含量最高,為40.27±1.26 g/L。一般而言,乳酸菌的最適生長溫度在30~37 ℃之間,較高的溫度會使菌株分泌的葡聚糖蔗糖酶失去活性,進而影響催化活性[14]。
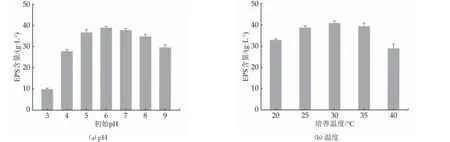
圖3 培養條件對菌株發酵產EPS 的影響
2.1.4 不同因素對菌株產EPS 影響的多重比較分析
培養基組分及發酵條件共9 個因素對EPS 產量的影響結果如表1 所示,通過優化,最終EPS 的產量達到40.27±1.26 g/L,是未優化前的3.02 倍。其中蔗糖濃度、酵母提取物濃度、無水乙酸鈉濃度以及初始pH值對EPS 的產量起到顯著影響,分別使EPS 產量提高了43.92%、15.51%、14.62%和18.80%。因此在后續的正交試驗中,選擇這4 個因素進行研究。

表1 不同因素對Leu. pseudomesenteroides GX-3 產EPS 影響的多重比較結果
2.2 正交試驗分析
本研究在確定最佳單因素條件的前提下,采取L9(34)4 因素3 水平正交試驗,考察蔗糖濃度(A)、酵母提取物濃度(B)、無水乙酸鈉濃度(C)和初始pH 值對菌株產EPS 的影響,試驗設計如表2 所示,結果如表3所示。
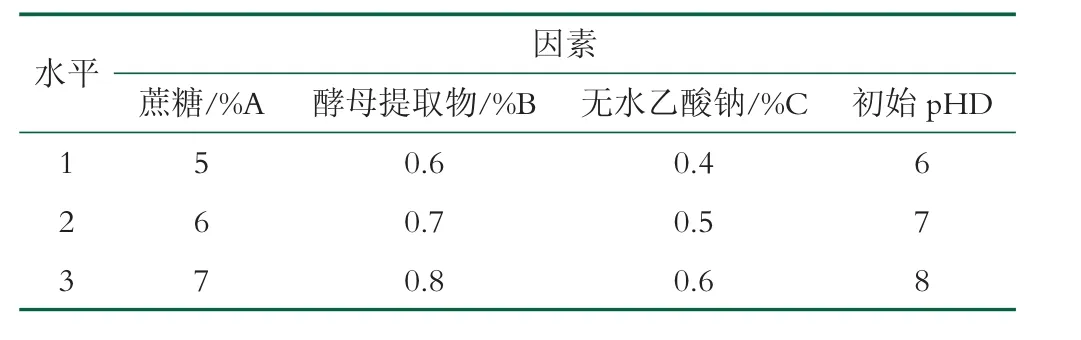
表2 L9(34)正交試驗因素水平設計
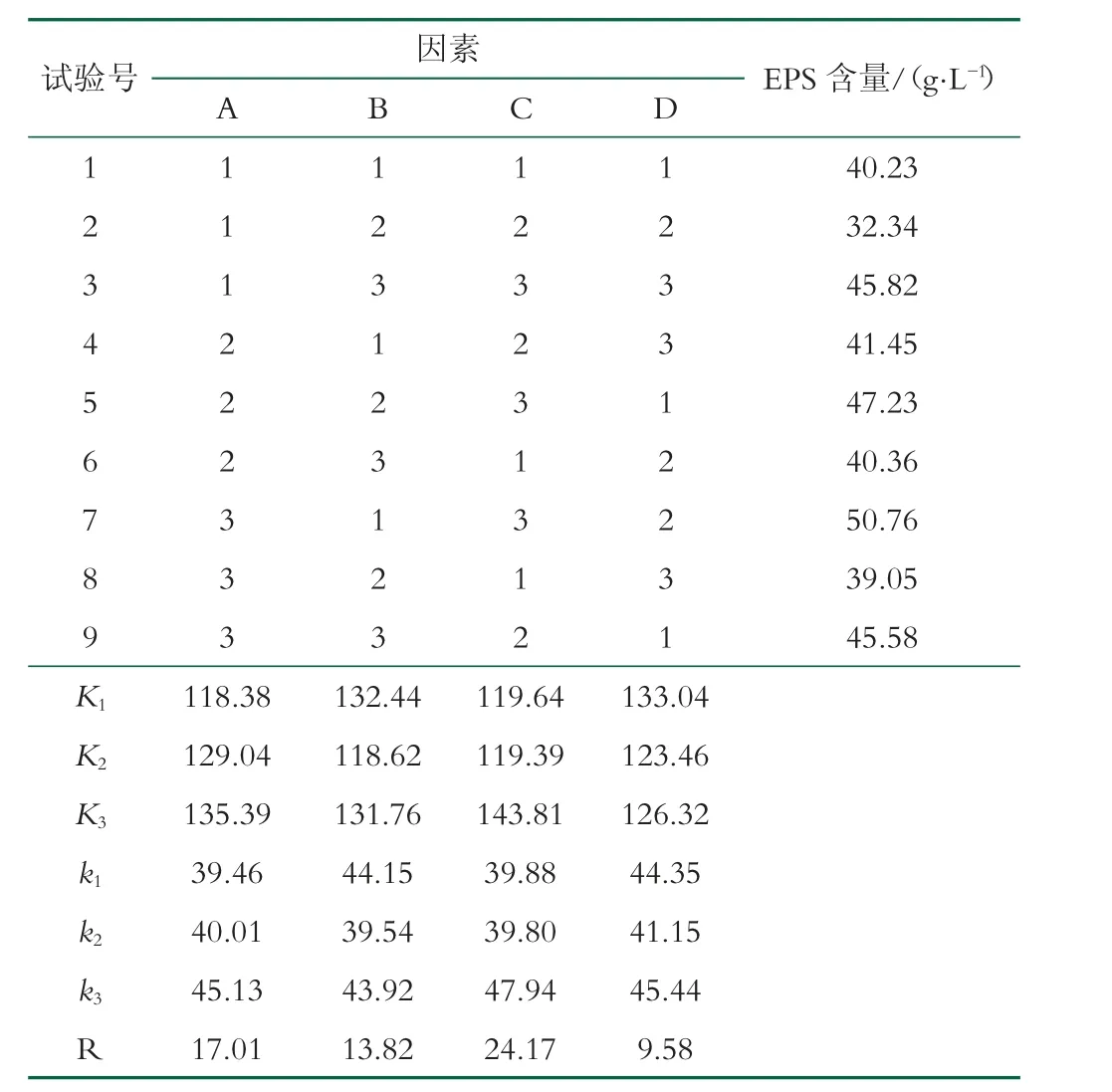
表3 正交試驗設計方案及結果分析
由極差分析可知,各因素對菌株產EPS 的影響大小順序依次為無水乙酸鈉濃度>蔗糖濃度>酵母提取物濃度>初始pH 值,獲得最佳培養條件為A3B1C3D2,即蔗糖濃度為7%、酵母提取物濃度為0.6%、無水乙酸鈉濃度為0.6%、初始pH 值為7 時,EPS 含量最高,為50.76 g/L,比優化前提高了3.81 倍。通過3 組平行驗證試驗,菌株產糖能力與正交試驗結果無顯著差異(P>0.05)。Du 等對Leu. mesenteroides TDS2-19 產EPS條件進行優化,結果同樣表明蔗糖、無水乙酸鈉和初始pH 值顯著影響菌株產EPS[15]。先前的研究中,我們利用響應面法優化Leu. citreumTD1 產EPS,優化后EPS 含量達到57.58 ± 2.04 g/L,是單因素試驗后(32.71 g/L)的1.76 倍[16],高于本研究結果。因此,在后續的研究中,我們進一步利用響應面優化GX-3 EPS產量。
2.3 菌株產EPS 發酵進程分析
菌株GX-3 在最適條件下的生長情況和產糖進程如圖4 所示,隨著發酵時間的進行,菌株的OD600值與EPS 產量正向耦合,呈現先急速增長后趨于穩定的趨勢。在發酵30 h 時,EPS 的含量最高,此時菌體生長進入穩定期。因此,在后續的EPS 提取工藝中,菌株培養至30 h 最適。
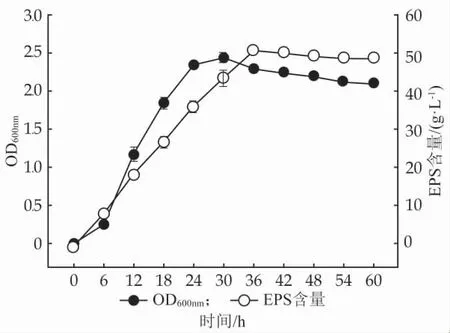
圖4 Leu. pseudomesenteroides GX-3 發酵體系中OD600 值及EPS 含量動態變化
2.4 GX-3 EPS 乳化性分析
GX-3 EPS 對油類和烴類化合物的乳化性能力如表4 所示,隨著時間增加,GX-3 EPS 的乳化作用增強,在24 h 時,乳化率從大到小分別為:大豆油>葵花油>柴油>柴油>棕櫚油>煤油>汽油,其中對大豆油和葵花油的乳化率均高于70%,分別為(79.35±1.67)%和(74.29±3.71)%。Meneghine 等研究Sphingomonas sp.EPS 的乳化性發現,該EPS 對汽油、煤油和食用油的乳化率達到70%以上[17]。
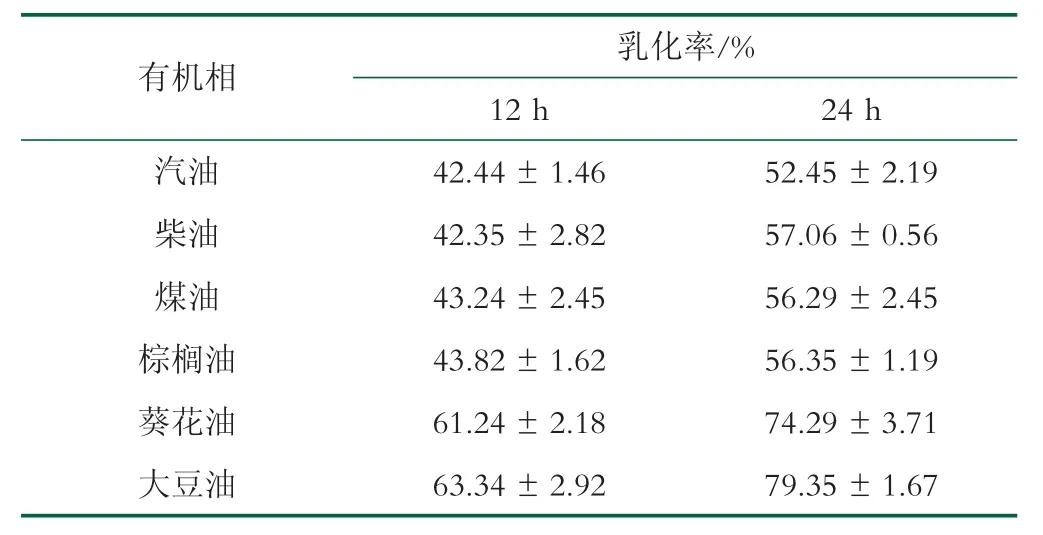
表4 GX-3 EPS 對有油類和烴類化合物的乳化能力
2.5 GX-3 EPS 黏度穩定性分析
EPS 的流變學特性顯著影響發酵食品的質地和口感,優質的乳制品往往與EPS 的黏度密切相關。溫度和pH 值對GX-3 EPS 黏度的影響如圖5 所示,該EPS 展現出剪切稀釋特性,隨著剪切的增加,黏度下降,是一種假塑性流體。GX-3 EPS 黏度隨著溫度的升高而下降,在中性環境下黏度較高,其次是堿性環境、酸性環境。此結果與Lactobacillus plantarum HM47 EPS的黏度特異性相一致[18]。因此可以看出,GX-3 EPS 黏度受環境的溫度和pH 值影響較大,可能是因為不同的環境使得EPS 的分子量和結構發生改變,從而應其物理性質[19]。此外,從上可知,GX-3 EPS 溶液具有非牛頓流體的特征。因此,可以通過改變環境條件來改善EPS 生物制品的特性。
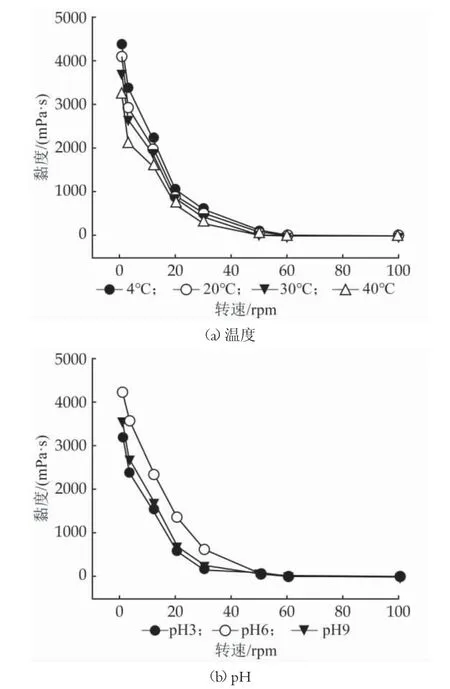
圖5 GX-3 EPS 黏度穩定性分析
3 結 論
乳酸菌產EPS 是一個復雜的過程,本研究通過單因素試驗篩選得到蔗糖濃度、酵母提取物濃度、無水乙酸鈉濃度以及初始pH 值對菌株GX-3 產EPS 起到顯著影響。正交試驗優化后,當蔗糖濃度為7%、酵母提取物濃度為0.6%、無水乙酸鈉濃度為0.6%、初始pH 值為7 時,EPS 含量最高,為50.76 g/L,比優化前提高了3.81 倍。此外,GX-3 EPS 展現出良好的乳化特性和黏度穩定性,具有開發成食品添加劑及增稠劑的潛質。

