干擾素α-1b聯合人免疫球蛋白對EB病毒感染患兒臨床療效及對Ficolin-3、SH2D1A表達的影響*
宋昆澤,李雅莉,牟 建
三二〇一醫院:1.兒科;2.微生物及免疫科,陜西漢中 723000
臨床上,兒童EB病毒(EBV)感染較為常見,多表現為咽峽炎、淋巴結腫大等,嚴重時可造成心、肝等器官損傷,危及生命。目前EBV感染患兒尚無特異性的治療方法,主要予以更昔洛韋、抗菌藥物及對癥支持治療等[1]。有研究表明,部分患兒在更昔洛韋治療中會出現骨髓抑制的現象,表現為白細胞及血小板減少等,導致患兒免疫力低下[2]。因此,提高EBV感染患兒治療療效,減少不良反應發生是臨床研究的重點。重組人干擾素α-1b聯合人免疫球蛋白能中和毒素,殺死細菌和病毒,其用于小兒毛細支氣管炎等疾病治療已取得一定成效,在治療EBV感染過程中能發揮免疫調節及抗病毒的雙重作用[3]。但是,重組人干擾素 α-1b聯合人免疫球蛋白用于治療EBV感染患兒的時間較短,且關于二者免疫調節的機制及療效判斷的指標報道較少。纖維膠凝蛋白3(Ficolin-3)是參與補體凝集素途徑中的重要蛋白,可識別細菌及病毒等多種微生物,在免疫反應中具有重要作用[4]。SH2結構域蛋白1A(SH2D1A)基因定位于Xq25,SH2D1A可與信號淋巴細胞激活分子結合,影響SH2結構域的信號轉導分子SHP-2的募集,參與調節免疫細胞的功能[5]。有研究表明,EBV感染患兒Ficolin-3、SH2D1A表達升高,二者表達情況與患兒病情嚴重程度有關[6-7]。因此,本研究分析重組人干擾素α-1b 聯合人免疫球蛋白治療對EBV感染患兒的臨床療效,以及對Ficolin-3、SH2D1A表達水平的影響。
1 資料與方法
1.1一般資料 選取2018年2月至2020年2月在本院就診的130例EBV感染患兒作為研究對象。收集患兒一般資料,記錄患兒住院期間臨床癥狀及體征的消退時間。納入標準:(1)參考《諸福棠實用兒科學》[8]中EBV感染診斷標準;(2)臨床表現和血清學抗體EBV-DNA、EBV-CA-IgM 及EBV-NA-IgG檢測結果提示EBV活動性感染。排除標準:(1)接受常規治療或人干擾素α-1b聯合人免疫球蛋白治療以外其他治療方案患兒;(2)伴嚴重神經及器官功能損害患兒;(3)存在藥物禁忌證或不愿意接受相關診治患兒。根據治療方式不同將入選患兒分為對照組和觀察組,各65例。觀察組和對照組性別、年齡和病程等比較,差異無統計學意義(P>0.05),見表1。本研究經本院醫學倫理委員會批準,患兒家屬簽署知情同意書。

表1 兩組一般資料比較
1.2儀器與試劑 熒光定量PCR(RT-qPCR)儀購自美國ABI公司,型號ABI7500。流式細胞儀購自美國貝克曼公司,型號CytoFLEX。人Ficolin-3 酶聯免疫吸附試驗(ELISA)試劑盒購自泉州睿信生物公司(貨號:RX2918),白細胞介素(IL)-6、IL-8、腫瘤壞死因子(TNF)-α ELISA試劑盒購自江萊生物公司(貨號:JL14113、JL13943、JL13317),Ficoll淋巴分離液購自美國SIGMA公司(貨號:26873-85-8)。RNA快速提取試劑盒購自新海基因公司(貨號:B0132),引物序列由華大基因公司合成。
1.3方法 對照組給予常規治療,包括營養支持、補液糾正水電解質及酸堿失衡、抗感染治療等對癥支持治療,以及阿昔洛韋(陜西博森生物制藥有限公司,國藥準字H20052277)靜脈滴注治療,給藥劑量為5 mg/kg,12 h 1次,治療1周。觀察組在常規治療基礎上給予人干擾素α-1b聯合人免疫球蛋白治療,人干擾素α-1b 注射液(北京三元基因藥業公司,國藥準字S20010006)給藥方式為肌內注射,給藥劑量為5 μg/kg,每天1次,持續給藥1周,人免疫球蛋白(華蘭生物工程有限公司,國藥準字10970032)給藥方式為靜脈滴注,給藥劑量為400 mg/kg,治療5 d。兩組患兒均治療5~7 d,7 d后評估療效。
1.4觀察指標
1.4.1ELISA檢測血清Ficolin-3、SH2D1A表達 取各組治療前及治療后清晨空腹靜脈血。ELISA檢測血清Ficolin-3表達。采用RT-qPCR檢測外周血單個核細胞SH2D1A表達。采用密度梯度離心法分離患兒治療前后外周血單個核細胞,RNA提取試劑盒提取總RNA。將RNA逆轉錄為cDNA后進行PCR反應。SH2D1A上游引物為5′-AGGCGTGTACTGCCTATGTG-3′,下游引物為5′-TGCAGAGGTATTACAATGCCTTG-3′;GAPDH上游引物為5′-GCACCCACATGGCACGAATTTT-3′,下游引物為5′-GGCTGTTGTCATACTTCTCATGG-3′。按照說明書配制反應體系,反應條件:95 ℃ 預變性5 min,95 ℃ 變性20 s,60 ℃ 退火20 s,70 ℃延伸30 s,共40個循環。Ficolin-3、SH2D1A表達結果以相對定量法2-ΔΔCt表示。
1.4.2免疫分子及免疫細胞檢測 采用ELISA雙抗體夾心法檢測血清IL-6、IL-8、TNF-α水平,采用流式細胞術檢測外周血CD3+、CD4+、CD8+和CD4+/CD8+。采用RT-qPCR檢測治療前后兩組EBV-DNA、EBV-CA-IgM及EBV-NA-IgG,并計算轉陰率。
1.4.3療效評估及并發癥發生情況 療效評估[3]:根據患兒治療后癥狀、體征和實驗室檢測指標進行療效評估,患兒的癥狀、體征加重,實驗室指標惡化時判斷為治療無效;當患兒EBV感染的臨床癥狀和臨床體征完全消失,并且EBV感染相關的實驗室檢測指標正常時判斷為顯效;癥狀、體征較治療前改善,實驗室檢測指標好轉但未達到正常時判斷為有效。總有效率=(顯效例數+有效例數)/總例數×100%。并發癥:觀察患兒治療過程中有無心肌酶異常、肝功能異常及胸腔積液等并發癥發生情況。
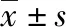
2 結 果
2.1兩組治療后癥狀及體征比較 治療后,觀察組發熱、咳嗽、頸淋巴結腫大、咽痛、扁桃體腫大和肝脾腫大各臨床癥狀及體征的消失或消退時間均短于對照組,差異有統計學意義(P<0.05)。見表2。
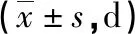
表2 兩組癥狀及體征消失或消退時間比較
2.2兩組治療后病毒轉陰率比較 治療后,觀察組EBV-DNA轉陰率、EBV-CA-IgM 轉陰率均明顯高于對照組,差異有統計學意義(P<0.05);兩組EBV-NA-IgG轉陰率比較,差異無統計學意義(P>0.05)。見表3。
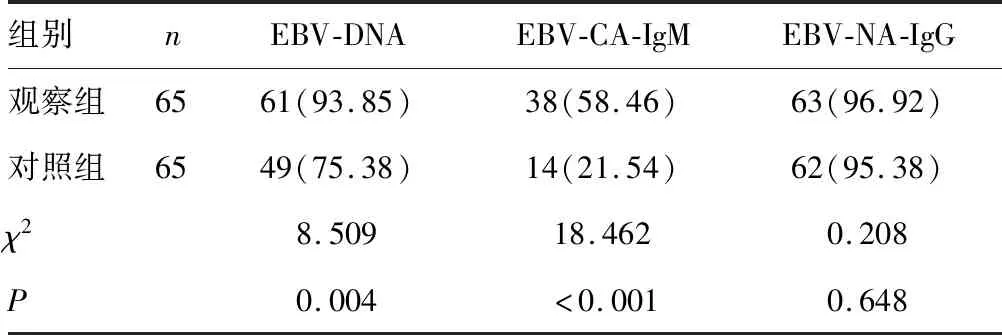
表3 兩組病毒轉陰率比較[n(%)]
2.3兩組治療前后免疫指標比較 兩組治療后Ficolin-3、SH2D1A、IL-6、IL-8、TNF-α、CD8+均較治療前明顯降低,觀察組上述指標較對照組降低更為明顯,差異均有統計學意義(P<0.05);兩組治療后CD3+、CD4+和CD4+/CD8+均明顯高于治療前,觀察組上述指標較對照組升高更為明顯,差異均有統計學意義(P<0.05)。見表4。
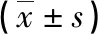
表4 兩組治療前后免疫分子水平比較
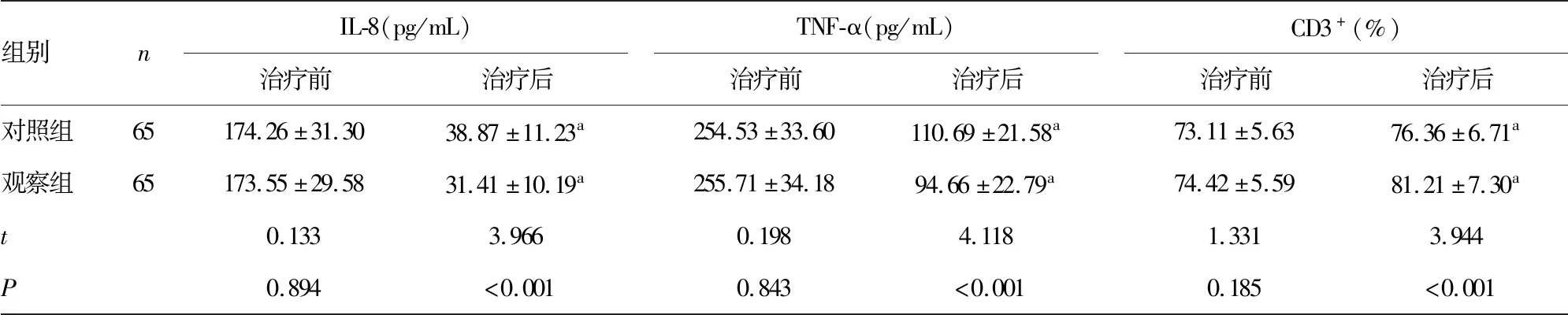
組別nIL-8(pg/mL)治療前治療后TNF-α(pg/mL)治療前治療后CD3+(%)治療前治療后對照組65174.26±31.3038.87±11.23a254.53±33.60110.69±21.58a73.11±5.6376.36±6.71a觀察組65173.55±29.5831.41±10.19a255.71±34.1894.66±22.79a74.42±5.5981.21±7.30at0.1333.9660.1984.1181.3313.944P0.894<0.0010.843<0.0010.185<0.001
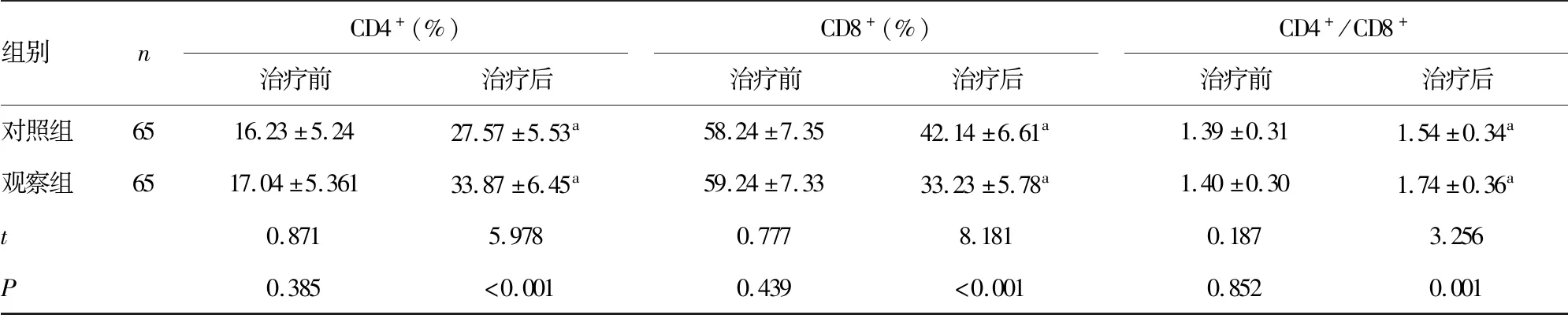
組別nCD4+(%)治療前治療后CD8+(%)治療前治療后CD4+/CD8+治療前治療后對照組6516.23±5.2427.57±5.53a58.24±7.3542.14±6.61a1.39±0.311.54±0.34a觀察組6517.04±5.36133.87±6.45a59.24±7.3333.23±5.78a1.40±0.301.74±0.36at0.8715.9780.7778.1810.1873.256P0.385<0.0010.439<0.0010.8520.001
2.4治療前Ficolin-3、SH2D1A表達與各項免疫指標的相關性 相關性分析顯示,治療前Ficolin-3表達與IL-6、IL-8、TNF-α及CD8+呈正相關,與CD3+、CD4+及CD4+/CD8+呈負相關;SH2D1A表達與IL-6、IL-8及TNF-α水平呈正相關,與CD3+、CD4+及CD4+/CD8+呈負相關。見表5。
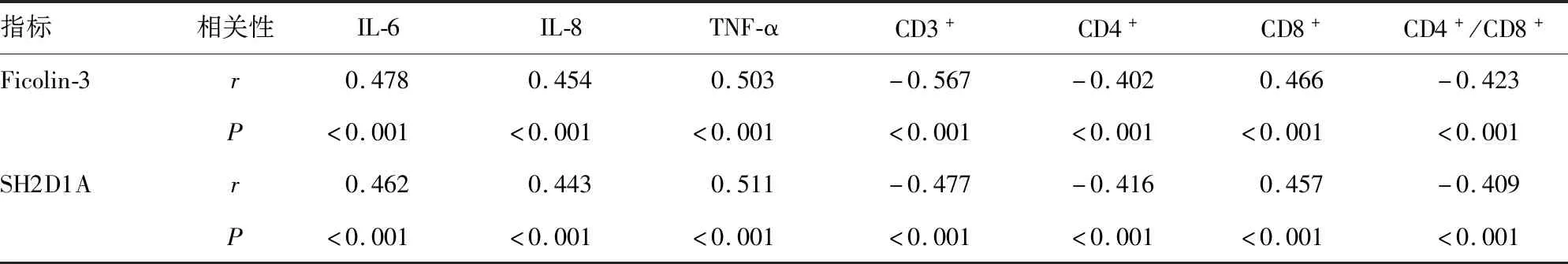
表5 治療前血清Ficolin-3、SH2D1A表達與免疫指標的相關性
2.5兩組臨床療效及并發癥發生情況比較 觀察組顯效、有效和無效分別為36例、27例和2例,對照組分別為30例、22例和13例。觀察組治療總有效率[96.92%(63/65)]明顯高于對照組[80.00%(52/65)],差異有統計學意義(χ2=9.119,P=0.003)。觀察組發生心肌酶異常3例,肝功能異常2例,胸腔積液1例;對照組心肌酶異常7例,肝功能異常10例,肺不張1例,胸腔積液2例;觀察組并發癥總發生率[9.23%(6/65)]明顯低于對照組[30.77%(20/65)],差異有統計學意義(χ2=9.423,P=0.002)。
3 討 論
人體在感染EBV后,B淋巴細胞首先受累,受累的B細胞抗原性的異常改變會誘導CD4+T細胞的增殖活化,抑制被EBV感染的B細胞的增殖,調節局部的炎性反應,但同時CD4+T細胞也被消耗而減少[9]。此外,大量EBV抗原的刺激使CD8+T細胞過度增殖活化,CD8+T細胞的細胞毒作用不僅殺傷EBV感染的B細胞,還侵犯心、肝及腎等多個器官,導致重要臟器發生組織病理學改變。T淋巴細胞活化會促進單核-巨噬細胞分泌促炎性細胞因子,如IL-6、IL-8及TNF-α等,造成組織器官的炎性損傷[10]。Ficolin-3是補體凝集素途徑中的起始因子,結合病原體后參與補體激活,在宿主防御感染中起關鍵作用,在EBV感染的急性炎癥期間表達明顯升高[8,11]。SH2D1A是近年來發現的能夠調節免疫細胞功能的重要因子,廣泛存在于T和B淋巴細胞等免疫細胞中,當免疫細胞活化后SH2D1A表達明顯上調,進而調節周圍免疫細胞的功能。有學者報道,SH2D1A在兒童EBV感染時表達明顯升高,并導致患兒細胞免疫功能紊亂[7]。
目前,EBV感染患兒的治療原則主要是對癥治療,疾病急性期主要注意休息,輔以抗病毒治療,合并細菌感染的患兒予以抗菌藥物治療,但臨床療效有限。干擾素α-1b是一種低相對分子質量的蛋白質,在人體中主要由單核細胞及淋巴細胞分泌產生,不僅參與調節機體的正常免疫功能的調節,在抗病毒方面也具有明顯的治療效果[12]。干擾素α-1b能夠誘導細胞產生抗病毒蛋白,促進病毒mRNA降解,并抑制病毒蛋白的轉錄、翻譯和復制過程,從而提高抗病毒治療效果[13]。人免疫球蛋白在臨床上常用于細菌或病毒感染性疾病,其能提高機體的體液免疫,減輕過度的炎性反應,在機體免疫監視、免疫防護、免疫自穩等過程中發揮重要的功能[14]。本研究中,與對照組比較,采用干擾素α-1b 聯合人免疫球蛋白治療的觀察組總有效率明顯高于對照組,且患兒臨床癥狀消失或消退時間短、病毒轉陰率高、并發癥總發生率較低,差異均有統計學意義(P<0.05)。分析其原因:一方面,人免疫球蛋白能夠抑制抗原、抗體復合物的形成,降低器官組織的炎性反應,改善EBV感染患兒的臨床癥狀[15];另一方面,觀察組患兒治療后自身免疫功能有所提高。EBV感染的發病機制復雜,機體免疫功能紊亂是導致炎性反應進行性加重及疾病發生、發展的重要原因。CD3+T淋巴細胞是機體介導細胞免疫功能的主要成分,包括CD4+T淋巴細胞亞群和CD8+T淋巴細胞亞群。正常情況下,CD4+和CD8+的數量和功能處于動態平衡,維持機體正常的免疫應答;在病理情況下,細胞免疫功能紊亂,表現為CD4+T淋巴細胞功能抑制,CD8+T淋巴細胞功能激活。CD4+/CD8+是評價機體細胞免疫功能的重要指標,也可作為反映EBV感染患兒病情輕重的客觀指標。本研究中,觀察組治療后IL-6、IL-8、TNF-α及CD8+降低,CD3+、CD4+及CD4+/CD8+升高,表明干擾素α-1b 聯合人免疫球蛋白能夠提高患兒的細胞免疫功能,促進患兒疾病恢復。楊婷等[16]研究表明,干擾素α-1b 聯合人免疫球蛋白治療能夠通過誘導細胞凋亡等多種機制抑制效應性T細胞,改善對腺病毒性重癥患兒的細胞免疫及體液免疫狀態,提高臨床治療的療效,與本研究結果一致。IL-6、IL-8、TNF-α是機體重要的促炎因子,一定程度上能夠反映機體炎性反應及組織損傷嚴重程度。本研究結果發現,干擾素α-1b 聯合人免疫球蛋白能夠明顯降低IL-6、IL-8、TNF-α水平,從而減輕炎性反應,與其他文獻報道一致[3]。
本研結果發現,與對照組比較,觀察組在接受干擾素α-1b 聯合人免疫球蛋白治療后Ficolin-3、SH2D1A表達明顯降低(P<0.05),表明Ficolin-3、SH2D1A是反映干擾素α-1b 聯合人免疫球蛋白治療效果的潛在指標。分析其原因:干擾素α-1b 聯合人免疫球蛋白治療可能通過抑制補體凝集素途徑的過度激活,抑制T、B細胞的過度活化,恢復患兒機體正常免疫功能,改善EBV感染患兒的臨床治療效果[17]。有研究亦證實,干擾素能夠通過抑制適應性抗病毒免疫反應,抑制補體凝集素通路的過度激活,發揮治療作用[18]。本研究中相關性分析發現,Ficolin-3、SH2D1A與IL-6、IL-8、TNF-α及CD8+呈正相關,與CD3+、CD4+及CD4+/CD8+呈負相關,提示Ficolin-3、SH2D1A表達水平有助于反映EBV感染患兒機體免疫功能狀態,是新的免疫相關分子標志物。
綜上所述,對EBV感染患兒應用干擾素α-1b聯合人免疫球蛋白進行治療能夠縮短患兒癥狀持續時間,降低Ficolin-3、SH2D1A的表達,改善患兒免疫功能,提高治療有效性,值得臨床關注。

