苦豆子根、莖、葉浸提液對4種牧草種子萌發的化感作用
石國慶, 隋曉青*, 楊 靜, 劉 毅, 崔國盈, 張 博
(1.新疆農業大學草業學院, 西部干旱荒漠區草地資源與生態教育部重點實驗室, 新疆草地資源與生態重點實驗室,新疆 烏魯木齊 830052; 2.烏魯木齊市林業和草原局, 新疆 烏魯木齊 830000)
競爭在自然界中普遍存在,而化感作用(Allelopathy)就是某些植物在有限的資源和空間中競爭所產生適應性進化的結果[1-2]。化感物質(Allelochemical)通常是活體植物自身產生的某些化學物質,一般由植物的組織或器官合成,該化學物質能夠通過地下部根系分泌,地上部雨霧淋溶、揮發或殘茬分解莖葉等多種途徑釋放到自然界,以此促進或抑制其他植物的正常生長發育[3-6],例如舟葉橐吾(Ligulariacymbulifera)地上部和根部的水浸提液抑制白三葉(Trifoliumrepens)、多年生黑麥草(Loliumperenne)、鴨茅(Dactylisglomerata)種子萌發和幼苗生長[7];燕麥(Avenasativa)不同濃度的莖葉、根系浸提液抑制野生垂穗披堿草(Elymusnutans)種子萌發和幼苗生長[8]。我國對于植物化感作用研究起步晚,20世紀80年代有零星報道,從90年代開始,化感研究開始迅速崛起[9]。
苦豆子(Sophoraalopecuroides)為豆科中旱生、多年生草本植物,根莖生長發達,繁殖能力強,體內含有生物堿等化學成分[10-11]。由于我國草地的過度利用,導致天然草地的嚴重退化,出現了草地毒害草化,苦豆子、醉馬芨芨草(Achnatheruminebrians)等毒害草蔓延過度,使得苦豆子在我國西北地區部分草地形成了優勢種群[12-13]。從草地畜牧業的角度來看,苦豆子的繁殖入侵造成牧草產量降低,家畜因饑餓被迫采食而引起中毒、腹瀉等癥狀時有發生,這也給草地畜牧業造成一定的經濟損失[14-15]。研究表明苦豆子具有一定化感作用[16-18],在經濟作物黃瓜(Cucumissativus)、西瓜(Citrulluslanatus)、甜瓜(Cucumismelo)、西葫蘆(Cucurbitapepo)、向日葵(Helianthusannuus)等已得到了驗證[17,19],但關于苦豆子對牧草種子萌發的化感作用研究還鮮有報道。
種子的發芽是植物生長發育的開始,苦豆子與優良牧草能否共生主要取決于牧草的種子是否能定殖下來。若在幼苗生長發育過程中受到其他植物的抑制或促進作用,將會影響種子萌發或幼苗生長[20]。根據化感物質不同的釋放途徑,可采用浸提法、水蒸氣蒸餾法、培養-吸附法等方法來收集化感物質進行研究[21]。因此,本實驗通過模擬自然界的環境下化感物質進到泥土的方式,提取出苦豆子不同部位浸提液對4種優良草種:紫花苜蓿(Medicagosativa)、紅豆草(Onobrychisviciifolia)、無芒雀麥(Bromusinermis)和老芒麥(Elymussibiricus)進行牧草種子萌發的化感實驗,明確苦豆子不同部位浸提液對牧草種子萌發存在的不同化感作用影響程度,以期為今后草地建植與修復、苦豆子防控及利用提供一定的理論和實踐依據。
1 材料與方法
1.1 試驗材料
本試驗供體植物苦豆子取自新疆農業大學三坪草業綜合試驗站,受體植物為2種豆科牧草種子和2種禾本科牧草種子:‘新牧4號’紫花苜蓿(MedicagosativaL.‘XinMu No.4’)、紅豆草、老芒麥,取自新疆農業大學三坪草業綜合試驗站,‘烏蘇1號’無芒雀麥(Bromusinermis‘Wusu No.1’),取自新疆烏蘇市草原站林草局,種子凈度均為95%以上。
1.2 苦豆子浸提液的制備
新鮮苦豆子去雜,蒸餾水洗凈,存放于陰涼干燥處自然晾干。樣品分成根、莖、葉三部分,剪成約1 cm小段粉碎,稱取100 g放于燒杯中,加1 000 mL的蒸餾水,室溫浸泡48 h,浸提液采用雙層紗布過濾取得粗提液后用定性濾紙進行二次過濾,制成0.1 g·mL-1的苦豆子浸提液母液,將母液用蒸餾水分別稀釋到0.005 g·mL-1,0.025 g·mL-1,0.045 g·mL-1和0.065 g·mL-1的4個濃度的苦豆子根、莖、葉浸提液,貯存于4℃冰箱備用[18]。
1.3 發芽實驗
用培養皿雙層濾紙床法,培養皿底部直徑120 mm,取健康勻稱飽滿、滅菌的4種供試種子,根據種子大小每皿50粒或者100粒,分別均勻播種至酒精殺菌的雙層濾紙培養皿中,分別滴加0.005 g·mL-1,0.025 g·mL-1,0.045 g·mL-1,0.065 g·mL-1苦豆子根、莖、葉浸提液,對照組加蒸餾水,每個處理4次重復,置于光照培養箱培養。
1.4 指標測定方法
為保證濃度一致,定時更換濾紙并分別注入等量苦豆子根、莖、葉浸提液,對照組加入等量蒸餾水。每日以胚芽突破種皮1~2 mm為標準記錄其發芽種子數[22],直至各草種發芽結束,發芽結束后統計各類種子的根長、芽長。各草種發芽周期根據《國家草種子檢驗規程》(GB/T2930.4-2017)進行實驗和記錄,其中紫花苜蓿發芽初期為第4 d、發芽終期為第10 d,紅豆草發芽初期為第4 d、發芽終期為第14 d,無芒雀麥發芽初期為第7 d、發芽終期為第14 d,老芒麥發芽初期為第5 d、發芽終期為第12 d。根長、芽長的測量方法為隨機取出10株幼苗,用游標卡尺測定并記錄。
1.5 化感效應評價指標
發芽勢(Germination potential,GP):GP(%)=(發芽初期發芽種子粒數∕供試種子總粒數)×100。
發芽率(germination rate,GR):GR(%)=(發芽終期發芽種子粒數∕供試種子總粒數)×100。
發芽指數(Germination index,GI):GI=∑(Gt/Dt);式中,Gt表示在t時間內的發芽數目,Dt為相應的發芽天數。
化感效應指數(Allelopathic response index,RI):RI=1-C/T (T≥C)或RI=T/C-1(T
化感綜合效應指數(Synthetic effects of allelopathic index,SE)反應化感效應的強弱,用供體對同一受體發芽率、發芽勢、發芽指數等測試項目RI的算術平均值進行評價,SE<0時抑制作用,SE>0時促進作用。SE絕對值大小表示化感效應作用強度。
1.6 數據分析
數據采用SPSS 21.0進行單因素方差分析和Duncan法進行多重比較,Excel 2019進行表格制作。
2 結果與分析
2.1 苦豆子浸提液對4種牧草種子發芽勢的影響
苦豆子不同部位、不同濃度的浸提液對4種牧草種子發芽勢產生抑制作用,差異顯著(P<0.05);其中,紅豆草、無芒雀麥、老芒麥的發芽勢僅在苦豆子根浸提液0.005 g·mL-1作用下高于CK(表1)。苦豆子根、莖浸提液處理對無芒雀麥和老芒麥的發芽勢抑制程度大于紫花苜蓿和紅豆草的發芽勢,且在0.065 g·mL-1處理時4種草種的發芽勢達到最低值。苦豆子葉浸提液處理對紫花苜蓿和老芒麥的發芽勢抑制程度大于無芒雀麥和紅豆草的發芽勢,老芒麥的發芽勢在0.025 g·mL-1處理時為最低值,紫花苜蓿的發芽勢在0.045 g·mL-1處理時為最低值,無芒雀麥和紅豆草的發芽勢在0.065 g·mL-1處理時為最低值。紫花苜蓿、紅豆草、無芒雀麥和老芒麥的發芽勢與CK相比,在苦豆子根浸提液0.065 g·mL-1處理時分別降低了39.68%,34.69%,93.44%和100%;在苦豆子莖浸提液0.065 g·mL-1處理時分別降低了79.89%,77.55%,89.34%和100%;在苦豆子葉浸提液0.065 g·mL-1處理時均為0。

表1 苦豆子根、莖、葉浸提液對4種牧草種子發芽勢的影響Table 1 Effect of extracts from roots,stems and leaves of Sophora alopecuroides on seed germination potential of four forages
2.2 苦豆子浸提液對4種牧草種子發芽率的影響
隨著苦豆子根、莖、葉浸提液濃度的增加,4種牧草種子的發芽率均呈降低趨勢(P<0.05)(表2)。苦豆子根、莖浸提液處理對無芒雀麥和老芒麥的發芽率抑制程度總體大于紫花苜蓿和紅豆草的發芽率,在0.065 g·mL-1處理時4種草種的發芽率達到最低值。苦豆子葉浸提液處理對紫花苜蓿和老芒麥的發芽率抑制程度大于無芒雀麥和紅豆草的發芽率,紫花苜蓿和老芒麥的發芽率在0.045 g·mL-1處理時為最低值,無芒雀麥和紅豆草的發芽率在0.065 g·mL-1處理時為最低值。紫花苜蓿、紅豆草、無芒雀麥和老芒麥的發芽率與CK相比,在苦豆子根浸提液0.065 g·mL-1處理時分別降低了37.70%,25.99%,79.76%和61.45%;在苦豆子莖浸提液0.065 g·mL-1處理時分別降低了62.30%,76.38%,72.02%和100%;在苦豆子葉浸提液0.065 g·mL-1處理時均為0。苦豆子根、莖、葉浸提液對4種牧草種子的發芽率抑制情況總體表現為葉的抑制強度大于根和莖。
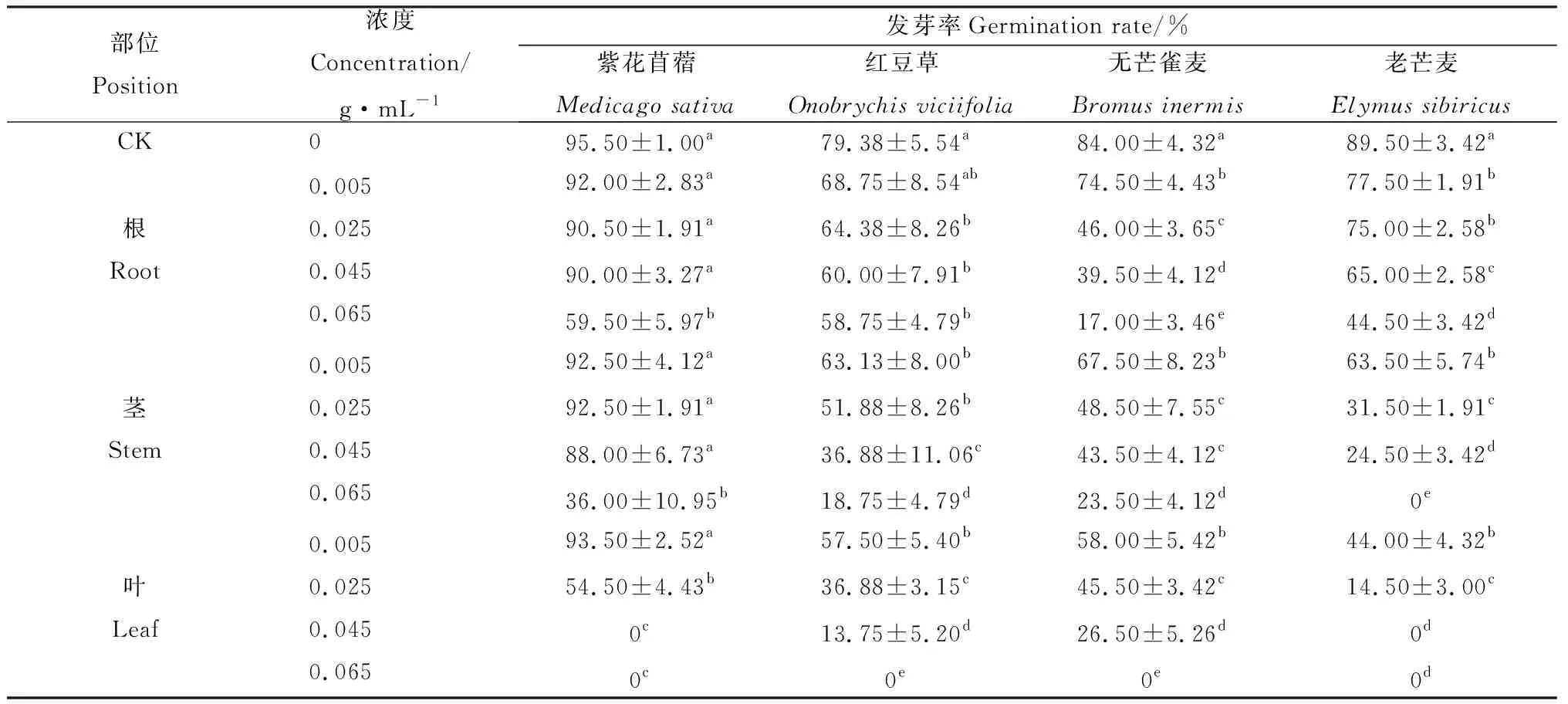
表2 苦豆子根、莖、葉浸提液對4種牧草種子發芽率的影響Table 2 Effect of extracts from roots,stems and leaves of Sophora alopecuroides on seed germination rate of four forages
2.3 苦豆子浸提液對4種牧草種子發芽指數的影響
苦豆子不同部位、不同濃度的浸提液對4種牧草種子發芽指數產生抑制作用,具有顯著差異(P<0.05)(表3)。苦豆子根、莖浸提液處理對無芒雀麥和老芒麥的發芽指數抑制程度大于紫花苜蓿和紅豆草的發芽指數,且在0.065 g·mL-1處理時4種草種的發芽指數達到最低值。苦豆子葉浸提液處理對紫花苜蓿和老芒麥的發芽指數抑制程度大于無芒雀麥和紅豆草的發芽指數,紫花苜蓿和老芒麥的發芽指數在0.045 g·mL-1處理時最低,無芒雀麥和紅豆草的發芽指數在0.065 g·mL-1處理時最低。紫花苜蓿、紅豆草、無芒雀麥和老芒麥的發芽指數與CK相比,在苦豆子根浸提液0.065 g·mL-1處理時分別降低了67.08%,30.19%,88.05%和68.00%;在苦豆子莖浸提液0.065 g·mL-1處理時分別降低了85.79%,75.38%,82.80%和100%;在苦豆子葉浸提液0.065 g·mL-1處理時均為0。
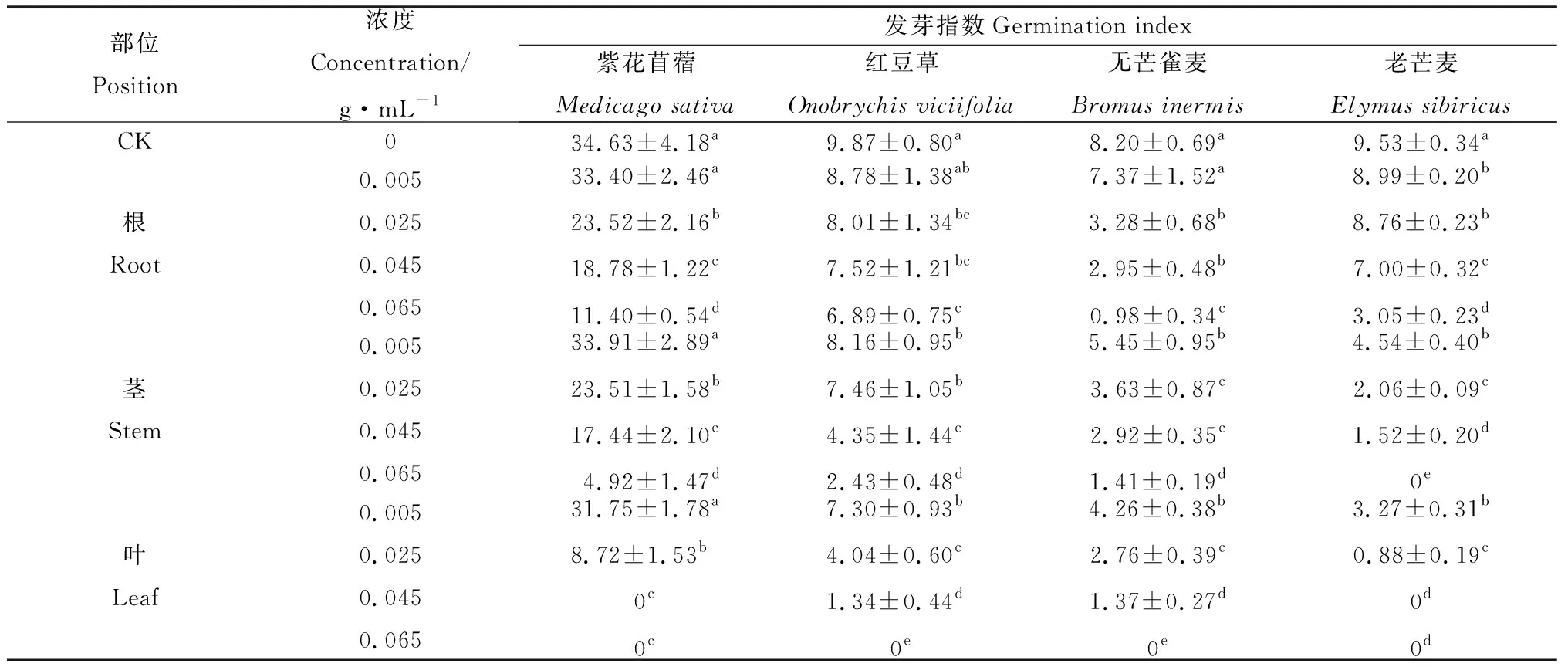
表3 苦豆子根、莖、葉浸提液對4種牧草種子發芽指數的影響Table 3 Effect of extracts from roots,stems and leaves of Sophora alopecuroides on seed germination index of four forages
2.4 苦豆子浸提液對4種牧草種子根長、芽長的影響
隨著苦豆子根、莖、葉浸提液濃度的增加,對4種牧草種子的根長、芽長整體表現降低趨勢(表4)。紫花苜蓿根長與CK相比,在苦豆子根、莖浸提液大于0.025 g·mL-1、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05),苦豆子根、莖浸提液0.065 g·mL-1為最低值,分別降低了52.97%,85.16%;紅豆草根長與CK相比,在苦豆子根、莖、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05),苦豆子根、莖浸提液0.065 g·mL-1為最低值,分別降低了62.16%,83.88%;無芒雀麥根長與CK相比,在苦豆子根浸提液大于0.045 g·mL-1,莖浸提液大于0.005 g·mL-1、葉浸提液大于0.025 g·mL-1處理時差異顯著(P<0.05),苦豆子根、莖浸提液0.065 g·mL-1為最低值,分別降低了28.03%,70.79%;老芒麥根長與CK相比,在苦豆子根浸提液大于0.025 g·mL-1,莖、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05),苦豆子根浸提液0.065 g·mL-1為最低值,降低78.42%。
紫花苜蓿芽長與CK相比,在苦豆子根浸提液大于0.065 g·mL-1,莖、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05)(表4),苦豆子根、莖浸提液0.065 g·mL-1為最低值,分別降低了18.69%,70.33%;紅豆草芽長與CK相比,在苦豆子根、莖、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05),苦豆子根、莖浸提液0.065 g·mL-1為最低值,分別降低了67.31%,86.56%;無芒雀麥芽長與CK相比,在苦豆子根浸提液大于0.025 g·mL-1,莖、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05),苦豆子根、莖浸提液0.065 g·mL-1為最低值,分別降低了38.05%,59.79%;老芒麥芽長與CK相比,在苦豆子根浸提液大于0.025 g·mL-1,莖、葉浸提液大于0.005 g·mL-1處理時差異顯著(P<0.05),苦豆子根浸提液0.065 g·mL-1為最低值,降低81.69%。老芒麥根長、芽長在莖浸提液0.065 g·mL-1、葉浸提液0.025 g·mL-1時為0。4種牧草種子的根長、芽長在苦豆子葉浸提液0.065 g·mL-1下均為0。苦豆子根、莖浸提液處理對無芒雀麥和老芒麥的根長、芽長抑制程度大于紫花苜蓿和紅豆草的根長、芽長。

表4 苦豆子根、莖、葉浸提液對4種牧草種子根長、芽長的影響Table 4 Effects of extracts from roots,stems and leaves of Sophora alopecuroides on seed root length、bud length of four forages
2.5 苦豆子浸提液對4種牧草種子化感效應的影響
由表5可知,在苦豆子根浸提液0.005 g·mL-1下紅豆草、無芒雀麥、老芒麥發芽勢的化感指數大于0,在苦豆子其余部位浸提液的濃度作用下發芽勢、發芽率和發芽指數的化感指數小于0,且化感指數的絕對值隨著浸提液濃度升高而增大,表明發芽初期在苦豆子根浸提液0.005 g·mL-1下表現低濃度促進高濃度抑制;苦豆子根、莖、葉浸提液對4種牧草種子的抑制作用也逐漸增強。
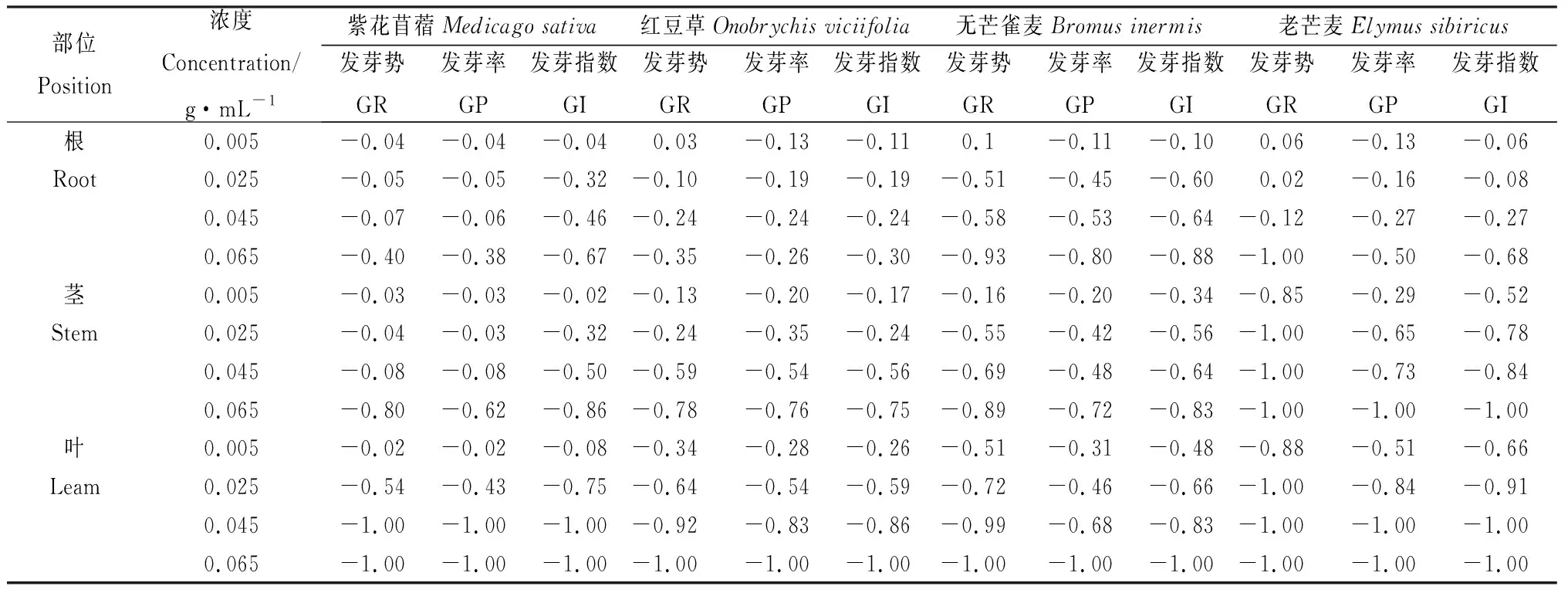
表5 苦豆子根、莖、葉浸提液對4種牧草種子化感效應指數Table 5 Allelopathy index of extracts from roots,stems and leaves of Sophora alopecuroides to four forage seeds
由表6可知,苦豆子根、莖、葉浸提液對4種牧草種子均存在較強的化感抑制作用,隨著的苦豆子浸提液濃度增加,其化感抑制效果逐漸加強。4種牧草種子中,無芒雀麥、老芒麥相比紅豆草、紫花苜蓿更易受苦豆子浸提液的影響,其中苦豆子根浸提液對4種牧草種子的抑制作用強弱順序為無芒雀麥>老芒麥>紫花苜蓿>紅豆草;苦豆子莖、葉浸提液對4種牧草種子的抑制作用強弱順序為老芒麥>無芒雀麥>紅豆草>紫花苜蓿。通過化感綜合效應指數來看,苦豆子化感作用的強弱與作用濃度有關。
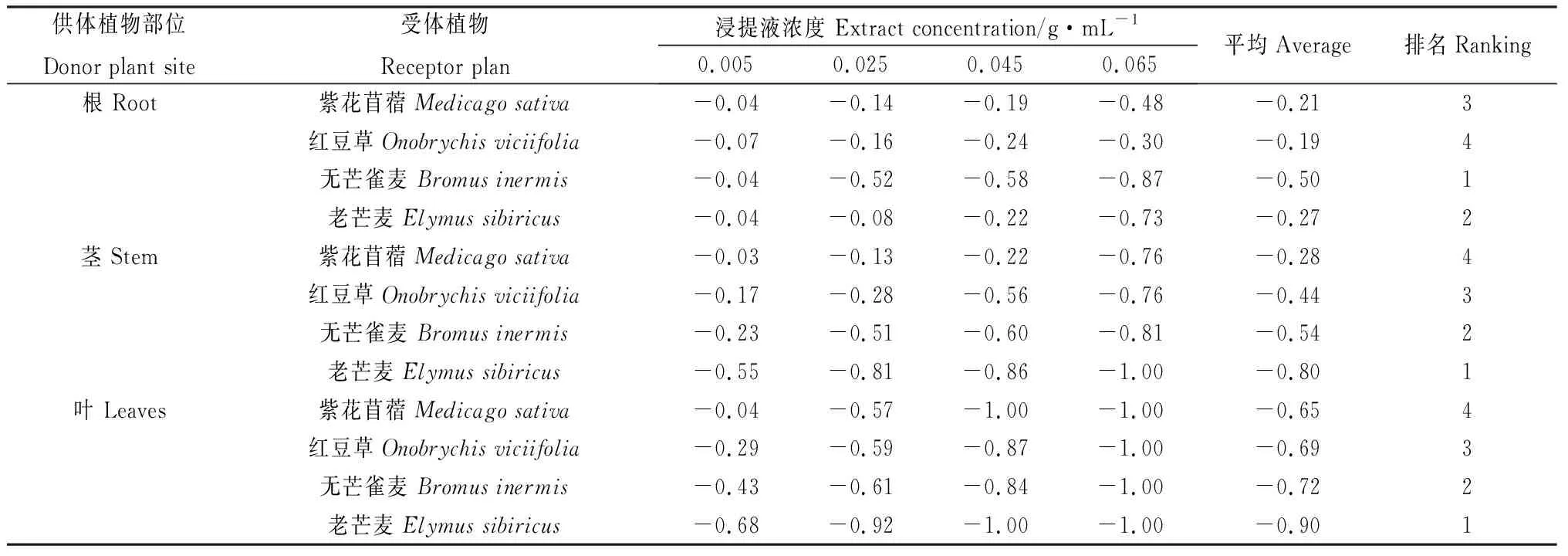
表6 苦豆子根、莖、葉浸提液對4種牧草種子化感綜合效應Table 6 Synthetic effects of allelopathic index of extracts from roots, stems and leaves of Sophora alopecuroides on four forage seeds
3 討論
化感是植物為本物種在競爭中能夠更好生存而進化出的適應機制,化感物質能夠抑制種子胚生長、影響種子細胞結構及種子萌發過程中的代謝途徑、打破種子內源激素平衡等[24-25]。植物化感作用受化感物質種類、浸提液濃度及受試植物種類影響,其存在濃度效應和化感作用不同[26-27]。化感物質幾乎都是植物次生代謝物質,其能有效提高植物生存競爭能力[25]。自然界中常見的化感作用的物質有:生物堿類物質、黃酮類物質、類萜、單寧、氨基酸和多肽、苯醌等[28]。其中,苦豆子中存在的生物堿由槐胺堿、苦參堿、異槐果堿、槐果堿、槐定堿等構成[29-30]。
隨著苦豆子根、莖、葉浸提液濃度的逐漸增大,紫花苜蓿、紅豆草、老芒麥和無芒雀麥的發芽勢、發芽率、發芽指數、根長和芽長均出現了不同程度的降低,表明苦豆子浸提液對4種牧草種子萌發呈現明顯抑制效果。周立彪等[31]發現不同溶劑的苦豆子浸提物對老瓜頭(Cynanchumkomarovii)種子的萌發均具有明顯的抑制作用,其萌發率、萌發指數、幼苗活力指數降低;呂篤康等[18]在研究苦豆子種子浸提液對禾本科牧草種苗的生長、發育中發現,隨著濃度的增加,化感抑制作用增強,影響作用較為顯著,這與本研究結果基本一致。在苦豆子根浸提液0.005 g·mL-1下紅豆草、無芒雀麥、老芒麥發芽勢的化感指數大于0,表明此濃度下對這3種牧草種子的發芽初期表現出一定的“低濃度促進高濃度抑制”現象,其原因一方面可能是低濃度下的化感物質有限,未能有效抑制這3種牧草種子的生長;另一方面,低濃度處理下,浸提液中的一些營養物質可能對牧草的生長有利,與馬銀山等[32]研究結果一致。在苦豆子各部位浸提液濃度升高至0.065 g·mL-1濃度時,4種牧草種子萌發均受到了明顯抑制;大部分處理組所測指標的化感效應指數小于0。高濃度下苦豆子根部的化感作用要顯著低于莖葉部分,這可能是苦豆子所含的生物堿在地上部分含量要遠高于根部的含量,所以根部化感作用要小于莖葉部分[33]。化感綜合效應表明,苦豆子的浸提液對無芒雀麥、老芒麥的化感抑制效果強于紫花苜蓿和紅豆草,原因可能是豆科相比禾本科表面有一層堅硬的外殼,對化感有較好的抗性,也可能是所測的豆科相比所測的禾本科種子內部含有特殊的物質對苦豆子有較好的耐受力,具體原因需做深入細致的研究。4種牧草對苦豆子不同部位,不同濃度浸提液的化感耐受力表現出一定的差異,苦豆子同一部位、相同濃度浸提液對4種牧草化感作用也不同,可能苦豆子的化感作用具有品種間差異性、物種選擇性及濃度效應[34]。
化感作用可能是苦豆子的蔓延重要原因之一。苦豆子一方面是以毒害草的“身份”存在,對草地畜牧業的發展產生了一定的影響,可以在放牧地或割草地篩選出對苦豆子抗性強的牧草或者在實際牧草建植時盡量徹底清除苦豆子植株,當地的自然條件、土質都會影響到草地的建植,需要對土壤進行分析研究,以免土壤殘留的苦豆子化感物質對植物正常生長產生影響;另一方面,在生態作用中,苦豆子又是天然草地生態群落中的一部分,具有耐干旱、耐鹽堿、抗風固沙、適應逆境等特性,一般生長在生態環境較為脆弱或草地嚴重退化的地方,對于維護生態平衡、防止土地沙漠化、促進退化草地的自我修復等具有重要生態作用,因此,用可持續發展的思路去合理看待這些毒害草。此次,本研究僅限所測4種牧草,實際生產實踐中和牧草的幼苗生長及其他牧草對苦豆子化感適應性的情況,仍需進一步研究。
4 結論
不同濃度的苦豆子根、莖、葉浸提液對紫花苜蓿、紅豆草、老芒麥和無芒雀麥的種子萌發均存在不同程度的化感作用,且抑制作用隨濃度升高而增強;苦豆子浸提液對無芒雀麥和老芒麥種子萌發的抑制作用強于紫花苜蓿和紅豆草,其中苦豆子不同部位浸提液濃度升高至0.065 g·mL-1時,4種牧草種子萌發均受到了明顯抑制。

