α-倒捻子素對帕金森病小鼠的神經保護作用
龐洪波,何曉非,張譯文,李琳琳
帕金森病是一種常見的慢性神經退行性疾病,以僵硬、震顫、運動遲緩、步態障礙等為主要臨床特征。病理上,黑質致密部的多巴胺能神經元逐漸喪失,使紋狀體中多巴胺含量缺乏和不足,是導致上述癥狀的主要原因。多巴胺替代療法是治療帕金森病的主要方法,但它不能阻止帕金森病的發生發展,并且會產生許多負面效應。因此,開發更有效的治療藥物對于帕金森病來說具有重要的臨床價值。α-倒捻子素是山竹子果殼中的一種多酚類化合物,具有抗炎、抗氧化應激、抗腫瘤等多種生物學效應[1-3]。近年研究發現,α-倒捻子素可在神經系統疾病中發揮保護作用[4-5],如Zhao 等[6]發現α-倒捻子素可以抑制β-分泌酶和γ-分泌酶的活性,從而抑制β-淀粉樣蛋白的生成,而且可以干預阿爾茨海默病的多種病理過程,有希望成為一種新型的神經保護劑。本研究通過腹腔注射1-甲基-4-苯基-1,2,3,6-四氫吡啶(MPTP)的方法構建帕金森病小鼠模型,以探討α-倒捻子素對帕金森病是否也具有神經保護作用,期望為帕金森病的治療提供新的選擇。本研究的起止時間為2018年7月至2019年8月。
1 材料與方法
1.1 主要試劑與儀器MPTP 購于美國Sigma 公司;α-倒捻子素購于南京狄爾格醫藥科技有限公司;YLS-4C轉棒儀購于濟南益延科技發展有限公司;抗酪氨酸羥化酶(TH)抗體購于美國Santa Cruz 公司;抗B 細胞淋巴瘤-2(Bcl-2)抗體、抗Bcl-2 相關X 蛋白(Bax)抗體、抗活化胱天蛋白酶-9(cleaved-caspase-9)抗體、抗甘油醛-3-磷酸脫氫酶(GAPDH)抗體購于美國Abcam 公司;山羊血清封閉液、4′,6-二脒基-2-苯基吲哚(DAPI)購于北京中杉金橋生物技術有限公司;TUNEL 染色試劑盒、放射免疫沉淀法(RIPA)裂解液、BCA 蛋白定量試劑盒、電化學發光法(ECL)顯色液購于上海碧云天生物技術有限公司。
1.2 實驗分組與處理SPF 級雄性C57BL/6小鼠購于北京維通利華實驗動物技術有限公司,生產許可證號SCXK(京)2019-000,使用許可證號SYXK(京)2017-0033),8周齡,體質量范圍為18~22 g。飼養環境為室溫23~25 ℃,標準濕度55%~60%,光照和黑夜各12 h,飲水飲食正常,分籠飼養,于1 周后實驗。將40 只C57BL/6 小鼠按照隨機數字表法分為四組,分別為對照組、模型組、α-倒捻子素給藥組(低劑量組、高劑量組),每組10只。模型組與α-倒捻子素給藥組進行帕金森病造模,即給予30 mg/kg 的MPTP腹腔注射,每日1 次,連續7 d;對照組則腹腔注射相同體積的生理鹽水。α-倒捻子素給藥組在MPTP 注射完畢后次日進行α-倒捻子素灌胃給藥,劑量分別為5 mg·kg-1·d-1、15 mg·kg-1·d-1,每日1 次,連續14 d[7-9];對照組和模型組則給予相同體積的生理鹽水灌胃。最后一次給藥后14 d,進行小鼠的行為學觀測。本研究符合一般動物實驗倫理學原則。

圖1 各組小鼠間黑質區TH表達的比較(免疫熒光染色×400)

圖2 各組小鼠間黑質區細胞凋亡水平的比較(TUNEL染色×100)
1.3 行為學觀測爬桿實驗:將1 個直徑2 cm 的塑料小球固定于爬桿頂部,在爬桿上纏繞醫用紗布以防止小鼠滑落,然后將小鼠放置于球體上使其爬下,以其雙前肢接觸爬桿底部為止,記錄其所需時間。每只小鼠測定3 次取均值。轉棒實驗:將小鼠放置于正在運轉的轉棒儀上,記錄小鼠在轉棒上的停留時間。每只小鼠測定3 次取均值。懸掛實驗:在距地面30 cm 處水平懸掛1 根直徑1 mm 的金屬線,使小鼠的雙前爪抓住金屬線,小鼠若在10 s內能用2只后爪抓住金屬線記3分,用1只后爪抓住金屬線記2分,2只均未抓住記1分,掉落記0分。
1.4 紋狀體多巴胺及其代謝產物含量的檢測行為學觀測結束后,將小鼠斷頭處死,在冰上迅速取出腦組織紋狀體區,稱重后放置于勻漿器中,加入1 mL 預冷的氯乙酸后勻漿。將勻漿液以8 000 r/min離心20 min,吸取上層液。使用高壓液相電化學技術測定多巴胺、高香草酸、3,4-二羥基苯乙酸(DOPAC)的含量。
1.5 免疫熒光染色檢測TH 表達小鼠斷頭處死后,同時在冰上迅速取出腦組織黑質區,放置于4%的多聚甲醛中固定48 h,蔗糖脫水后制作冰凍切片。山羊血清封閉液室溫封閉30 min,加入抗TH抗體(1∶200)4 ℃過夜孵育。次日,磷酸緩沖鹽溶液(PBS)洗滌3 次,加入二抗室溫孵育1 h,PBS 洗滌3 次,滴加DAPI染核,封片,熒光顯微鏡下觀察TH的表達。
1.6 TUNEL 染色檢測細胞凋亡水平根據上述方法制備腦組織黑質區的冰凍切片,按照TUNEL 染色試劑盒說明書操作,熒光顯微鏡下觀察和拍照。
1.7 蛋白質印跡法檢測凋亡相關蛋白表達取腦組織黑質區,加入RIPA 裂解液提取總蛋白質,BCA法測定總蛋白含量。取30 μg 總蛋白進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)和電轉印,5%的牛血清白蛋白室溫封閉2 h,加入抗Bax 抗體(1∶1 000)、抗Bcl-2 抗體(1∶1 000)、抗cleavedcaspase-9 抗 體(1∶1 000)、抗GAPDH 抗 體(1∶3 000),4 ℃過夜孵育。次日,洗膜后加入二抗室溫孵育1 h,洗膜后滴加ECL 顯色液,使用凝膠成像儀曝光和拍照。使用Image J軟件測定各條帶灰度值,將對照組的目的蛋白與GAPDH灰度值之比作為1.0。
1.8 統計學方法使用SPSS 20.0 軟件進行統計。所有計量數據均符合正態分布,以± s 表示,多組間計量數據的比較使用單因素方差分析,多組間的兩兩比較使用LSD-t檢驗。檢驗水準α=0.05。
2 結果
2.1 各組小鼠間行為學的比較與對照組比較,模型組小鼠的爬桿時間升高,轉棒停留時間和懸掛實驗得分均降低(P<0.05)。與模型組比較,低劑量組和高劑量組小鼠的爬桿時間降低,轉棒停留時間和懸掛實驗得分均升高(P<0.05)。高劑量組的上述指標均優于低劑量組。見表1。
2.2 各組小鼠間紋狀體多巴胺及其代謝產物含量的比較與對照組比較,模型組小鼠的紋狀體多巴胺、高香草酸、DOPAC 含量降低(P<0.05)。與模型組比較,低劑量組和高劑量組小鼠的紋狀體多巴胺、高香草酸、DOPAC 含量升高,且高劑量組的紋狀體多巴胺、高香草酸、DOPAC 含量高于低劑量組(P<0.05)。見表2。
表1 各組小鼠間行為學的比較/± s
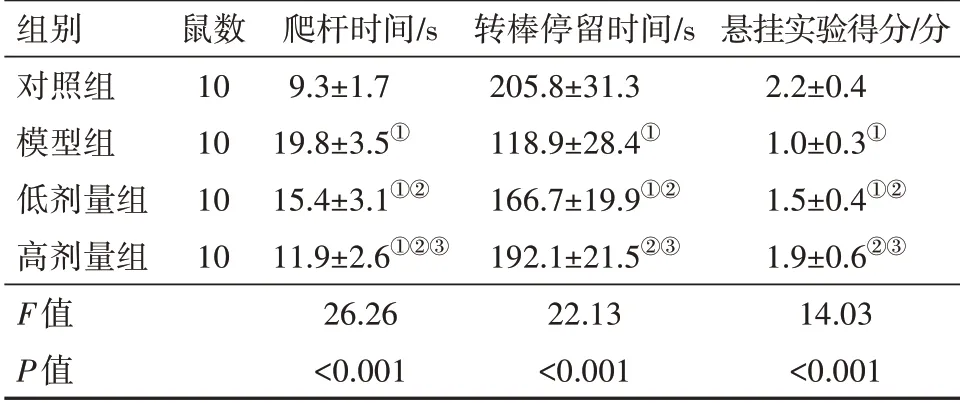
表1 各組小鼠間行為學的比較/± s
注:①與對照組比較,P<0.05。②與模型組比較,P<0.05。③與低劑量組比較,P<0.05。
組別對照組模型組低劑量組高劑量組F值P值鼠數10 10 10 10爬桿時間/s 9.3±1.7 19.8±3.5①15.4±3.1①②11.9±2.6①②③26.26<0.001轉棒停留時間/s 205.8±31.3 118.9±28.4①166.7±19.9①②192.1±21.5②③22.13<0.001懸掛實驗得分/分2.2±0.4 1.0±0.3①1.5±0.4①②1.9±0.6②③14.03<0.001
表2 各組小鼠間紋狀體多巴胺及其代謝產物含量的比較/(ng/g,± s)

表2 各組小鼠間紋狀體多巴胺及其代謝產物含量的比較/(ng/g,± s)
注:DOPAC為3,4-二羥基苯乙酸。①與對照組比較,P<0.05。②與模型組比較,P<0.05。③與低劑量組比較,P<0.05
組別對照組模型組低劑量組高劑量組F值P值鼠數10 10 10 10多巴胺2 051.4±195.2 911.3±88.5①1 388.6±159.9①②1 728.2±180.6①②③91.37<0.001高香草酸1 677.3±128.0 1 190.5±83.3①1 366.7±109.2①②1 510.8±112.4①②③35.89<0.001 DOPAC 395.8±41.1 187.9±20.3①266.5±33.7①②320.3±40.4①②③63.15<0.001
2.3 各組小鼠間黑質區TH 表達的比較對照組、模型組、低劑量組、高劑量組小鼠黑質區TH 表達水平 分 別 為(46.27±5.46)%、(8.85±3.15)%、(21.54±4.11)%、(35.29±4.63)%(F=20.77,P<0.001)。與對照組比較,模型組小鼠黑質區TH 表達降低(P<0.05);與模型組比較,低劑量組和高劑量組小鼠黑質區TH 表達升高,且高劑量組的TH 表達量高于低劑量組(P<0.05)。見圖1。
2.4 各組小鼠間黑質區細胞凋亡水平的比較對照組、模型組、低劑量組、高劑量組小鼠黑質區TH表達水平分別為(3.23±1.24)%、(34.18±5.15)%、(14.34±3.41)%、(6.42±1.62)%(F=14.03,P<0.001)。與對照組比較,模型組小鼠黑質區細胞凋亡水平升高(P<0.05)。與模型組比較,低劑量組和高劑量組小鼠黑質區細胞凋亡水平降低,且高劑量組的細胞凋亡水平低于低劑量組(P<0.05)。見圖2。
2.5 各組小鼠間黑質區凋亡相關蛋白表達的比較與對照組比較,模型組小鼠黑質區Bax 和cleaved-caspase-9表達量升高,Bcl-2表達量降低(P<0.05)。與模型組比較,低劑量組和高劑量組小鼠黑質 區Bax 和cleaved-caspase-9 表 達 量 降 低,Bcl-2 表達量升高(P<0.05)。高劑量組的上述指標均優于低劑量組。見圖3,表3。
3 討論

圖3 蛋白質印跡法檢測黑質區凋亡相關蛋白的表達
表3 各組小鼠間黑質區凋亡相關蛋白表達的比較/± s

表3 各組小鼠間黑質區凋亡相關蛋白表達的比較/± s
注:Bcl-2 為B 細胞淋巴瘤-2,Bax 為Bcl-2 相關X 蛋白,cleavedcaspase-9為活化胱天蛋白酶-9。①與對照組比較,P<0.05。②與模型組比較,P<0.05。③與低劑量組比較,P<0.05。
組別對照組模型組低劑量組高劑量組F值P值鼠數10 10 10 10 Bcl-2 1.00±0.17 0.23±0.11①0.44±0.19①②0.94±0.22②③45.37<0.001 Bax 1.00±0.14 3.15±0.42①2.06±0.38①②1.18±0.20②③101.80<0.001 cleaved-caspase-9 1.00±0.15 4.27±0.52①2.29±0.43①②1.30±0.28②③156.80<0.001
天然植物提取物因具有安全性高、提取成本低、生物學活性高等優勢,在醫藥開發領域逐漸占據重要地位,也是治療帕金森病潛在的寶貴資源。α-倒捻子素是一種多酚黃酮類物質,來源于山竹子的果皮、樹皮和干汁,而山竹子在一些熱帶國家中常被經驗性地用于腹痛、腹瀉、痢疾、感染性傷口、慢性潰瘍等疾病[10-11]。近年研究發現,α-倒捻子素具有廣泛的生物學效應,如α-倒捻子素是一種強有效的活性氧清除劑,可減少線粒體毒素3-硝基丙酸引起的神經元死亡[12-13]。
MPTP 及其代謝產物通過抑制線粒體復合物Ⅰ的活性誘導多巴胺神經元凋亡,從而產生類帕金森病樣癥狀和病理特征,連續腹腔注射5~7 d 是制備帕金森病小鼠模型的經典方法[14-15]。行為學觀測發現,與對照組比較,模型組小鼠的爬桿時間升高,轉棒停留時間和懸掛實驗得分均降低,表明造模小鼠的運動協調能力明顯減弱,證實動物模型已成功構建。此外,給予α-倒捻子素可以明顯改善造模小鼠的行為學指標,而且高劑量組優于低劑量組,表明α-倒捻子素對帕金森病確實具有治療效應。
為了進一步證實上述行為學的結論,本研究檢測了α-倒捻子素對帕金森病典型病理特征的影響。TH是多巴胺神經元的特征性標志物,可以反映其數量變化[16],本研究對黑質區神經元進行了TH 的免疫熒光染色,結果顯示α-倒捻子素可以顯著抑制MPTP 導致的TH 表達降低,表明α-倒捻子素對多巴胺神經元具有保護作用。此外,α-倒捻子素給藥組小鼠紋狀體中多巴胺及其代謝產物的含量高于模型組,該結果也進一步證實了α-倒捻子素的神經保護作用。細胞凋亡是導致帕金森病中多巴胺神經元數量降低的主要機制[17-18],TUNEL 染色和蛋白質印跡法結果顯示α-倒捻子素可以抑制神經凋亡,下調促凋亡蛋白Bax 和cleaved-caspase-9 表達,上調抗凋亡蛋白Bcl-2 表達。上述神經保護效應的機制可能要歸功于α-倒捻子素強有力的抗氧化、抗炎作用,如謝瑞等人在癲癇小鼠模型中發現,α-倒捻子素可降低海馬組織中炎性因子的含量,活化核因子E2相關因子2/血紅素加氧酶-1(NRF2/HO-1)信號通路[7]。但是,本研究未對該方面進行研究,未來需要進一步檢測黑質區氧化應激及炎癥相關因子的含量,以深入探討α-倒捻子素的神經保護機制。
本研究的不足與展望:(1)內質網應激、線粒體功能障礙、自噬、蛋白酶體功能障礙等過程與帕金森病的發生發展密切相關,α-倒捻子素對這些病理過程的影響尚不清楚,未來仍需要進一步完善相關指標的檢測;(2)α-倒捻子素溶解性差,通過口服進入循環系統的效率較低,而且血腦屏障的阻礙作用較強[19-20],如何促進α-倒捻子素吸收和遞送是個關鍵問題,未來可以嘗試構建納米載藥系統以及靶向肽修飾等方法解決[21]。
綜上所述,α-倒捻子素可以改善MPTP 誘導帕金森病小鼠模型的行為學,上調多巴胺及其代謝產物的含量,促進TH表達,抑制細胞凋亡水平。
(本文圖1,2見插圖9-1)

