既往胸部放療對信迪利單抗聯合多西他賽治療Ⅳ期非小細胞肺癌病人預后的影響分析
鄭紀紅,韓強,馮金月,宋代穎,郭英,劉伊輝
目前肺癌仍是全球癌癥相關死亡的主要原因,嚴重威脅著人類的身體健康,其中85%以上的肺癌由非小細胞肺癌(non-small cell lung cancer,NSCLC)組成[1]。因肺癌病人咳嗽、咳痰、胸痛、咯血等早期癥狀不明顯,超過50%的肺癌病人確診時已經處于晚期階段[2]。NSCLC 的發生、發展機制仍不明確,但通常認為它與機體免疫系統互相作用與影響,并形成免疫抑制性微環境,因此抗腫瘤治療更迫切地需求針對腫瘤微環境的藥物[3]。近年來,隨著人們對免疫治療的研究不斷深入,程序性死亡受體1(programmed death 1,PD-1)/程序性死亡配體1(programmed death ligand 1,PD-L1)抑制劑在晚期NSCLC 治療中廣泛應用,但免疫抑制劑單藥治療的客觀緩解率不足20%,因此尋求提高免疫治療應答率的治療方案成為研究重點[4]。現已有多項研究表明放化療聯合免疫治療均顯著改善NSCLC 病人腫瘤微環境的免疫抑制性,通過下調免疫抑制調節性T 細胞數量和恢復T 細胞殺傷腫瘤細胞的能力來增強機體抗腫瘤免疫反應,是晚期NSCLC 治療中較為有效的新策略[5-6]。信迪利單抗是一種抗PD-1 抗體,于2018 年經國家藥品監督管理總局批準上市,這表明晚期NSCLC 的治療進入中國自主創新的免疫時代。多西他賽為晚期NSCLC 標準二線治療方案之一,其單藥應用療效差且不良反應發生率較高[7],一項II 期臨床試驗(NCT02574598 研究)證明多西他賽聯合免疫治療晚期NSCLC 可顯著延長病人的生存期,且具有良好的安全性[8]。本研究回顧性分析信迪利單抗與多西他賽聯合治療Ⅳ期NSCLC 的有效性及安全性,為今后Ⅳ期NSCLC 病人二線治療方案的選擇提供更充分的理論依據。放療可誘導腫瘤微環境的免疫調節,是免疫治療的啟動者,但目前關于既往放療對免疫治療的影響分析較少,本文通過分析既往胸部放療對接受該聯合方案治療的Ⅳ期NSCLC 病人預后的影響,討論既往胸部放療在接受免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)治療病人預后中的臨床價值。
1 資料與方法
1.1 一般資料回顧性分析2019 年2 月至2020 年1 月濰坊醫學院附屬醫院收治的Ⅳ期難治性無基因突變NSCLC病人73例,均經病理組織學或細胞學明確診斷(組織學標本中PD-L1 表達情況不詳),并有CT、磁共振成像(MRI)、正電子發射計算機斷層顯像(PET-CT)等影像學檢查明確轉移部位。納入標準:①17 歲<年齡<80 歲;②一線抗腫瘤治療方案失敗,已接受信迪利單抗聯合多西他賽治療;③體力狀況東部腫瘤協作組(eastern cooperative oncology group,ECOG)評分為0~3 分;④存在至少1 個可測量評估的病灶;⑤無表皮生長因子受體或間變淋巴瘤激酶等基因突變;⑥重要臟器功能正常。排除標準:①合并其他惡性腫瘤者;②有免疫功能缺陷者;③合并活動性傳染性疾病者。本研究符合《世界醫學協會赫爾辛基宣言》相關要求,病人或其近親屬簽署知情同意書。本研究失訪病人3 例,最終共70 例病人納入研究,所有病人至少接受2 周期信迪利單抗聯合多西他賽治療,依據既往是否行胸部放療進行分組。如果病人在接受信迪利單抗之前接受了胸部放療,則為放療組(28 例),既往胸部放療均應用醫用電子直線加速器治療,每次1.8~2.0 Gy,放療劑量范圍為45~70 Gy,放療劑量中位數為60 Gy;主要危及器官受量分別為:脊髓劑量≤50 Gy,肺平均劑量≤20 Gy,雙肺V20≤30%,心臟V30<40%、V40<30%。如果病人在接受信迪利單抗之前未行胸部放療,則為無放療組(42例)。
1.2 方法所有病人每周期治療前均完善血常規、血生化、甲狀腺功能、心電圖等檢查,如無明顯異常,給予信迪利單抗注射液(規格:每支10 g/L,批號S20180016,信達生物制藥生產)200 毫克/次聯合多西他賽(規格:每支40 g/L,批號H200041129,齊魯制藥生產)75 mg/m2治療,21 d 為1 個治療周期,每2個周期進行1 次療效評價,直到出現疾病進展或者無法耐受的不良反應。治療中出現與多西他賽相關的3 級及以上的不良反應,下個周期減量20%。出現與信迪利單抗相關的3 級及以上的不良反應,暫停給藥直至不良反應恢復至0~1 級或考慮永久停藥。
1.3 觀察指標及方法
1.3.1 觀察終點 無進展生存時間(progressionfree survival,PFS)表示病人自該聯合方案治療開始起至疾病進展或疾病無進展末次隨訪的時間,隨訪截止日期為2021年4月。
1.3.2 療效評價 所有病人每2個周期進行1次CT或MRI 檢查,按實體瘤療效評價標準(RECIST)1.1版,療效分為:完全緩解、部分緩解、疾病穩定、疾病進展。總有效率定義為(完全緩解+部分緩解)/總例數×100%。疾病控制率(DCR)定義為(完全緩解+部分緩解+疾病穩定)/總例數×100%。
1.3.3 不良反應評價標準 不良反應采用美國國家癌癥研究所通用毒性標準v4.0,主要不良反應包括骨髓抑制、肝臟毒性、乏力等。
1.4 統計學方法應用SPSS 20.0 軟件統計。用χ2檢驗對兩組計數資料進行比較;應用Kaplan-Meier法進行生存分析,行log-rank 檢驗,并繪制生存曲線,應用Cox 比例風險模型分析影響病人預后的因素,并計算各自的風險比(HR)和95%置信區間(CI)。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料比較兩組病人的年齡、性別等一般資料比較,差異無統計學意義(P>0.05),兩組具有可比性,見表1。
2.2 療效比較放療組總有效率、DCR 分別為46.43%、75.00%,無放療組的總有效率、DCR 分別為40.48%、71.43%,但兩組總有效率、DCR 比較差異無統計學意義(P>0.05),見表2。截至隨訪時間,仍有2 例病人繼續接受聯合方案治療。放療組和無放療組病人中位無進展生存時間(mPFS)分別為7.9個月[95%CI:(7.1,8.7)]和6.5 個月[95%CI:(5.4,7.6)],log-rank P=0.004,差異有統計學意義;將放療組的病人按放療結束至開始信迪利單抗治療的時間進行分層分析,分為時間間隔≤6 個月(12 例)和>6 個月(16 例),兩者的mPFS 分別為8.6 個月[95%CI:(7.4,9.8)]和7.5 個月[95%CI:(6.7,8.3)],log-rank P=0.297,差異無統計學意義。
2.3 生存分析單因素分析中,與年齡、性別、病理類型、吸煙史等因素相比,既往胸部放療[HR=0.490,95%CI:(0.296,0.810);P=0.005]是改善PFS預后的保護性因素,ECOG 評分不佳[HR=2.491,95%CI:(1.482,4.187);P=0.001]、腦 轉 移[HR=1.795,95%CI:(1.026,3.138);P=0.040]是影響PFS預后的危險性因素(表3),并繪制生存曲線(圖1~3)。依據單因素分析結果,將P<0.05 的因素(既往胸部放療、ECOG 評分、腦轉移)納入多因素回歸分析,結 果 示 既 往 胸 部 放 療[HR=0.524,95%CI:(0.371,0.868);P=0.012]是改善PFS 的獨立保護性因素,ECOG 評分不佳[HR=2.830,95%CI:(1.649,4.858);P<0.001]、腦 轉 移[HR=1.941,95%CI:(1.085,3.473);P=0.025]是預后較差的獨立危險性因素。

表3 與Ⅳ期無基因突變非小細胞肺癌70例PFS相關的單因素分析
2.4 不良反應分析兩組各種不良反應比較差異無統計學意義,兩組所有級別不良反應發生率分別為53.57%和54.76%,P=0.922,3 級及以上不良反應發生率分別為7.14%和9.52%,P=0.544,詳見表4。上述不良反應給予對癥處理后均好轉或消失,總體安全性好。
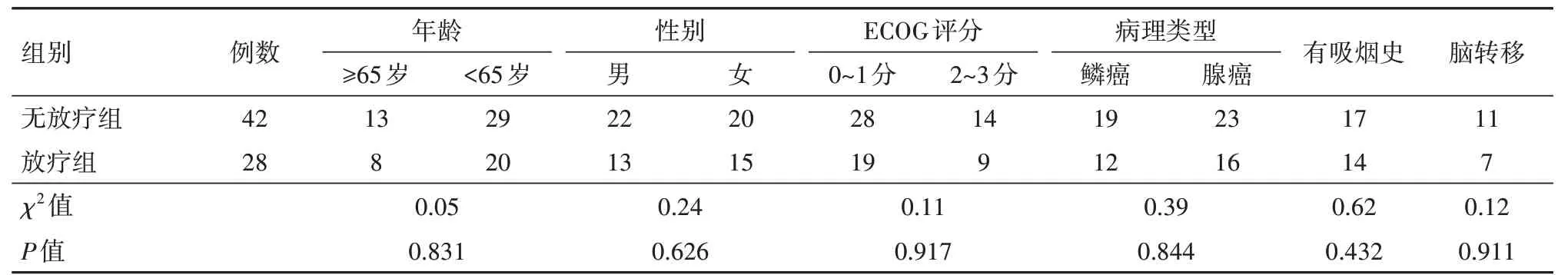
表1 兩組Ⅳ期無基因突變非小細胞肺癌病人一般資料比較/例

表2 兩組Ⅳ期無基因突變非小細胞肺癌病人臨床療效比較

表4 兩組Ⅳ期無基因突變非小細胞肺癌病人不良反應比較/例

圖1 既往胸部放療對Ⅳ期無基因突變非小細胞肺癌70例無進展生存時間(PFS)的影響分析
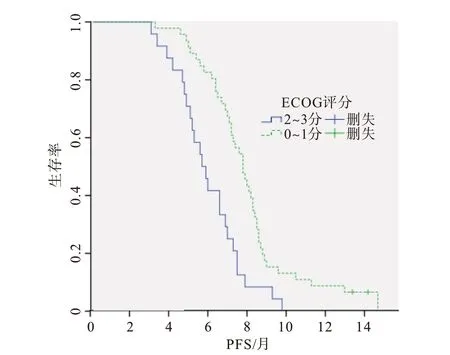
圖2 不同東部腫瘤協作組(ECOG)評分對Ⅳ期無基因突變非小細胞肺癌70例無進展生存時間(PFS)的影響分析
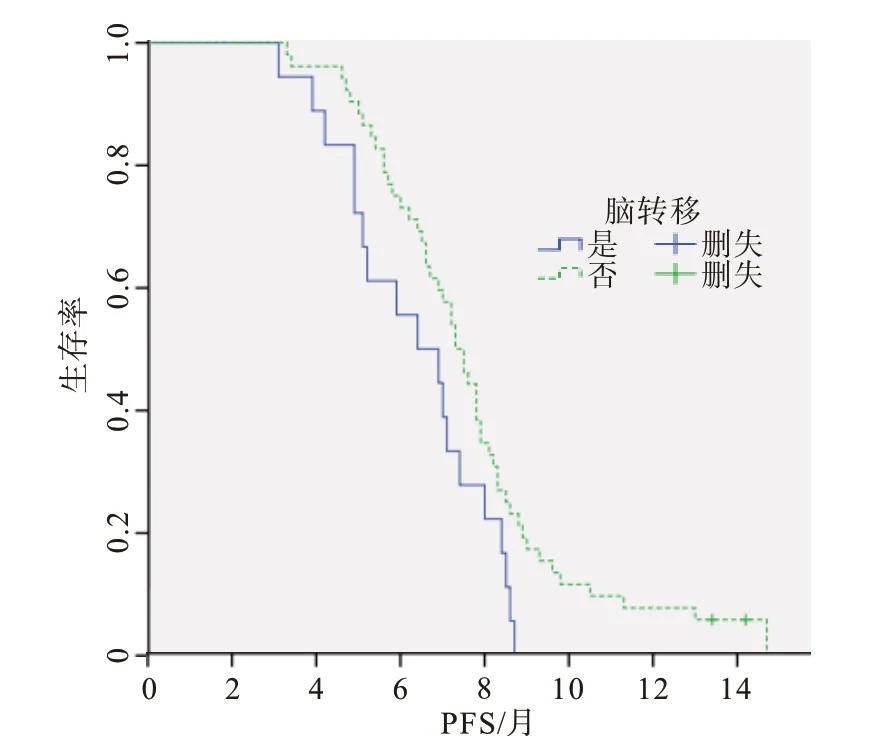
圖3 腦轉移對Ⅳ期無基因突變非小細胞肺癌70例無進展生存時間(PFS)的影響分析
3 討論
NSCLC 早期具有隱匿性的特點,臨床分期多是晚期,提示預后相對不佳。在晚期NSCLC 中,高耐藥性的發生導致了放化療、靶向等傳統治療的失敗,免疫治療成為臨床治療中的重要一部分[9]。PD-1是一種下調效應T 細胞的抑制性檢查點,腫瘤細胞可通過激活免疫檢查點發生免疫逃逸[10]。信迪利單抗通過與機體免疫細胞表面的PD-1 結合,抑制PD-1 與腫瘤細胞表面的PD-L1 之間的相互作用,進而阻斷了T 細胞抗腫瘤活性的抑制作用,使T 細胞重新激活并殺傷癌細胞[11]。一項臨床前研究表明,信迪利單抗相對于其他抗PD-1藥物,表現出對PD-1受體更高的親和力和更強的抗腫瘤作用,且解離速度非常慢,這一特性決定了它對PD-1通路具有持久的阻斷作用[12]。盡管抗PD-1 免疫治療的效果多與病人PD-L1 表達水平有關,但有研究提示無論其表達情況如何,聯合治療可能是提高療效、減少不良反應的有效措施[13]。
本研究結果示,兩組病人的總有效率分別為46.43%、40.48%,DCR 分別為75.00%、71.43%,mPFS分別為7.9、6.5 個月,與NCT02574598 研究[8]結果相似,提示免疫與化療聯合治療的病人生存獲益明顯。本研究中兩組病人總有效率、DCR 比較均差異無統計學意義,表明既往胸部放療無法預測接受ICIs 治療的晚期NSCLC 病人的療效。本研究提示放療組病人有更好的PFS 獲益(P=0.004)。這與Ratnayake 等[14]的回顧性研究結果一致,該研究發現給予納武利尤單抗二線治療的轉移性非細胞肺癌病人中,既往或同期接受胸部放療者PFS 獲益明顯(P=0.020)。本研究單因素及多因素分析結果均表明既往胸部放療是改善病人PFS 預后的保護性因素。其可能存在的機制為:放療誘導腫瘤釋放特異抗原,將其轉化為原位疫苗,放療也可調節腫瘤新抗原的表達,進而激活先天性和適應性免疫反應,并維持機體免疫記憶,對腫瘤做出長期免疫應答,抗PD-1 治療可增強機體抗腫瘤活性[15]。這種免疫記憶可能是既往放療對病人生存期影響的機制之一,但具體的機制仍需研究證實[16]。本研究將放療組的病人按放療結束至開始ICIs治療的時間進行分層分析,結果示病人的PFS 預后與該時間無明顯關系。PACIFIC 研究表明放化療與ICIs 續貫應用時,ICIs 應用時間越早,獲益越明顯[17]。因此本研究可能尚有不足,結論可能隨著樣本量增大而改變。
本研究還表明腦轉移、ECOG 評分不佳是病人預后較差的獨立危險性因素。腦為NSCLC 常見的轉移器官之一,晚期階段的NSCLC 病人腦轉移率高達30%,嚴重影響病人的生活質量[18]。由于肺癌可誘導全身免疫抑制這一特點,推測腦轉移可能在被發現之前的很長一段時間就已經發生[19]。然而,迄今為止的多數研究都集中在轉移性腫瘤治療的階段。免疫治療雖在晚期NSCLC 治療中獲得良好的效果,但在早期疾病中的作用仍不清楚,仍須進一步探究。本研究中兩組病人的不良反應多為1~2級,少數病人發生3級及以上不良反應,表明病人對信迪利單抗、多西他賽的副作用尚可耐受。雖然有研究顯示既往有胸部放療的NSCLC 病人在接受帕博利珠單抗治療后肺毒性發生率更高[17],但本研究中兩組病人所有級別不良反應發生率、3 級及以上不良反應發生率比較均差異無統計學意義,提示既往胸部放療與不良反應增加無關。
綜上所述,信迪利單抗聯合多西他賽二線以上治療Ⅳ期無基因突變NSCLC 有良好的療效和安全性;既往胸部放療有助于接受ICIs 治療的Ⅳ期NSCLC 病人預后的判斷,具體機制還需進一步研究。本研究也存在一定局限:樣本量偏少。

