熒光光譜法探究pH值對葉黃素與牛血清白蛋白相互作用的影響
范金波,康 柱,張 炎,蘇冬雨,周素珍,呂長鑫
(渤海大學食品科學與工程學院,遼寧省食品安全重點實驗室,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧 錦州 121013)
牛血清白蛋白(bovine serum albumin,BSA)是人血清白蛋白(human serum albumin,HSA)的同源蛋白,由3 個結構同源的螺旋結構域(I、II和III)組成,每個螺旋結構域都包含2 個亞結構域(A和B),并且位于白蛋白上藥物結合位點的主要區域在IIA和IIIA子域的疏水腔中。BSA螺旋結構相對于其他蛋白質比較薄弱,與其他物質的連接位置容易更改,所以BSA能夠與脂溶性或水溶性物質發生結合作用。由于BSA相對HSA易提取,成本較低,可作為載體攜帶小分子作用于相應部位,發生相應的活性作用,因此研究BSA與小分子結合對小分子的活性保護和靶向傳遞有著重要意義。
類胡蘿卜素廣泛存在于植物中,種類多樣,具有抗癌、抗炎、抗氧化、抑菌、抑血栓等多種活性作用。其中,葉黃素是人體視網膜黃斑的組成成分,具有保護視網膜和預防心血管疾病的作用。然而因葉黃素穩定性差,易受光、氧、熱等環境因素的影響,以及水溶性較差的特點,導致其生物利用度低,限制了其應用。因此,通過蛋白基載體實現葉黃素的保護和靶向遞送已經成為研究的熱點。
目前,藥物、生物活性小分子等與BSA或HSA相互作用的研究較為普遍,但在不同pH值條件下,葉黃素與BSA的相互作用鮮見報道,亟待深入研究。通過熒光光譜法及分子對接技術研究不同pH值(7.4、5.2、3.0)對葉黃素-BSA相互作用的影響,對于BSA蛋白基載體的開發及活性成分的保護都具有重要意義。
1 材料與方法
1.1 材料與試劑
BSA(98%) 北京百靈威科技有限公司;葉黃素(98%)、布洛芬(ibuprofen,IBUP,98%)、華法林(warfarin,WARF,98%) 生工生物工程(上海)有限公司;其他實驗試劑均為分析純。
1.2 儀器與設備
F-7000熒光分光光度計 日本日立高新技術公司;GL124-1SCN電子天平 賽多利斯科學儀器(北京)有限公司;HY-2旋渦混勻儀、PHS-25 pH計 儀電科學儀器(上海)股份有限公司。
1.3 方法
1.3.1 儲備液的配制
配制0.2 mol/L的pH 7.4、5.2、3.0磷酸緩沖液,并配制1.2×10mol/L的BSA儲備液,以及7.2×10mol/L葉黃素、IBUP、WARF儲備液。
1.3.2 葉黃素與BSA相互作用的熒光光譜測定
熒光發射光譜:向離心管中加入一定量的磷酸緩沖液,再加入1.2×10mol/L BSA溶液30 μL,最后加入葉黃素溶液,最終離心管中溶液總體積為3 mL,使之充分反應30 min。分別在298 K和310 K溫度下,設置激發波長為280 nm,發射波長為290~450 nm,以700 nm/min的掃描速率進行熒光發射光譜的測定。
同步熒光光譜:在298 K溫度下,固定和的波長間隔分別為Δ=60 nm和Δ=15 nm,分別測定樣品在250~350 nm的同步熒光光譜并記錄。
1.3.3 葉黃素與BSA的結合位點
參照1.3.2節方法,在加入葉黃素溶液前,先加入7.2×10mol/L WARF/IBUP溶液25 μL,使其混勻充分反應20 min,再加入葉黃素溶液,后續操作同1.3.2節,并設置對照組。
1.3.4 分子對接
運用Autodock Vina軟件進行分子對接。在RCSB PDB蛋白質數據庫中選取BSA(ID∶4OR0)的3D結構,保留A鏈并去除結構中的水分子,添加H原子;PubChem數據庫中選取葉黃素(CID:5281243)的3D結構。設置對接區域以覆蓋受體分子的大部分,BSA設為剛性對接,葉黃素設為柔性對接,其他參數設置保持默認。從結果中選擇結合能最低的對接構象,利用Discovery Studio 2017 R2和Pymol軟件進行作圖分析。
1.4 數據處理
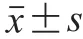
2 結果與分析
2.1 葉黃素與BSA相互作用的熒光光譜分析
如圖1所示,298 K、不同pH值條件下,葉黃素對BSA均產生熒光猝滅現象,且熒光強度隨著葉黃素濃度的升高而逐漸降低。pH 7.4~3.0時,BSA的熒光強度峰值分別降低了43%、46%和39%。當pH 7.4時,最大發射波長()在340 nm處,沒有發生明顯的位移;pH 5.2時,發生微弱藍移(339~337 nm);pH 3.0時,發生紅移(325~329 nm)。這可能是因為pH值使葉黃素與BSA相互作用的微環境發生了變化。由圖1D可知,隨著葉黃素濃度的增大,猝滅率逐漸增大。pH 5.2的猝滅率最高,pH 7.4和pH 3.0的猝滅率相差不大。

圖1 298 K條件下pH值對葉黃素與BSA結合影響的熒光光譜Fig. 1 Fluorescence spectra of lutein-BSA complex at different pH conditions and 298 K
由圖2可知,在310 K時,不同pH值條件下葉黃素對BSA均產生熒光猝滅作用。當pH 7.4、5.2和3.0時,BSA的熒光強度峰值分別降低了46%、35%和31%。在pH 7.4、5.2和3.0時,隨著葉黃素濃度的增大,BSA的分別紅移2 nm(338~340 nm)、藍移2 nm(337~335 nm)、紅移5 nm(324~329 nm)。這說明葉黃素與BSA發生了相互作用,同時加之pH值變化的影響,使熒光基團附近的微環境發生變化。在不同pH值條件下,與298 K相比,均有明顯的位移現象,說明溫度也影響了其相互作用的微環境。由圖2D可知,在同一葉黃素濃度下,隨著pH值的升高,猝滅率逐漸增大,pH 7.4時,猝滅率最高,說明pH值影響了葉黃素與BSA的結合作用。

圖2 310 K條件下pH值對葉黃素與BSA結合影響的熒光光譜Fig. 2 Fluorescence spectra of lutein-BSA complex at different pH conditions and 310 K
2.2 熒光猝滅機理和結合常數
通常熒光猝滅用來反映蛋白質與活性成分之間的相互作用,熒光猝滅類型有2 種,分別是動態猝滅和靜態猝滅,2 種方式均可以降低生物大分子的熒光強度。本實驗采用Stern-Volmer方程(1)和Hill方程(2)分析小分子與蛋白的結合作用和熒光猝滅機理。

式中:和分別為猝滅劑加入前后熒光體的熒光強度峰值;[]為猝滅劑濃度/(mol/L);為未加猝滅劑時熒光體的平均壽命/(10s);為Stern-Volmer猝滅常數/(L/mol);為生物分子猝滅速率常數/(L/(mol·s));為表觀結合常數/(L/mol);為結合位點數。

表1 葉黃素與BSA相互作用的常數Table 1 Interaction constants between lutein and BSA
由表1可知,在相同pH值條件下,隨溫度的升高呈現下降的趨勢,且均大于2×10L/(mol?s)(生物分子的最大散射碰撞猝滅常數),說明葉黃素對BSA產生的熒光猝滅類型為靜態猝滅;在相同溫度條件下,也受pH值變化的影響,隨著pH值的增加而上升,當pH 7.4時,最大,與圖2D的結果相互驗證。在2 個溫度下,均在1左右,表明BSA提供一個位點與葉黃素結合。血清白蛋白與藥物的結合常數常在10~10L/mol之間,由表1可知,BSA與葉黃素的結合常數在10~10L/mol數量級,表明葉黃素和BSA的結合能力較強。的值越接近于1,說明數據越精確。
2.3 熱力學性質分析和作用力類型
生物活性小分子與BSA相互作用時,二者之間主要由疏水相互作用、靜電相互作用、范德華力和氫鍵等維持。當溫度不變或溫差較小時,Δ可認為是定值或常數。通過Van’ t Hoff方程(3)和方程(4)計算相關參數,分析其作用力。

式中:、對應(298 K)、(310 K)時葉黃素與BSA的結合常數;Δ為吉布斯自由能變化/(kJ/mol);Δ為熵變/(J/(mol·K));Δ為焓變/(kJ/mol);R為氣體常數,8.314 J/(mol·K)。

表2 葉黃素與BSA相互作用的熱力學參數Table 2 Thermodynamic constants of interaction between lutein and BSA
對于熱力學常數與相互作用力的關系,一般認為,當Δ<0或Δ≈0,Δ>0,靜電相互作用作為結合的主要驅動力;Δ>0,Δ<0時,通過靜電和疏水相互作用結合;Δ<0,Δ<0時,結合的主要驅動力是氫鍵與范德華力;Δ>0,Δ>0時,結合的主要作用力為疏水相互作用。由表2可知,葉黃素與BSA結合時,Δ>0,Δ>0,Δ<0,說明該相互作用,是熵增加、吉布斯自由能升高的吸熱過程,主要作用力是疏水相互作用。在3 種不同pH值條件下,熱力學常數的方向沒有發生變化,說明pH值對二者間的相互作用力和反應類型沒有影響。
2.4 同步熒光光譜的測定
由于蛋白質中含有對微環境敏感的氨基酸,這些氨基酸具有特定的熒光吸收峰,而同步熒光具有選擇性高的特點,故同步熒光光譜常用來評價活性小分子結合作用引起的蛋白質微環境的變化。本實驗通過同步熒光光譜,判斷葉黃素對BSA構象的改變。同步熒光光譜中,Δ=15 nm和Δ=60 nm分別反映酪氨酸(Tyr)殘基和色氨酸(Trp)殘基的特征光譜。
如圖3所示,298 K,當Δ=15 nm時,Tyr殘基的熒光強度依次減弱,在pH 5.2和pH 7.4條件下,對應氨基酸殘基的略微紅移1 nm,pH 3.0時未發生變化;當Δ=60 nm時,在3 個pH值條件下,Trp殘基的均略微紅移1 nm。隨著pH值的逐漸增大,Trp殘基的熒光強度下降更為明顯。由此可以推測,葉黃素與BSA的結合位點在Trp殘基附近,且葉黃素的加入和pH值的影響共同改變了BSA構象。


圖3 298 K條件下pH 3.0(A)、5.2(B)和7.4(C)時葉黃素與BSA相互作用的同步熒光光譜Fig. 3 Synchronous fluorescence spectra of interaction between lutein and BSA at pH 3.0 (A), 5.2 (B), and 7.4 (C) and 298 K
2.5 葉黃素與牛血清白蛋白結合位點分析
BSA的亞結構域IIA(Sudlow’s site I)和亞結構域IIIA(Sudlow’s site II)分別是WARF和IBUP的特異性結合位點。本實驗將IBUP和WARF作為位點Marker,通過競爭性結合實驗,比較猝滅率的變化判斷葉黃素與BSA的結合位點。
由圖4A、B可知,pH 7.4和pH 5.2時,WARF和IBUP的加入,均影響了葉黃素與BSA的相互作用,使得熒光猝滅率下降;但IBUP的加入對葉黃素對BSA的熒光猝滅現象更顯著,進而可推測出葉黃素與BSA的結合位點位于亞結構域IIA和IIIA之間,但更接近于亞結構域IIIA,即Sudlow’s site II附近。
由圖4C可知,pH 3.0時,WARF和IBUP的存在對葉黃素與BSA的熒光猝滅現象沒有顯著影響,結合位點既不在亞結構域IIA附近,也不在亞結構域IIIA附近。說明pH值影響了葉黃素與BSA的結合,pH值不同結合位點也不同。


圖4 298 K條件下pH 7.4(A)、5.2(B)和3.0(C)時IBUP和WARF對葉黃素與BSA結合的影響Fig. 4 Effect of IBUP and WARF on the interaction between lutein and BSA at pH 7.4 (A), 5.2 (B), and 3.0 (C) and 298 K
2.6 分子對接
分子模擬是研究葉黃素與BSA等生物大分子結合位點的有效方法。通Autodock Vina軟件研究葉黃素和BSA的分子對接,最佳構象Δ=-33 kJ/mol,和熒光結果相差不大。由圖5可知,葉黃素與BSA的結合位點位于亞結構域IIA和IIIA之間。此外葉黃素與BSA間的相互作用力以疏水相互作用為主(主要為Leu259、Leu237、Lys187、Arg435等氨基酸殘基形成),其次還有少許氫鍵(主要為Arg256、Ser286、Ala260等氨基酸殘基形成)和靜電相互作用(主要為Tyr149、His241等氨基酸殘基形成)(表3)。這與位點Marker實驗和熱力學性質分析的結果一致。

圖5 葉黃素與BSA的可能結合位點、氨基酸殘基和作用力Fig. 5 Possible binding sites, amino acid residues and interaction forces of lutein and BSA

表3 葉黃素與BSA相互作用的結合位點氨基酸殘基,作用力及吉布斯自由能Table 3 Amino acid residues, binding force and Gibbs free energy of the interaction between lutein and BSA
3 結 論
采用熒光光譜法,研究在pH 7.4、5.2、3.0條件下葉黃素與BSA的相互作用。結果表明,在3 種pH值條件下,葉黃素對BSA均產生熒光猝滅效應。通過熒光猝滅機理分析,該猝滅類型屬于靜態猝滅,且在pH 7.4時,猝滅效應最為明顯,同時結合常數達到10數量級,由此說明在生理條件下葉黃素與BSA更易結合;經熱力學分析可知,二者結合作用力主要是疏水相互作用;同步熒光結果表明,葉黃素的加入和pH值的影響共同改變了BSA的構象;位點競爭實驗和分子對接技術結果顯示,葉黃素與BSA的結合位點受pH值的影響。實驗結果表明,pH值的變化影響了葉黃素與BSA的結合,且pH值的增加促進了二者的結合,這對于在分子水平上認識葉黃素與BSA相互作用的機理,以及BSA蛋白基載體的開發提供了實驗依據。

