伴嚴重瘙癢的周圍神經高興奮綜合征臨床及電生理研究
陳 琳, 陳 娜, 王 穎, 翦 凡, 張 磊, 楊 碩, 張在強, 潘 華
周圍神經過度興奮綜合征(peripheral nerve hyperexcitability syndrome,PNHS)是以自發或持續的肌肉顫搐、痙攣為主要表現的罕見周圍神經綜合征[1]。其中,原發性的PNHS,主要包含 Isaacs 綜合征(Isaacs syndrome)、Morvan 綜合征(Morvan syndrome)和痙攣-束顫綜合征(cramp-fasciculation syndrome,CFS),患者除運動系統的高興奮性癥狀外,多伴有自主神經功能障礙,部分患者出現失眠或輕度精神認知癥狀,除疼痛外,其他感覺異常并不多見[2~4]。
在此,我們報道我院收治的2例伴嚴重瘙癢的PNHS患者,總結其臨床特點、診療經過及隨訪轉歸,結合文獻予以分析討論。旨在提高臨床醫師對該病的認識,以及時有效地診治。
1 資料和方法
研究對象為2019年于首都醫科大學附屬北京天壇醫院就診的2例伴嚴重瘙癢的PNHS患者。收集患者的臨床資料,包括臨床表現、血清學指標、電生理表現及治療、隨訪情況,同時結合文獻進行回顧性分析。
2 結 果
例1,男,60歲。因雙下肢肌肉不自主抽動、疼痛2 m伴難以忍受的瘙癢1 m,2019年9月就診我院。患者2019年7月無明顯誘因出現雙小腿肌肉不自主抽動,伴刀割樣疼痛,活動后加重,休息不能緩解,睡眠中可也可出現上述表現;起病1 m后出現雙下肢瘙癢,無明顯皮疹,搔抓不可緩解,因瘙癢無法入睡。就診前10 d出現磨牙。患者發病初期多汗,后睡眠質量差、大便干燥、小便次數增多。患者曾于2014年、2018年分別行胸腺瘤切除術,術后化療4次,具體用藥不詳。
查體除雙下肢皮膚明顯抓痕、結痂,部分肌群可見顫搐現象,余未見異常。患者發病初期多汗,就診時皮膚未見明顯潮濕或干燥,皮膚劃痕征陰性。
肌電圖檢查(2019年9月)示:運動神經傳導檢測于左側正中神經、尺神經及雙側脛神經可見復合肌肉動作電位(compound muscle action potential,CMAP,M波)后發放電位(見圖1 A,C,E,G),感覺神經傳導檢測正常。針極肌電圖檢查于左側三角肌、肱二頭肌、腓腸肌和右側脛前肌可見束顫、三聯束顫及肌顫搐電位。四肢交感皮膚反應(sympathetic skin response,SSR)未引出。
患者中年男性,亞急性起病,病情進展加重。表現為雙下肢疼痛伴肌肉不自主跳動,病程中存在自主神經癥狀,既往胸腺瘤病史,肌電圖運動神經傳導可見M波后發放電位、針極肌電圖可見束顫及肌顫搐電位,考慮診斷神經性肌強直,病因考慮獲得性可能性大,需排除自身免疫相關、腫瘤相關。患者此次胸部CT未見胸腺瘤復發,腫瘤標志物未見明顯異常。血清及腦脊液神經元抗原抗體譜未見異常。電壓門控鉀通道(voltage-gated potassium channel,VGKC)相關抗體檢查提示血清學CASPR2抗體陽性(1∶320)、LGI1抗體陽性(1∶32),腦脊液相關抗體陰性。
患者自免腦相關抗體陽性,且存在失眠、情緒低落,考慮診斷Movan綜合征,但腦電圖及頭顱MRI未見明顯異常。認知評估簡易智力狀態檢查量表27分/30分,蒙特利爾認知評估量表17分/30分(大專學歷),存在中度認知功能障礙(視空間及執行功能、注意力、延遲回憶受損明顯)。漢密爾頓抑郁量表21分,漢密爾頓焦慮量表21分,存在明顯的焦慮抑郁。匹茲堡睡眠質量指數14分,睡眠受損;多導睡眠監測提示快動眼睡眠行為障礙。最終診斷為Morvan 綜合征,抗CASPR2/LGI-1抗體相關自身免疫性腦炎[4,5]。
予以靜脈注射丙種球蛋白(IVIG)0.4 g/(kg·d)治療5 d后,患者雙下肢瘙癢明顯緩解,VAS自評分由治療前7分降為1分。但肌顫搐及磨牙癥狀同前。繼以靜脈注射甲潑尼龍1000 mg/d沖擊治療3 d后,患者上肢(肱二頭肌及三角肌)肌肉顫搐緩解,但仍有下肢腓腸肌顫搐存在。甲潑尼龍減量至500 mg/d治療3 d、240 mg/d治療3 d、120 mg/d治療3 d后改為口服潑尼松片維持治療。病程中應用氯硝西泮、加巴噴丁及文拉法辛進行對癥治療。2 m后患者所有癥狀消失。
復查肌電圖(2019年11月):上肢正中神經、尺神經M波后發放電位消失(圖1 B,D),雙側脛神經M波后發放電位較前減輕(圖1 F,H);針極肌電圖檢查左側三角肌及肱二頭肌未見束顫及肌顫搐電位發放;四肢交感皮膚反應可引出。
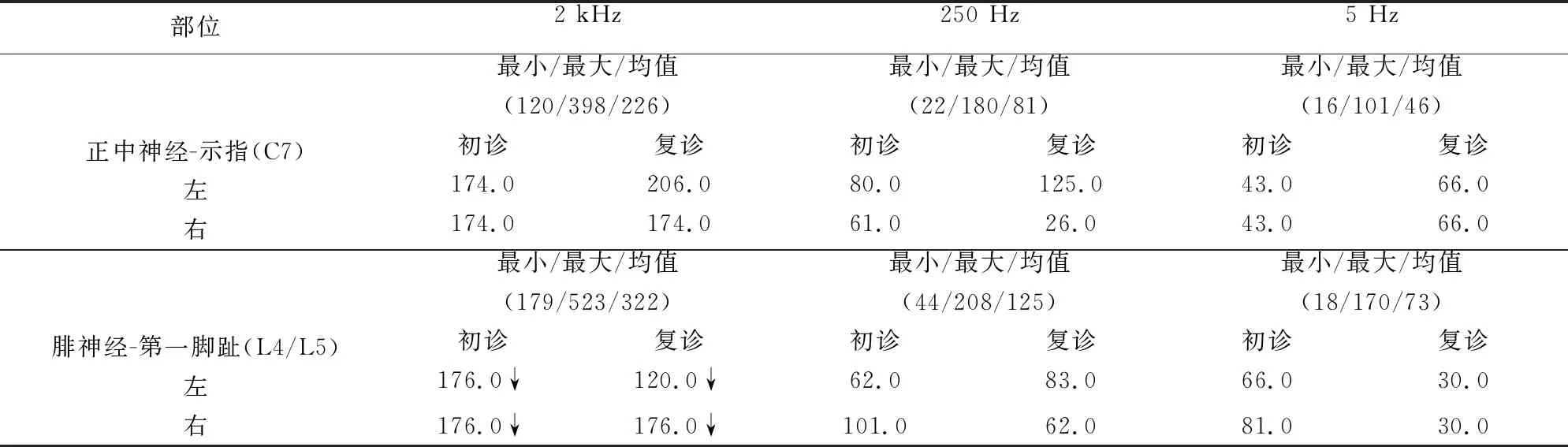
圖1 患者1治療前后的M波后發放電位
例2,女,37歲。于2019年9月無明顯誘因出現雙下肢脹痛,同時伴有下腹部及會陰部瘙癢,無明顯皮疹,搔抓不可緩解,自述難以忍受,無法入睡。次日進展為全身酸痛,行走后雙下肢酸痛加重。1 m后出現雙小腿肌肉顫搐,運動后加重,并出現便秘及小便費力;就診前半月出現雙下肢燒灼感及蟻行感,持續不緩解,伴有多汗。于2019年11月于我院就診,自發病以來精神差,睡眠差,體重減輕5 kg。查體可見皮膚潮濕,下腹部明顯紅色抓痕,雙下肢近端、遠端肌肉顫搐,其他無異常。
肌電圖檢查(2019年11月):神經傳導檢測未見異常,雙側脛神經及右側尺神經F波檢測未見M波及F波后發放電位;針極肌電圖檢查右側三角肌,雙側腓腸肌靜息時可見束顫、多聯束顫和肌顫搐電位;SSR波幅降低。CPT檢測提示2000 Hz電流刺激感覺神經纖維閾值降低(見表1)。
患者中年女性,急性起病,進展性病程。表現為感覺異常、肌肉顫搐及出汗增多,肌肉抽搐于清醒和睡眠時均存在,結合肌電圖考慮神經性肌強直。獲得性神經性肌強直常與腫瘤及自身免疫疾病有關,患者CASPR2抗體陽性,血清神經元抗體譜抗Yo抗體弱陽性。肺部CT發現殘存胸腺組織,但腫瘤標志物及PET-CT未見明顯異常,頭顱MRI及腦脊液檢查均正常。婦科檢查排除生殖系統感染所致會陰部瘙癢。
最終診斷為Isaacs 綜合征[6,7],予以IVIG 0.4 g/(kg·d)治療5 d后,患者癥狀改善不明顯,會陰部瘙癢嚴重,難以入睡,繼以靜脈注射甲潑尼龍1000 mg/d沖擊治療2 d后癥狀逐漸緩解,VAS自評分由10分改善為3分。甲潑尼龍減量至500 mg/d治療3 d、240 mg/d治療3 d、120 mg/d治療3 d后,口服甲潑尼龍及硫唑嘌呤維持治療。患者病程中應用氯硝西泮、卡馬西平、加巴噴丁及度洛西汀進行對癥治療。患者癥狀逐漸好轉,1 m后疼痛及瘙癢感消失,但偶有雙側小腿肌肉抽動。于2020年8月復診,復查CASPR2抗體陰性。肌電圖檢查(2020年8月):神經傳導及針極肌電圖檢測均未見異常,SSR正常。CPT檢測仍提示2000 Hz電流刺激感覺神經纖維閾值降低。
3 討 論
2例患者臨床表現相似(見表2),病程中均出現肢體肌肉顫搐、疼痛,出汗、二便異常、睡眠障礙,以及焦慮不安等情緒改變,并伴有顯著瘙癢;病例2還出現雙下肢皮膚的蟻走感。這種涵蓋感覺異常的周圍神經高興奮綜合征在臨床并不多見。

表2 患者的臨床及實驗室資料

注:治療前左側正中神經(A)、左側尺神經(C)、左側脛神經(E)及右側脛神經(G)均可見M波后發放電位的存在,F波無法辨認。治療后,正中神經(B)與尺神經(D)M波后發放電位消失,F波可辨認。脛神經(F、H)M波后發放電位仍存在,但較前緩解
瘙癢是一種引起患者強烈搔抓的感覺體驗,通常由皮膚疾病或系統疾病造成,神經功能異常及心理疾病亦可引起瘙癢[8]。神經病理性癢為神經系統功能異常造成,中樞神經系統或周圍神經系統均可參與其中[9]。癢的傳遞有其特定的神經通路[10],神經性瘙癢可由其感覺神經通路上任何部位的異常所引起[11]。以往研究認為無髓鞘的C纖維是調節癢感覺的主要纖維[9],而隨著研究進展發現,粗髓鞘的A纖維也參與到癢感覺的獲取[12]。本研究中兩例患者周圍神經的遠端感覺神經傳導檢測均正常,不能解釋其嚴重瘙癢表現,但SSR存在不同程度的受累,提示與以往研究C類纖維受累相符;另外病例2 CPT檢測雙下肢感覺神經纖維2000 Hz電流刺激閾值降低,提示Aβ粗有髓感覺纖維興奮性升高,可能參與到該患者瘙癢的形成,這是常規感覺神經傳導檢測所不能體現的。
近年來研究顯示,感覺神經元的敏化參與到瘙癢的形成。神經細胞中瞬時受體電位通道(transient receptor potential channel,TRPC)A1(TRPA1)和V1(TRPV1)與瘙癢關系緊密,其開放引起Ca2+內流,調節神經興奮性[13]。TRPV1主要介導組胺性瘙癢,其治療主要應用抗組胺藥;而TRPA1主要介導非組胺性瘙癢,與其他炎癥介質的釋放有關[14]。加巴噴丁可通過調節電壓門控的鈣離子通道減少Ca2+內流,降低神經的興奮性,但本文兩例患者單獨使用加巴噴丁并不能很好改善瘙癢癥狀。
另外,由于K通道在穩定神經元膜電位和調節神經元興奮性方面的重要作用,研究發現背根神經節(dorsal root ganglia,DRG)神經元的K通道參與神經性瘙癢。敲除實驗動物DRG神經元中特定K通道的必須亞基[15]或抑制特定K通道的功能[16]均可通過提高DRG神經元的興奮性誘發瘙癢。那么,CASPR2作為VGKC功能復合體的重要組成,其抗體是否可能造成傳遞癢的感覺神經元興奮性升高呢?
最新研究表明,CASPR2抗體可以直接作用于DRG神經元的CASPR2胞外段,從而阻斷VGKC復合體的形成,下調神經元胞膜上電壓門控K通道亞基1(Kv1)的表達,從而上調DRG神經元興奮性[17],并最終造成脊髓背角的中樞敏化。同時,既往研究在探討咪喹莫特所致嚴重瘙癢的機制中發現,其可抑制小鼠DRG神經元Kv1的功能[18]。因此,我們推測CASPR2抗體可能同樣敏化DRG中傳遞癢的神經元,從而引發嚴重瘙癢。病例2中Aβ粗有髓纖維感覺興奮閾值降低,可能是DRG中相應大直徑神經元敏化的結果。
CASPR2抗體所致K通道的異常同樣介導了運動神經的高興奮。由于神經軸突末端缺乏髓鞘保護且血-神經屏障薄弱[19],因而CASPR2更易與其抗體結合,下調VGKC復合體在運動神經軸突末端的表達[20],電生理上表現為M波后發放電位,臨床上因放電頻率的不同表現為肌肉顫搐、痙攣或僵直。本研究兩例患者均出現肌肉顫搐。
LGI1是一種神經元分泌蛋白,主要分布在中樞神經系統海馬及顳葉皮質,參與突觸前膜VGKC向突觸后膜傳遞抑制信號,LGI1抗體干擾其功能影響神經元抑制信號的突觸傳遞,最終引起神經元興奮性增高[21,22]。病例1可檢出LGI1抗體,臨床表現存在中樞神經系統的失眠、記憶力減退和認知障礙等。
以往也有研究發現有疼痛表現的CASPR2抗體陽性的Morvan綜合征患者,存在小纖維神經受累的證據[23],另外在小纖維神經病(small fiber neuropathy,SFN)的研究中也發現,有50%的患者存在CASPR2抗體陽性[24]。這與本文兩例患者SSR異常相一致。
關于兩例患者治療和隨訪,病例1既往診斷并治療胸腺瘤,病例2可見殘留胸腺。本病和胸腺瘤及自身免疫障礙有一定的關系。本研究兩例患者對免疫治療反應較好與文獻報道一致[25]。該兩例患者瘙癢、疼痛、自主神經癥狀及運動神經高興奮性的表現在IVIG及類固醇激素治療后緩解或消失,繼續行免疫抑制治療后達到進一步改善。
綜上所述PNHS的表現形式多樣,可有周圍運動、感覺神經高興奮性的表現如肌肉顫搐、疼痛等及中樞神經系統受累的表現如認知、情緒、睡眠障礙等。以往對該類疾病中的瘙癢研究不足,推測該類患者的瘙癢為神經病理性瘙癢,與CASPR2抗體導致的神經功能異常有關,免疫治療后緩解。早期識別該類患者,及時行血清學相關抗體檢測及肌電圖檢查有助于早期診斷和治療。

