高溫與碳化對鋁酸鹽水泥水化產物氯離子結合穩定性的影響
陳鈺婷,王中平,2,彭 相,朱哲譽,徐玲琳,2,*
(1.同濟大學 材料科學與工程學院,上海 201804;2.同濟大學先進土木工程材料教育部重點實驗室,上海 201804)
氯鹽腐蝕是導致海洋環境中鋼筋混凝土結構耐久性降低的重要原因[1-2].氯離子進入水泥基材料后,或與某些水泥相反應形成Friedel′s鹽(C3A·CaCl2·10H2O),抑或被吸附于水化產物或者孔壁上,前者稱為氯離子化學結合,后者稱為氯離子物理吸附[3].研究表明,水泥漿體對氯離子的結合利于改善結構的抗氯離子腐蝕性[3-4].但硬化水泥石中易結合氯離子的主要礦物相具有不穩定性,在高溫或碳化作用下,非穩定結合的氯離子或被釋放,造成再次腐蝕風險,這在硅酸鹽水泥體系中已得到驗證.例如,升溫使硅酸鹽水泥石的氯離子結合量逐漸增加[5-6],而過高溫度又致使其降低[7];低氯鹽濃度條件下,升溫導致氯離子結合量降低,而高氯鹽濃度條件下相反[8];碳化不但使水化產物喪失氯離子結合能力,而且導致Friedel′s鹽溶解[9-13],對水泥石的氯離子結合起負面作用.
鋁酸鹽水泥(calcium aluminate cement,CAC)的水化產物具有優異的化學結合氯離子能力[4,14],有望用于海洋工程.然而,CAC水化過程受溫度影響顯著,其水化產物CAH10和C2AH8在高溫下易轉變為穩定的C3AH6[15-16],降低了CAC的氯離子結合穩定性.近年來,圍繞CAC水化產物的物相穩定性提升開展了系統研究.如Falzone等[17]和姚燕等[18]發現,硝酸鈣改性CAC漿體中會生成吉布斯自由能更低的NO3-AFm(C3A·Ca(NO3)2·10H2O),可避免界穩相水化產物轉變,有效抑制CAC強度倒縮;但高溫及碳化可能導致物相轉變.由此可見,關于CAC的氯離子結合穩定性仍缺乏研究.
鑒于此,本文結合CAC的水化特性,利用pH計、X射線衍射儀(XRD)、掃描電鏡(SEM)探究了高溫和碳化作用對CAH10、C2AH8、C3AH6和NO3-AFm這4種典型CAC水化產物與氯離子結合穩定性的影響,綜合評估了CAC的氯離子結合性能,以期為CAC在氯鹽腐蝕環境中的安全高效利用提供理論基礎和數據支撐.
1 試驗
1.1 原材料
水泥采用益瑞石公司產CAC(商品名Ternal White),其化學組成(文中涉及的組成、水膠比等均為質量分數或質量比)和物理性能分別見表1、2;試驗用水均為去離子水;化學試劑為國藥集團產四水硝酸鈣(Ca(NO3)2·4H2O)和氯化鈉(Na Cl),分析純.

表1 鋁酸鹽水泥的化學組成Table 1 Chemical composition of CAC w/%

表2 鋁酸鹽水泥的物理性能Table 2 Physical property of CAC
1.2 試驗方法
1.2.1 樣品制備
按水膠比2∶1稱取4份去離子水和CAC.其中3份去離子水與CAC攪拌均勻后分別置于5、20、60℃下養護30 d,依次得到CAH10、C2AH8和C3AH6樣品;另1份去離子水中先溶入20%的Ca(NO3)2·4H2O(以CAC質量為基準),再與CAC充分攪拌后在45℃下密封養護30 d,得到NO3-AFm樣品.4種樣品均放入真空干燥箱干燥48 h,然后研磨成粒徑小于48μm的粉末備用,其物相組成見圖1.

圖1 4種樣品的XRD圖譜Fig.1 XRD patterns of four kinds of sample
高溫試驗:先取3份上述4種粉末樣品各5 g,置于1.0 mol/L Na Cl溶液中浸泡120 d,使粉末樣品與氯離子 充 分 結 合 生成Friedel′s鹽——Fs(CAH10)、Fs(C2AH8)、Fs(C3AH6)和Fs(NO3-AFm);再將這4種Fs樣品分別于(20±1)、(60±1)℃下繼續浸泡28 d,洗滌、干燥后備用.
碳化試驗:將(20±1)℃下經NaCl溶液浸泡120 d的Fs(CAH10)、Fs(C2AH8)、Fs(C3AH6)和Fs(NO3-AFm)洗滌、干燥后置于碳化試驗箱((20±1)℃、相對濕度為(65±5)%及質量分數為3.0%的CO2)內養護至規定齡期.
1.2.2 測試方法
CAC水化產物與氯離子的結合量通過樣品浸泡液中的氯離子濃度計算得到,計算表達式[19]為:
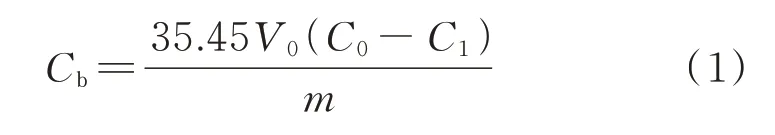
式中:Cb為單位質量樣品的氯離子結合量,mg/g;V0為樣品浸泡液的體積,mL;C0為浸泡液的初始氯離子濃度,mol/L,本文為1.0 mol/L;C1為樣品浸泡液的氯離子濃度,mol/L;m為樣品的質量,g.
采用雷磁ZDJ-4A型自動電位滴定儀測定樣品浸泡液的氯離子濃度C1,每份浸泡液滴定3次,取其平均值作為試驗值.采用METTLER TOLEDO數顯p H計測量樣品浸泡液的p H值,每次測量前,先用p H值為4.00、6.86和9.18的緩沖液進行校準,每個樣品重復測試3次,試驗值取其算術平均值.采用日本Rigaku D/max 2550 X射線粉末衍射儀(XRD在5°~45°進行連續掃描,掃描速率為2(°)/min.利用美國FEI公司產QUANTA 200FEG-ESEM型場發射環境掃描電子顯微鏡(SEM)進行微觀形貌分析,加速電壓為20 k V,采用低真空模式.
2 結果與討論
2.1 高溫對CAC氯離子結合穩定性的影響
2.1.1 浸泡液的氯離子濃度
圖2顯示了相比20℃浸泡,不同Fs樣品在60℃下浸泡于NaCl溶液中28 d后氯離子濃度的增加量.由圖2可以看出,60℃下所有樣品浸泡液中的氯離子濃度均顯著高于20℃時,其中Fs(CAH10)樣品尤為明顯,增長了5.34%,而Fs(C3AH6)樣品增長最少.這表明高溫導致CAC水化產物中已結合的氯離子再次釋放,成為自由氯離子,使得浸泡液中的氯離子濃度增加,從而對CAC水化產物的氯離子結合穩定性產生負面影響.

圖2 不同Fs樣品在60℃下浸泡28 d后氯離子濃度較20℃時的增加量Fig.2 Increment of free chloride concentration in soaking solution of chloride-bound samples at 60℃for 28 d comparing to 20℃
2.1.2 浸泡液的pH值
圖3為20、60℃下不同Fs樣品在Na Cl溶液中浸泡28 d時的pH值.由圖3可見:(1)與初始溶液相比,20℃下4種Fs樣品浸泡液的p H值均有不同程度增加,增幅 由 大到小依 次為Fs(C3AH6)>Fs(C2AH8)>Fs(CAH10)>Fs(NO3-AFm),其中增幅最小的Fs(NO3-AFm)樣品的pH值基本沒有變化.(2)當溫度升至60℃時,除Fs(CAH10)樣品浸泡液的pH值繼續略微增加外,Fs(C2AH8)和Fs(C3AH6)樣品浸泡液的p H值均略微降低,Fs(NO3-AFm)樣品浸泡液的p H值仍無明顯變化.上述結果與圖2所示不同Fs樣品浸泡液中氯離子濃度的變化規律基本一致,浸泡液的pH值增幅隨著自由氯離子濃度的提升而增大.這是由于自由氯離子置換出水化鋁酸鈣內層的OH-,致使孔溶液p H值增加[20-21],但可能由于高溫影響氯離子的物理吸附,溫度過高時浸泡液的p H值變化幅度仍然較小;高溫下Fs(CAH10)樣品的pH值略有升高,可能是由于物理脫附出的自由氯離子數量有所增加,進一步促進其置換出OH-;此外,Fs(NO3-AFm)樣品浸泡液的p H值始終保持穩定,源自其對氯離子的化學結合是其結構中的NO-3直接置換了氯離子,并未涉及游離OH-的釋放[22].
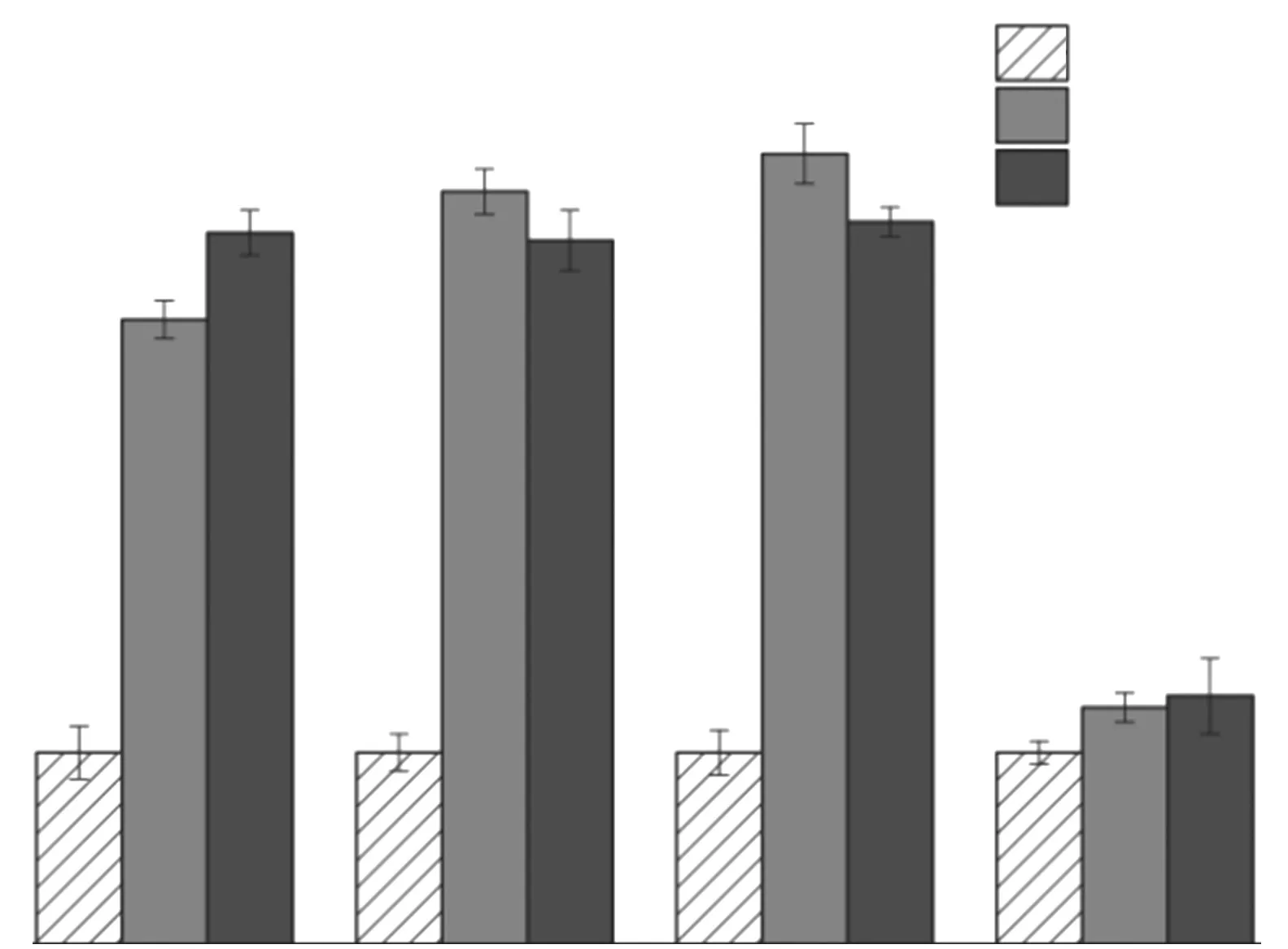
圖3 不同Fs樣品在20、60℃下浸泡28 d時溶液的p H值Fig.3 pH values of soaking solution of chloride-bound samples immersed at 20,60℃for 28 d
2.1.3 水化產物組成
圖4為20、60℃下不同Fs樣品在Na Cl溶液中浸泡28 d時的XRD圖譜.由圖4可知:4種Fs樣品在2種溫度下的水化產物組成基本沒有差異,均以Friedel′s鹽為主;與20℃時相比,60℃下Fs樣品中Friedel′s鹽的衍射峰強度并未減弱,說明高溫下浸泡液中氯離子濃度的增加并非源自Friedel′s鹽溶解,而是物理結合的氯離子解吸附所致,也進一步證實了Fs樣品浸泡液中自由氯離子與p H值變化的結果.
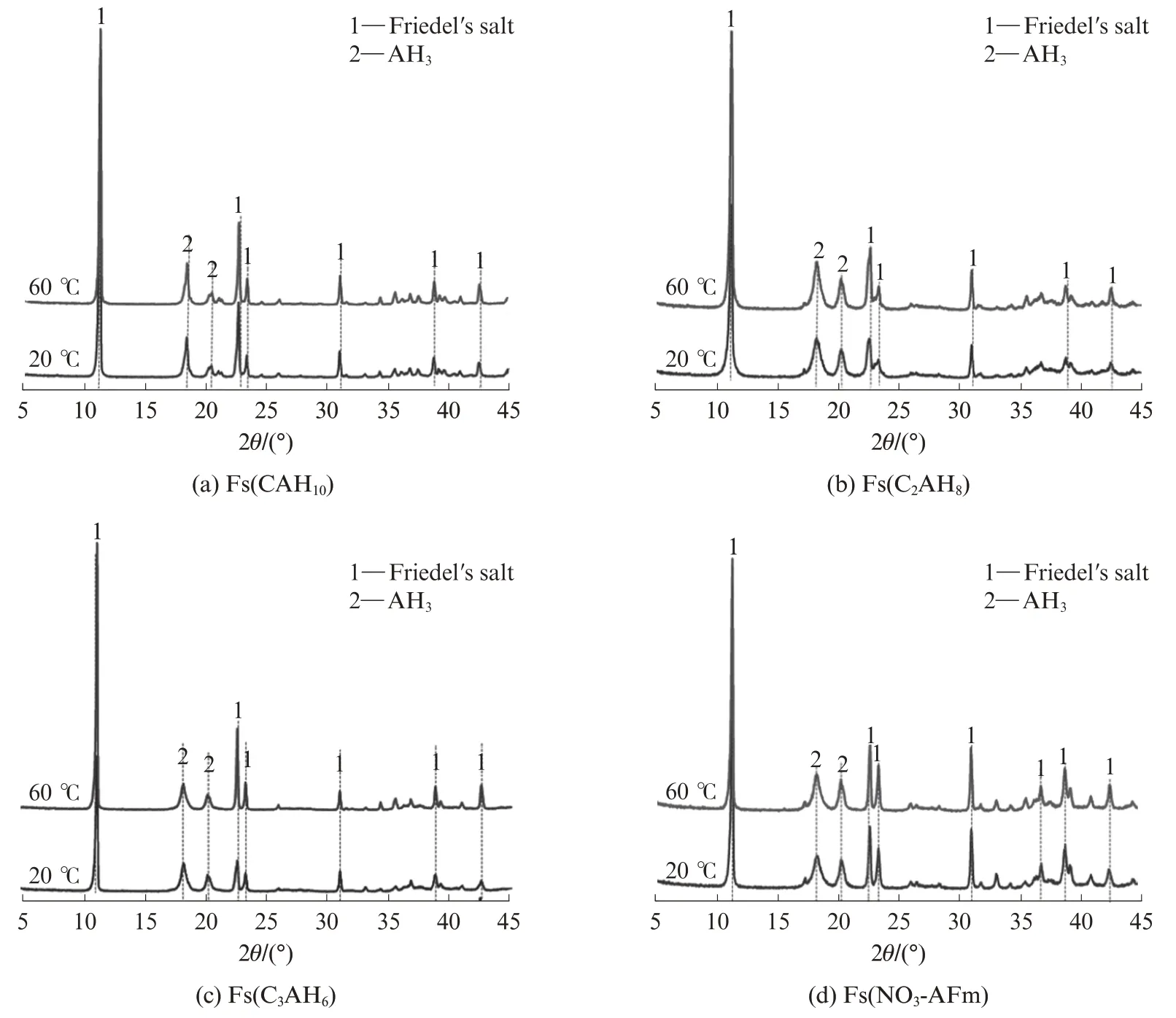
圖4 不同Fs樣品在20、60℃下Na Cl溶液中浸泡28 d時的XRD圖譜Fig.4 XRD patterns of chloride-bound samples soaked in NaCl solutions for 28 d at 20,60℃
2.2 碳化對CAC氯離子結合穩定性的影響
2.2.1 氯離子結合量
圖5為碳化1、3、7 d時不同Fs樣品中自由氯離子濃度的變化.由圖5可見:碳化1 d后,Fs(CAH10)和Fs(C2AH8)樣品中的自由氯離子濃度均較低,而Fs(C3AH6)和Fs(NO3-AFm)樣品中的自由氯離子濃度較高,最高可達68.50×10-3mol/L;碳化3 d后,Fs(CAH10)、Fs(C2AH8)和Fs(C3AH6)樣品中的自由氯離子濃度均大幅增加,而Fs(NO3-AFm)樣品僅略有增加;繼續碳化至7 d時,Fs(CAH10)和Fs(C2AH8)的自由氯離子含量增加仍較為明顯,但增幅較3 d時有所放緩,而Fs(C3AH6)和Fs(NO3-AFm)樣品中的自由氯離子濃度較3 d時基本無變化.由此可見,碳化導致CAC水化產物結合氯離子所形成的Friedel′s鹽溶解生成Ca CO3和鋁膠等物質,造成已結合的氯離子再次被釋放出來,進入Fs樣品孔溶液中,增加了自由氯離子的濃度[23],且碳化時間越長,結合態氯離子轉變為自由氯離子的程度越明顯,與文獻[21,24]結果相符.
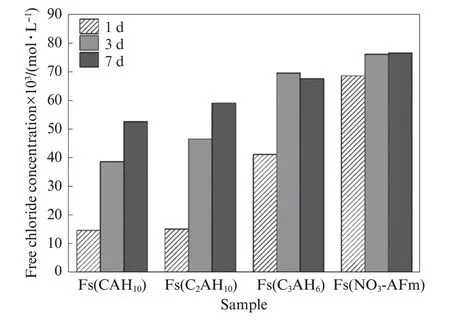
圖5 不同Fs樣品碳化1、3、7 d時的自由氯離子濃度變化Fig.5 Free chloride concentration of chloride-bound samples carbonized for 1,3,7 d
2.2.2 水化產物組成
圖6為不同Fs樣品碳化1、3、7 d時的XRD圖譜.由圖6(a)、(b)可見,碳化1 d時,在Fs(CAH10)和Fs(C2AH8)樣品中只檢測到極弱的CaCO3(方解石、文石和球霰石)衍射信號,可以認為樣品幾乎未被碳化,因而自由氯離子濃度較低;碳化3 d時,CaCO3的衍射強度明顯增強,尤其是方解石,表明樣品已被碳化;碳化7 d后,CaCO3的衍射峰強度繼續增強,且Friedel′s鹽衍射峰強度減弱,說明部分Friedel′s鹽因碳化而被溶解,結合態氯離子被再次釋放,因此樣品中的自由氯離子濃度大幅增加,與圖4結果相符.相比之下,Fs(C3AH6)和Fs(NO3-AFm)樣品(圖6(c))水化產物組成的變化規律基本一致,碳化1 d時即生成了大量以方解石為主的Ca CO3,可見樣品碳化程度較大,這也解釋了圖5中碳化1 d時Fs(C3AH6)樣品和Fs(NO3-AFm)樣品中自由氯離子含量較Fs(CAH10)和Fs(C2AH8)樣品更高的原因.繼續碳化至3 d時,樣品中Friedel′s鹽完全消失,相應方解石的衍射峰強度繼續增強.而碳化7 d時樣品中的水化產物組成與3 d時基本相同,可見樣品早在3 d時就已被完全碳化,這也與圖5中Fs(CAH10)和Fs(C2AH8)樣品碳化3、7 d時的自由氯離子濃度幾乎沒有變化的結果相符.
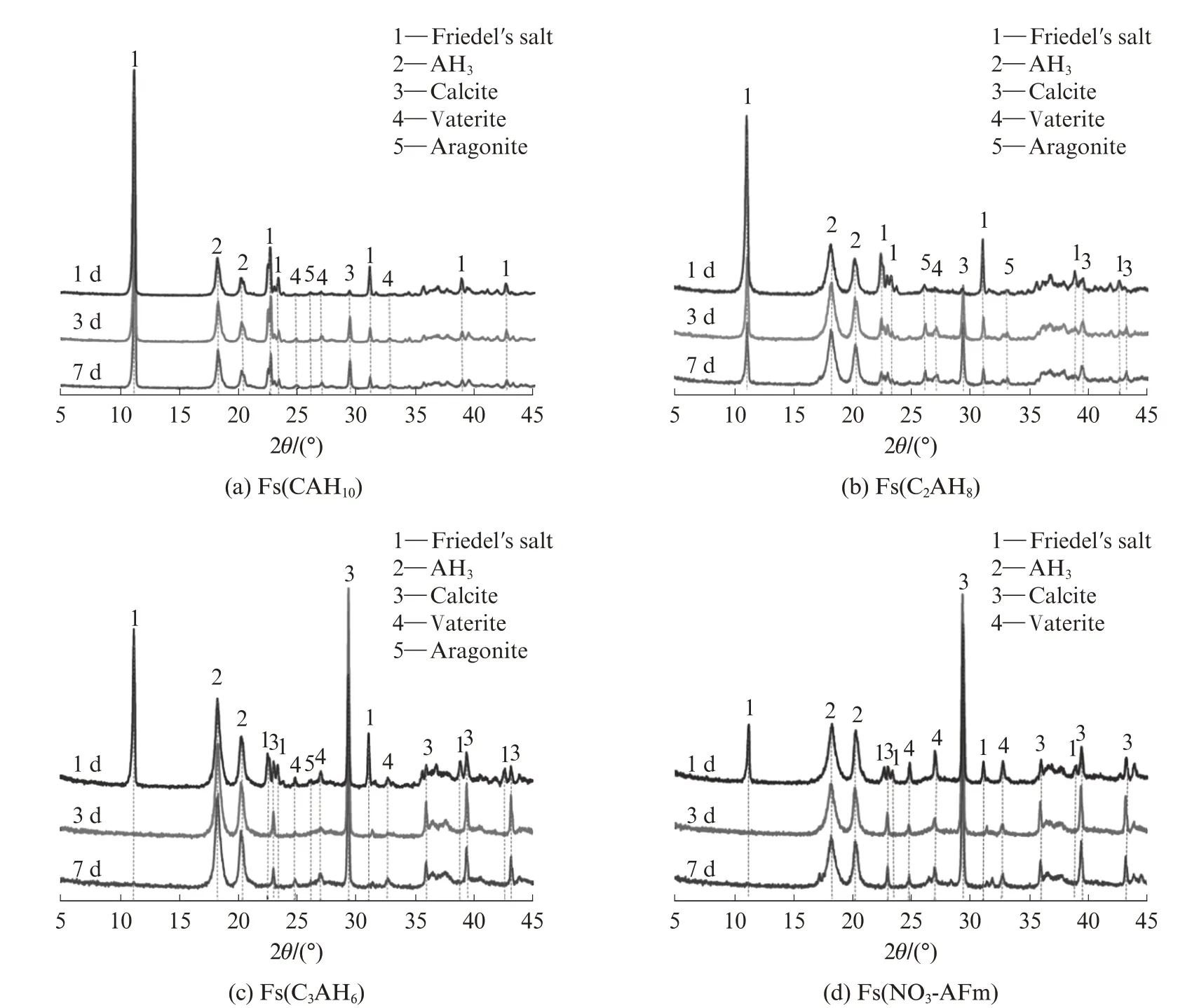
圖6 不同Fs樣品碳化1、3、7 d時的XRD圖譜Fig.6 XRD patterns of chloride-bound samples carbonized for 1,3,7 d
碳化對CAC水化產物的氯離子結合穩定性尤其是化學結合具有負面影響,主要有兩方面原因[24]:一是使樣品孔溶液的p H值降低,引發Friedel′s鹽溶解(3CaO·Al2O3·CaCl2·10H2O+3CO2→3Ca CO3+2Al(OH)3+Ca Cl2+10H2O),使得被結合的氯離子再次釋放,導致孔溶液中的自由氯離子濃度升高;二是C-S-H和C-A-H等水化產物碳化后多形成CaCO3和AH3等水化產物,降低了氯離子結合位點,進而導致水泥基材料的氯離子結合能力大幅降低.結合圖5、6可以看出,Fs(CAH10)和Fs(C2AH8)樣品具有較好的抗碳化性能,而Fs(C3AH6)和Fs(NO3-AFm)樣品的抗碳化性能較差.
2.2.3 微觀形貌
圖7為各Fs樣品碳化7 d時的SEM照片.由圖7可 見:(1)碳化后Fs(CAH10)中呈六方板狀的Friedel′s鹽表面光滑,結構仍較為完整,而在2塊板狀Friedel′s鹽之間可見邊長為2~3μm的方塊狀方解石.(2)碳化后Fs(C2AH8)中六方板狀Friedel′s鹽的輪廓較為模糊,表面因碳化而附著大量方解石和部分球霰石.(3)碳化后Fs(C3AH6)樣品中除了絮凝狀AH3外,其產物基本只有方塊狀的方解石,Friedel′s鹽不復存在,可見其碳化嚴重.(4)碳化后Fs(NO3-AFm)的產物形貌與Fs(C3AH6)基本相同,也是大量方塊狀的方解石被AH3包裹,未發現板狀的Friedel′s鹽,這與圖6中XRD結果一致.由此可見:碳化首先導致Friedel′s鹽的表面溶解,然后在其表面形成大量方解石;隨著碳化程度的加重,Friedel′s鹽被逐漸溶解,結合的氯離子則被釋放出來,導致孔溶液中自由氯離子濃度升高.

圖7 不同Fs樣品碳化7 d時的SEM照片Fig.7 SEM images of chloride-bound samples carbonized for 7 d
3 結論
(1)高溫對CAC漿體的氯離子結合穩定性產生不利影響,導致已結合的氯離子釋放,溶液中的自由氯離子濃度增加;但溫度升高僅影響物理吸附氯離子的結合穩定性,對化學結合穩定性則基本無影響.高溫對以氯離子化學結合為主的Fs(NO3-AFm)樣品無明顯影響,但會導致Fs(CAH10)、Fs(C2AH8)和Fs(C3AH6)樣品中物理吸附的氯離子大幅解吸附.
(2)碳化對CAC漿體的氯離子結合穩定性產生不利影響,導致Friedel′s鹽溶解,并生成以方解石為主的Ca CO3,進而增加漿體中自由氯離子的濃度;且碳化越嚴重,相應的自由氯離子濃度越高.Fs(CAH10)與Fs(C2AH8)的 抗 碳 化 能 力 較 好,而Fs(C3AH6)與Fs(NO3-AFm)的抗碳化能力較差.

