皺紋盤鮑肽聚糖識(shí)別蛋白在免疫防御中的作用*
陳鈺瑩 韓怡靜 劉相全 何金霞 楊頂瓏
皺紋盤鮑肽聚糖識(shí)別蛋白在免疫防御中的作用*
陳鈺瑩1,2,3韓怡靜3劉相全2何金霞2楊頂瓏3①
(1. 上海海洋大學(xué)水產(chǎn)與生命學(xué)院 上海 201306;2. 山東省資源與環(huán)境研究院山東省海洋生態(tài)修復(fù)重點(diǎn)實(shí)驗(yàn)室 山東 煙臺(tái) 264006;3. 中國科學(xué)院煙臺(tái)海岸帶研究所 山東 煙臺(tái) 264003)
本研究從皺紋盤鮑()中鑒定并克隆了一種肽聚糖識(shí)別蛋白(PGRP),命名為HdPGRP。HdPGRP的cDNA全長為1467 bp,共編碼354個(gè)氨基酸,其中含有1個(gè)信號肽(1~18氨基酸)、1個(gè)SH3b結(jié)構(gòu)域(93~160氨基酸)、1個(gè)PGRP結(jié)構(gòu)域(179~322氨基酸)和1個(gè)Ami_2結(jié)構(gòu)域(191~332氨基酸)。此外,在HdPGRP序列中發(fā)現(xiàn)了4個(gè)保守的Zn2+結(jié)合位點(diǎn)(H209、Y255、H318和C330)以及5個(gè)保守的酰胺酶催化位點(diǎn)(H209、Y255、H318、T328和C330)。經(jīng)多序列比對和系統(tǒng)發(fā)育樹分析,表明HdPGRP屬于短型PGRP家族成員。在健康鮑魚中,主要在肝胰腺中表達(dá),其次依次在血細(xì)胞、外套膜和鰓中。在鰻弧菌()刺激后,血細(xì)胞中的表達(dá)量在72 h內(nèi)呈現(xiàn)先上升后下降的趨勢,在24 h表達(dá)量達(dá)到最高。SDS-PAGE結(jié)果顯示,重組HdPGRP (rHdPGRP)的分子量為30 kDa。rHdPGRP表現(xiàn)為Zn2+依賴酰胺酶活性,可催化降解不溶性肽聚糖。此外,rHdPGRP對革蘭氏陽性菌藤黃微球菌()具有顯著的抑制作用,且這種抑制作用可能與其酰胺酶活性有關(guān)。本研究表明,HdPGRP在機(jī)體抵御入侵細(xì)菌等免疫防御中起重要作用。
皺紋盤鮑;肽聚糖識(shí)別蛋白;免疫防御
免疫識(shí)別是先天免疫的第一道防線,通過模式識(shí)別蛋白(pattern recognition proteins, PRPs)結(jié)合微生物表面高度保守的病原相關(guān)分子結(jié)構(gòu),如細(xì)菌中的脂多糖、肽聚糖,真菌中的β-1,3-葡聚糖以及病毒雙鏈RNA等(Huang, 2019; Li, 2020; Rout, 2020)。目前,已在無脊椎動(dòng)物中鑒定出肽聚糖識(shí)別蛋白(peptidoglycan recognition proteins, PGRPs)、C1q結(jié)構(gòu)域蛋白、NOD2、革蘭氏陰性菌結(jié)合蛋白、含硫酯鍵蛋白、Toll樣受體、脂多糖和(或)β-1,3葡聚糖結(jié)合蛋白和清道夫受體等多種PRPs,它們對入侵病原微生物的免疫識(shí)別及應(yīng)答起重要作用(曹丹丹等, 2018; Wang, 2013; Gerdol, 2015)。
PGRPs首次在家蠶()的血淋巴和角質(zhì)層中被鑒定,它能特異性結(jié)合肽聚糖,并觸發(fā)酚氧化酶級聯(lián)反應(yīng)(Li, 2020)。隨后,在果蠅()中成功克隆出PGRP后,其他無脊椎動(dòng)物的PGRPs也相繼被鑒定克隆(Hu, 2020)。在結(jié)構(gòu)上,PGRP包含一個(gè)保守的肽聚糖結(jié)合2型酰胺酶結(jié)構(gòu)域,也被稱為PGRP結(jié)構(gòu)域,它能夠水解N-乙酰胞壁酸(N-acetylmuramic)和L-丙氨酸(L-alanine)之間的酰胺鍵,以達(dá)到抗菌目的(Zaidman- Rémy, 2006; Mellroth, 2006)。根據(jù)PGRPs分子量及結(jié)構(gòu)的不同,可將其分為短型(PGRP-S)、中間型(PGRP-I)和長型(PGRP-L) 3類(Dziarski, 2004)。PGRPs在抵御病原菌的先天免疫中具有多種功能,其中,識(shí)別并結(jié)合細(xì)菌肽聚糖是其最基本的功能(Yang, 2010)。另外,PGRPs可作為免疫識(shí)別蛋白激活免疫通路(Wei, 2018),通過誘導(dǎo)細(xì)菌的氧化應(yīng)激、硫醇應(yīng)激和金屬應(yīng)激等作為直接殺菌劑(Kashyap, 2014; Hu, 2020),此外,PGRPs可作為調(diào)理素來誘導(dǎo)凝集或吞噬作用(Coteur, 2007; Yang, 2019)。
皺紋盤鮑()是我國重要的海水養(yǎng)殖經(jīng)濟(jì)貝類,主要分布在遼東半島和山東半島(姜向陽等, 2021)。自20世紀(jì)80年代以來,由于病原菌入侵,尤其是弧菌的感染造成人工養(yǎng)殖和野生鮑魚出現(xiàn)大規(guī)模死亡,其中鰻弧菌()通過產(chǎn)生熱穩(wěn)定和熱不穩(wěn)定的毒素使宿主發(fā)病,導(dǎo)致全球鮑魚產(chǎn)量大幅下降(王瑞旋等, 2006; 何婷婷, 2018; 吳富村等, 2020)。因此,研究免疫相關(guān)分子的特性對鮑魚養(yǎng)殖業(yè)的疾病控制和健康管理具有重要意義。迄今為止,已在軟體動(dòng)物中鑒定出100多種PGRPs,如大竹蟶()中的SgPGRP-S1 (Wei, 2018),仿刺參()中的AjPGRP-S (Hu, 2020)。然而,目前對鮑魚中PGRP功能的認(rèn)識(shí)還很有限。本研究從皺紋盤鮑中鑒定了一種PGRP (命名為HdPGRP),并對其組織分布、入侵病原菌時(shí)的轉(zhuǎn)錄表達(dá)模式、抗菌活性等進(jìn)行研究,以更好地了解鮑魚對病原體入侵的免疫應(yīng)答反應(yīng)。
1 材料與方法
1.1 鮑魚選取及細(xì)菌刺激
選取平均殼長為60 mm的皺紋盤鮑,在海水中馴養(yǎng)1周(20℃~22℃),將300只鮑魚平均分為6組。其中3組分別用鰻弧菌(1×107CFU/mL)進(jìn)行浸泡刺激,每組分別在0、3、6、12、24、48和72 h時(shí)隨機(jī)選6個(gè)個(gè)體抽取血淋巴,2600 r/min離心10 min,獲得血細(xì)胞。另外3組為對照組,每組隨機(jī)選取6個(gè)個(gè)體,取血細(xì)胞、外套膜、鰓、肝胰腺和肌肉進(jìn)行的組織特異性表達(dá)分析。
1.2 總RNA的提取及cDNA的合成
使用TRIzol (Invitrogen, 美國)從鮑魚血細(xì)胞、外套膜、鰓、肝胰腺和肌肉中提取總RNA,1.0%瓊脂糖凝膠電泳檢測RNA質(zhì)量后,用2 μg總RNA和0.5 mmol/L Oligo (dT) 70℃熱變性5 min后逆轉(zhuǎn)錄合成cDNA。反應(yīng)體系(25 μL):已完成變性的RNA,5 μL dNTPs,1 μL RNase抑制劑(Promega, 美國),1 μL M-MLV逆轉(zhuǎn)錄酶(Promega, 美國)以及5 μL 5×M- MLV反應(yīng)緩沖液,加無RNA酶水至25 μL。
1.3 hdpgrp基因的克隆
通過對本實(shí)驗(yàn)室構(gòu)建的皺紋盤鮑cDNA文庫中EST序列進(jìn)行BLAST分析,得到皺紋盤鮑肽聚糖識(shí)別蛋白的EST序列。以P1、P2為正向引物(表1),Oligo (dT)為反向引物,進(jìn)行巢式PCR擴(kuò)增的3′端。步驟如下:加入聚合酶延長變性(94℃ 5 min);94℃ 50 s,58℃ 45 s,72℃ 30 s,35次循環(huán)擴(kuò)增;PCR產(chǎn)物經(jīng)凝膠純化后,連接到pMD18-T載體(TaKaRa, 大連)進(jìn)行測序。將原始EST序列與擴(kuò)增片段重疊得到的全長cDNA。
表1 實(shí)驗(yàn)所用引物

Tab.1 Primers used in this study
1.4 生物信息學(xué)分析
用BLAST算法對的cDNA序列進(jìn)行分析,并通過ExPASy (expert protein analysis system)推導(dǎo)出蛋白序列進(jìn)行分析。使用SMART (simple modular architecture research tool)預(yù)測蛋白結(jié)構(gòu)域。采用ClustalW軟件進(jìn)行多序列比對。利用MEGA 4.0軟件的鄰位連接(neighbor-joining, NJ)算法構(gòu)建系統(tǒng)發(fā)育樹(重復(fù)1000次)。
1.5 hdpgrp mRNA的轉(zhuǎn)錄表達(dá)
采用實(shí)時(shí)熒光定量PCR (qRT-PCR)技術(shù)分析mRNA的轉(zhuǎn)錄表達(dá)。用基因特異性引物(P3、P4, 表1)擴(kuò)增片段,-actin作為內(nèi)參基因,以1.2所合成的cDNA為模板,使用7500 Fast Real-time PCR系統(tǒng)(Applied Biosystems, 美國)進(jìn)行qRT-PCR。反應(yīng)程序:94℃,5 min變性;94℃ 50 s,60℃ 60 s,72℃ 50 s循環(huán)40次,72℃延伸10 min。用2–ΔΔCt法分析mRNA的相對表達(dá)水平(Livak, 2001)。所有數(shù)據(jù)以mRNA相對表達(dá)量的平均值±標(biāo)準(zhǔn)差(Mean±SD,=6)表示,采用SPSS 16.0軟件對所得數(shù)據(jù)進(jìn)行統(tǒng)計(jì)學(xué)分析,<0.05為具有顯著性差異。
1.6 HdPGRP的重組表達(dá)
用一對特異性引物(P7和P8, 表1)擴(kuò)增,然后將PCR產(chǎn)物克隆到pEASY-blunt E1表達(dá)載體(Transgen Biotech, 中國)。在大腸桿菌() BL21 (DE3)中表達(dá)重組質(zhì)粒,經(jīng)IPTG誘導(dǎo)后,用15% SDS-PAGE檢測蛋白表達(dá)結(jié)果。重組蛋白HdPGRP (rHdPGRP)用Ni2+螯合Sepharose柱純化,然后用梯度尿素-TBS甘油緩沖液(10%甘油, 2 mmol/L還原型谷胱甘肽,0.2 mmol/L氧化型谷胱甘肽,50 mmol/L NaCl, 50 mmol/L Tris-HCl, pH 8.0)透析復(fù)性。用BCA法測定重組蛋白的濃度(Smith, 1985)。
1.7 酰胺酶活性
參照Mellroth等(2003)的方法測定rHdPGRP對肽聚糖的相對酶活性。將不溶于水的肽聚糖(來自金黃色葡萄球菌, 1 mg/mL)分別溶解于HEPES緩沖液(20 mmol/L, pH 7.2, 150 mmol/L NaCl),HEPES-ZnCl2緩沖液(20 mmol/L, pH 7.2, 150 mmol/LNaCl, 10 mmol/L ZnCl2)和HEPES-ZnCl2EDTA緩沖液(20 mmol/L, pH 7.2, 150 mmol/L NaCl, 10 mmol/LZnCl2, 10 mmol/L EDTA)并加入rHdPGRP (50 μg/mL),其中以PBS緩沖液作為陰性對照。在120 min內(nèi)每隔15 min檢測OD540 nm值。
1.8 rHdPGRP的抑菌活性
將藤黃微球菌()培養(yǎng)至對數(shù)期,用培養(yǎng)基稀釋至1.0?×?107CFU/mL。在100 μL的細(xì)菌懸液中加入rHdPGRP (終濃度為100 μg/mL),設(shè)含10 mmol/L ZnCl2和不含ZnCl22組。無rHdPGRP的細(xì)胞懸液作為陰性對照。220 r/min,37℃振蕩培養(yǎng),每隔1 h測定OD600 nm值。
2 結(jié)果
2.1 hdpgrp的cDNA克隆及序列分析
的cDNA全長為1467 bp,共編碼354個(gè)氨基酸,在GenBank數(shù)據(jù)庫中編號為MZ150581。通過ExPASy分析,HdPGRP含有1個(gè)糖基化位點(diǎn)(N133),用SMART軟件預(yù)測,HdPGRP含有1個(gè)信號肽(1~18氨基酸)、1個(gè)SH3b結(jié)構(gòu)域(93~160氨基酸)、1個(gè)PGRP結(jié)構(gòu)域(179~322氨基酸)和1個(gè)Ami_2結(jié)構(gòu)域(191~332氨基酸) (圖1),說明HdPGRP可能分泌到細(xì)胞外識(shí)別并結(jié)合肽聚糖。多序列比對分析結(jié)果表明,HdPGRP與太平洋牡蠣() (58%, XP_034310518)和光滑雙臍螺() (55%, NP_001298227)的PGRPs之間具有高度相似性,且HdPGRP有4個(gè)保守的Zn2+結(jié)合位點(diǎn)(H209、Y255、H318和C330)以及5個(gè)保守的酰胺酶催化位點(diǎn)(H209、Y255、H318、T328和C330) (圖2)。采用MEGA 4.0軟件的鄰接法構(gòu)建的系統(tǒng)發(fā)育樹顯示,PGRPs分為3個(gè)分支:短型PGRPs (PGRP-S)、中長型PGRPs (PGRP-I)和長型PGRPs (PGRP-L),HdPGRP與太平洋牡蠣等其他海洋無脊椎動(dòng)物的PGRPs聚于短型PGRPs (圖3)。
2.2 hdpgrp的組織表達(dá)及在鰻弧菌刺激后血細(xì)胞中的表達(dá)
利用qRT-PCR技術(shù)對鮑魚各組織中轉(zhuǎn)錄表達(dá)進(jìn)行分析。在所有被檢測的組織中均有表達(dá),其中,主要分布于肝胰腺,其次為血細(xì)胞、外套膜和鰓,在肌肉中表達(dá)量最低(圖4)。在鰻弧菌刺激后,血細(xì)胞中表達(dá)量在3—48 h內(nèi)顯著升高(<0.01),并在24 h時(shí)達(dá)到最大值,是對照組的9.4倍(<0.01),隨后,表達(dá)量下降,在72 h時(shí),水平與對照組相比無顯著差異,說明表達(dá)恢復(fù)至正常水平(圖5)。

圖1 HdPGRP核酸及推導(dǎo)的氨基酸序列
加粗:起始密碼子和終止密碼子;方框:糖基化位點(diǎn);下劃線:信號肽;深灰色陰影:SH3b結(jié)構(gòu)域;波浪線:PRGP結(jié)構(gòu)域;淺灰色陰影:Ami_2結(jié)構(gòu)域。
Bold: Initial codon and termination codon; Box: Glycosylation sites; Underline: Signal peptide; Dark grey shadow: SH3b domain; Wave line: PRGP domain;Light gray shadow: Ami_2 domain.
2.3 rHdPGRP蛋白的制備
用IPTG對含HdPGRP重組質(zhì)粒的表達(dá)菌株BL21(DE3)進(jìn)行誘導(dǎo)表達(dá),SDS-PAGE顯示,位于30 kDa處出現(xiàn)1條與預(yù)期重組蛋白大小一致的條帶。經(jīng)Ni2+螯合瓊脂糖柱純化并復(fù)性后的rHdPGRP蛋白條帶單一,約30 kDa (圖6)。
2.4 酰胺酶和抗菌活性測定
酰胺酶活性是PGRP水解不溶性肽聚糖的N-乙酰胞壁酸和L-丙氨酸之間肽鍵,從而降解肽聚糖的一種活性。結(jié)果顯示,在Zn2+存在的情況下,rHdPGRP對肽聚糖顯示出較高的降解活性,在120 min內(nèi)OD540 nm從0.268降到0.142。與含Zn2+組相比,不含Zn2+組和Zn2+-EDTA組的rHdPGRP對肽聚糖的降解活性明顯降低(圖7)。表明rHdPGRP的酰胺酶活性是Zn2+依賴型。rHdPGRP對革蘭氏陽性菌藤黃微球菌的抑制實(shí)驗(yàn)顯示,在Zn2+存在情況下,經(jīng)rHdPGRP孵育后,藤黃微球菌的生長被強(qiáng)烈抑制(圖8),然而,在無Zn2+的情況下,rHdPGRP對其生長的抑制作用減弱(圖8)。

圖2 HdPGRP與其他物種中PGRPs的多序列比對
PGRPs來源及GenBank登錄號如下:夏威夷短尾魷(EsPGRP-2, AAY27974)、三角帆蚌(HcPGRP-S2, AHK22786)、太平洋牡蠣(CgPGRP-S1S, BAG31896; CgPGRP, XP_034310518)、大竹蟶(SgPGRP, AEW43446)、豹蛙(LcPGRP, PIO34231)、光滑雙臍螺(BgPGRP, NP_001298227)。圓形:Zn2+結(jié)合位點(diǎn);三角形:酰胺酶催化位點(diǎn)。
The PGRPs source and GenBank number are as follows:(EsPGRP-2, AAY27974),(HcPGRP-S2, AHK22786),(CgPGRP-S1S, BAG31896; CgPGRP, XP_034310518),(SgPGRP, AEW43446),(LcPGRP, PIO34231),(BgPGRP, NP_001298227). Round: Zn2+binding site; Triangle: Amidase catalytic site.

圖3 HdPGRP的N-J進(jìn)化樹
利用MEGA 4.0軟件,采用鄰接法構(gòu)建系統(tǒng)發(fā)育樹,重復(fù)1000次。PGRPs來源及GenBank登錄號如下:美洲牡蠣(CvPGRP-SC2, XP_022311450)、太平洋牡蠣(CgPGRP-SC2, XP_034321576; CgPGRP, XP_034310518)、紫貽貝(MgPGRP-C, AJQ2153)、歐洲扇貝(PmPGRP-SC2, XP_033761487)、印度蠶(SrPGRP, BAF03521)、煙草天蛾(MsPGRP, ACX49764)、斑馬魚(DrPGRP, NP_001038687)、黑斑鲀(TnPGRP-La3, ABQ23363)、虹鱒(OmPGRP-L1, AGF29405)、牛(BtPGRP-4, XP_874055)、鼠(MmPGRP-3, NP_997130)、人(HsPGRP-3, NP_443123)。
Using MEGA 4.0 software, the phylogenetic tree was constructed by Neighbor-Joining method and repeated 1000 times. The PGRPs source and GenBank number are as follows:(CvPGRP-SC2, XP_022311450),(CgPGRP-SC2, XP_034321576; CgPGRP, XP_034310518),(MgPGRP-C, AJQ2153),(PmPGRP-SC2, XP_033761487),(SrPGRP, BAF03521),(MsPGRP, ACX49764),(DrPGRP, NP_001038687),(TnPGRP-La3, ABQ23363),(OmPGRP-L1, AGF29405),(BtPGRP-4, XP_874055),(MmPGRP-3, NP_997130),(HsPGRP-3, NP_443123).

圖4 不同組織中hdpgrp的相對表達(dá)量(平均值±標(biāo)準(zhǔn)差, n=6)
Mu:肌肉;Gi:鰓;Ma:外套膜;Hem:血細(xì)胞;Hep:肝胰腺。
Mu: Muscle; Gi: Gills; Ma: Mantle; Hem: Hemocytes; Hep: Hepatopancreas.
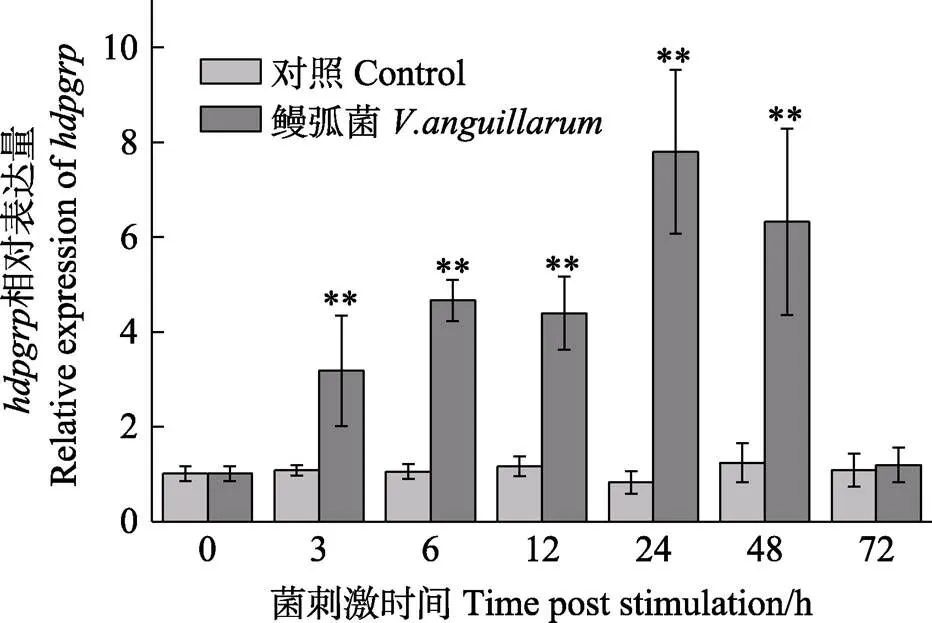
圖5 鰻弧菌刺激后血細(xì)胞中hdpgrp的相對表達(dá)量(平均值±標(biāo)準(zhǔn)差, n=6)
*:<0.05, **:<0.01.
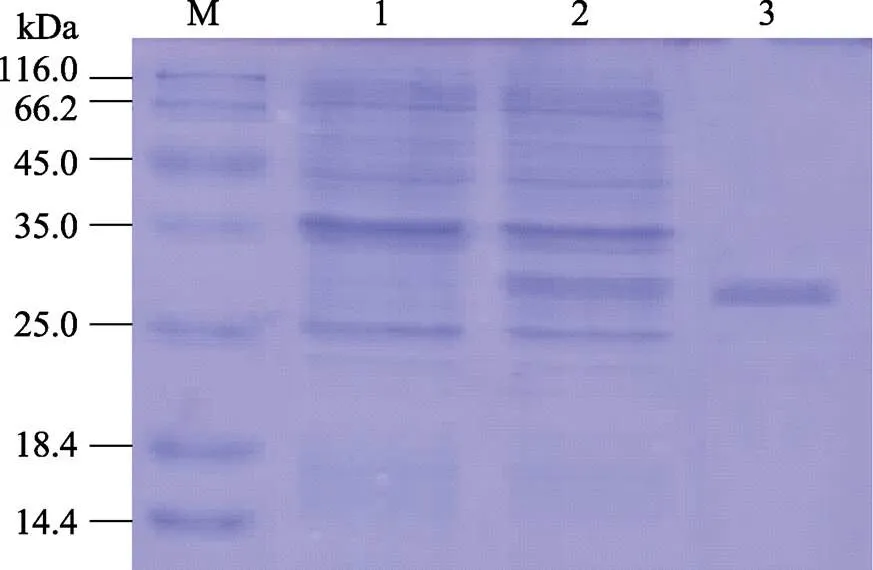
圖6 rHdPGRP的SDS-PAGE分析
泳道M:標(biāo)準(zhǔn)蛋白分子量標(biāo)記物;泳道1:陰性對照(未誘導(dǎo));泳道2:誘導(dǎo)大腸桿菌表達(dá)rHdPGRP;
泳道3:純化的rHdPGRP。
Lane M: Marker; Lane 1: rHdPGRP inwithout induction; Lane 2: Induced rHdPGRP in; Lane 3: Purified rHdPGRP.
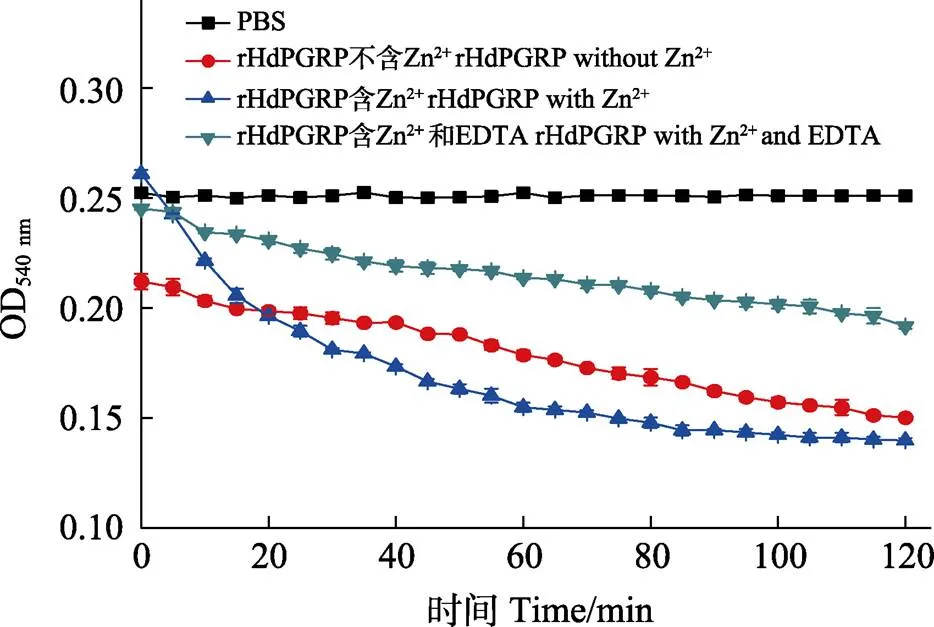
圖7 rHdPGRP的酰胺酶活性
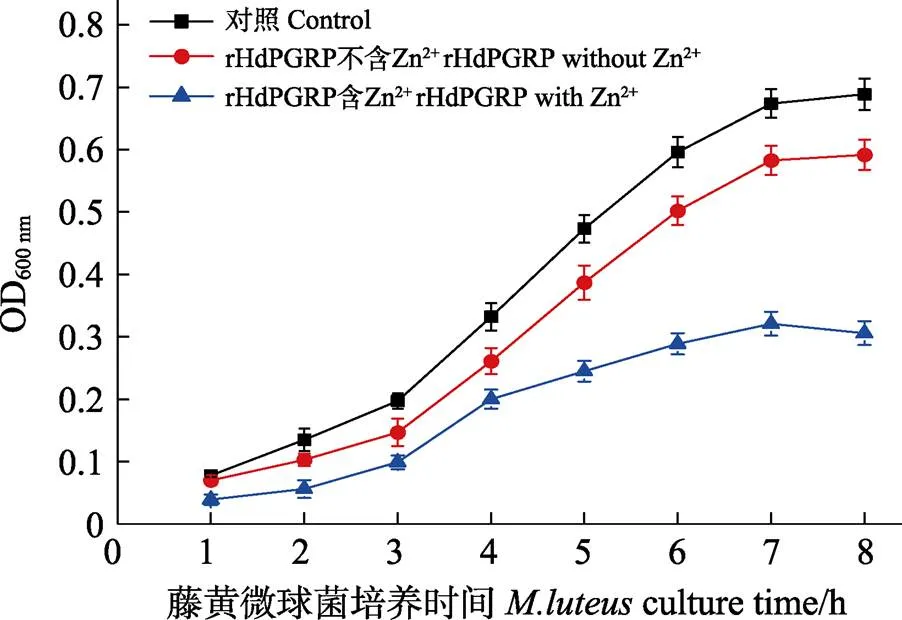
圖8 rHdPGRP的抗菌活性(平均值±標(biāo)準(zhǔn)差, n=3)
3 討論
皺紋盤鮑作為一種海洋無脊椎動(dòng)物,被認(rèn)為缺乏復(fù)雜的適應(yīng)性免疫,它們主要由先天免疫發(fā)揮機(jī)體防御,需要通過一些模式識(shí)別蛋白來識(shí)別異己,進(jìn)而抵御外界病原菌的入侵。PGRP作為特異性識(shí)別肽聚糖的模式識(shí)別蛋白,在抵御以肽聚糖為細(xì)胞壁主要成分的微生物的免疫反應(yīng)中發(fā)揮重要作用(Wei, 2018; Yang, 2019; 楊嘉龍, 2011)。本研究從皺紋盤鮑中鑒定了一種PGRP,并對其在組織中的分布情況、病原菌入侵時(shí)轉(zhuǎn)錄表達(dá)模式以及抗菌活性進(jìn)行了研究。
多序列比對結(jié)果顯示,HdPGRP與其他軟體動(dòng)物的PGRPs具有高度的相似性,PGRP結(jié)構(gòu)域與噬菌體的T3溶菌酶同源,表明HdPGRP具有抗菌和凝集作用。此外,HdPGRP中還發(fā)現(xiàn)了SH3b結(jié)構(gòu)域,在細(xì)菌蛋白中發(fā)現(xiàn)的SH3結(jié)構(gòu)域同源物能介導(dǎo)不同的生理過程,如增加局部蛋白濃度,改變其亞細(xì)胞位置,并介導(dǎo)大型多蛋白復(fù)合物的組裝(Huang, 2019; Morton, 1994)。這些結(jié)構(gòu)特征表明,HdPGRP可能具有細(xì)菌識(shí)別和清除的效應(yīng)功能。值得注意的是,在軟體動(dòng)物中發(fā)現(xiàn)的PGRPs均為短型,說明軟體動(dòng)物PGRPs介導(dǎo)的免疫防御機(jī)制可能與非軟體動(dòng)物不同。
鮑魚屬于半開放循環(huán)系統(tǒng),易受到多種微生物的侵入。在本研究中,盡管在所測組織中均有表達(dá),但在不同組織其表達(dá)量完全不同,表現(xiàn)出一定的組織特異性。與三角帆蚌的類似(Huang, 2019; Tao, 2014),主要在皺紋盤鮑肝胰腺中表達(dá),而在日本盤鮑()中發(fā)現(xiàn)的另一種短型主要在血淋巴中表達(dá)(Premachandra, 2014)。類似地,在太平洋牡蠣中,和分別在外套膜和消化盲囊中的表達(dá)量最高(Itoh, 2008)。在大竹蟶中,主要在肌肉和肝胰腺中表達(dá),而主要在鰓和外套膜中表達(dá)(楊頂瓏, 2014)。不同病原菌引發(fā)的病害不同,在不同的組織中選擇性表達(dá),表明PGRPs有可能針對不同病原菌進(jìn)行特異性識(shí)別。鰻弧菌作為皺紋盤鮑的一種重要致病菌,通過產(chǎn)生熱穩(wěn)定和熱不穩(wěn)定的毒素使宿主發(fā)病(王瑞旋等, 2006),在鰻弧菌刺激后,血細(xì)胞中的表達(dá)顯著升高,并在24 h時(shí)達(dá)到最高,可能是鰻弧菌細(xì)胞壁中的肽聚糖被PGRP識(shí)別,進(jìn)行信號傳遞并觸發(fā)免疫反應(yīng)(Hu, 2020)。
PGRPs具有酰胺酶活性,通過水解連接L-丙氨酸和N-乙酰胞壁酸之間的酰胺鍵降解肽聚糖,防止細(xì)菌過度激活免疫系統(tǒng)(Zaidman-Rémy, 2006; Premachandra, 2014; 楊嘉龍, 2011)。前期研究表明,存在4個(gè)保守的Zn2+結(jié)合殘基是PGRP酰胺酶活性能夠被激活的前提(Hu, 2020),與此相一致的是,HdPGRP也鑒定出4個(gè)保守的Zn2+結(jié)合位點(diǎn)(H210、Y255、H318和C330)。在Zn2+存在的情況下,肽聚糖被rHdPGRP顯著降解,這與櫛孔扇貝() (Yang, 2010)和菲律賓蛤仔()的酰胺酶活性一致(Yang, 2019)。研究表明,PGRPs通過酰胺酶活性降解細(xì)胞壁上的肽聚糖,細(xì)胞壁的損傷抑制細(xì)菌的生長,從而發(fā)揮一定的抗菌作用(Hu, 2020; Wang, 2003)。藤黃微球菌作為革蘭氏陽性菌,其細(xì)胞壁成分主要為肽聚糖,本研究發(fā)現(xiàn),rHdPGRP在Zn2+的作用下顯著抑制藤黃微球菌的生長,這表明HdPGRP對藤黃微球菌的抑菌活性是通過酰胺酶活性實(shí)現(xiàn)的。
4 結(jié)論
本研究在皺紋盤鮑中鑒定了一種新的模式識(shí)別蛋白(HdPGRP),對其在免疫防御中的作用進(jìn)行了初步研究。HdPGRP在進(jìn)化及結(jié)構(gòu)上較為保守,具有保守的Zn2+結(jié)合位點(diǎn)和酰胺酶催化位點(diǎn)。在血細(xì)胞及各組織中均有表達(dá),血細(xì)胞中的能夠響應(yīng)鰻弧菌刺激顯著上調(diào),表明其可能參與皺紋盤鮑抗細(xì)菌免疫防御。此外,證實(shí)了HdPGRP具有酰胺酶活性,對微生物病原菌具有一定的抗菌活性。這些結(jié)果為了解HdPGRP的功能特性及其在皺紋盤鮑免疫防御機(jī)制中的作用提供了基礎(chǔ)依據(jù)。
CAO D D, LIU J X, WANG Z G,. Expression analysis and functional characterization ofin the resistance of Japanese flounder () toinfection. Progress in Fishery Sciences, 2018, 39(3): 53–64[曹丹丹, 劉金相, 王志剛, 等. 牙鲆基因的表達(dá)分析及在抗遲緩愛德華氏菌感染過程中的功能. 漁業(yè)科學(xué)進(jìn)展, 2018, 39(3): 53–64]
COTEUR G, MELLROTH P, LEFORTERY C D,. Peptidoglycan recognition proteins with amidase activity in early deuterostomes (Echinodermata). Developmental and Comparative Immunology, 2007, 31(8): 790–804
DZIARSKI R. Peptidoglycan recognition proteins (PGRPs). Molecular Immunology, 2004, 40(12): 877–886
GERDOL M, VENIER P. An updated molecular basis for mussel immunity. Fish and Shellfish Immunology, 2015, 46(1): 17–38
HE T T. Comparative study on immunological responses of Pacific abalone and its hybrids with green abalone understress. Master′s Thesis of Xiamen University, 2018[何婷婷. 哈維氏弧菌脅迫下不同規(guī)格皺紋盤鮑和綠盤鮑免疫應(yīng)答研究. 廈門大學(xué)碩士研究生學(xué)位論文, 2018]
HU Z G, CAO X B, GUO M,. Identification and characterization of a novel short-type peptidoglycan recognition protein in. Fish and Shellfish Immunology, 2020, 99: 257–266
HUANG Y, PAN J L, LI X G,. Molecular cloning and functional characterization of a short peptidoglycan recognition protein from triangle-shell pearl mussel (). Fish and Shellfish Immunology, 2019, 86: 571–580
ITOH N, TAKAHASHI K G. Distribution of multiple peptidoglycan recognition proteins in the tissues of Pacific oyster,. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2008, 150(4): 409–417
JIANG X Y, YU G L, SONG X K,. Survey and evaluation of the Qianliyan national aquatic germplasam reserve. Progress in Fishery Sciences, 2021, 42(5): 1–7 [姜向陽, 于廣磊, 宋秀凱, 等. 千里巖海域國家級水產(chǎn)種質(zhì)資源保護(hù)區(qū)現(xiàn)狀調(diào)查與評價(jià). 漁業(yè)科學(xué)進(jìn)展, 2021, 42(5): 1–7]
KASHYAP D R, ROMPCA A, GABALLA A,. Peptidoglycan recognition proteins kill bacteria by inducing oxidative, thiol, and metal stress. PLOS Pathogens, 2014, 10(7): e1004280
LI X, YUAN S, SUN Z S,. Gene identification and functional analysis of peptidoglycan recognition protein from the spotted sea bass (). Fish and Shellfish Immunology, 2020, 106: 1014–1024
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCtmethod. Methods, 2001, 25(4): 402–408
MELLROTH P, KARLSSON J, STEINER H. A scavenger function for apeptidoglycan recognition protein. Journal of Biological Chemistry, 2003, 278(9): 7059–7064
MELLROTH P, STEINER H. PGRP-SB1: An-acetylmuramoyl L-alanine amidase with antibacterial activity. Biochemical and Biophysical Research Communications, 2006, 350(4): 994–999
MORTON C J, CAMPBELL I D. SH3 Domains: Molecular 'Velcro'. Current Biology, 1994, 4(7): 615–617
PREMACHANDRA H K A, ELVITIGALA D A S, WHANG I,. Identification of a novel molluscan short-type peptidoglycan recognition protein in disk abalone () involved in host antibacterial defense. Fish and Shellfish Immunology, 2014, 39(1): 99–107
ROUT A K, PARAMANIK S, DEHURY B,. Elucidating the molecular interaction of zebrafish () peptidoglycan recognition protein 2 with diaminopimelic acid and lysine type peptidoglycans using in silico approaches. Journal of Biomolecular Structure and Dynamics, 2020, 38(12): 3687–3699
SMITH P K, KROHN R I, HERMANSON G T,. Measurement of protein using bicinchoninic acid. Analytical Biochemistry, 1985, 150(1): 76–85
TAO Y, YANG Z Y, ZHANG X,. Molecular cloning and mRNA expression of the peptidoglycan recognition protein gene HcPGRP1 and its isoform HcPGRP1a from the freshwater mussel. Genetics and Molecular Biology, 2014, 37(3): 508–517
WANG R X, XU L W, FENG J,.Transactions of Oceanology and Limnology, 2006, 90(2): 117–124[王瑞旋, 徐力文, 馮娟, 等. 鮑類微生物性疾病研究進(jìn)展. 海洋湖沼通報(bào), 2006, 90(2): 117–124]
WANG X W, WANG J X. Pattern recognition receptors acting in innate immune system of shrimp against pathogen infections. Fish and Shellfish Immunology, 2013, 34(4): 981–989
WANG Z M, LI X N, COCKLIN R R,. Human peptidoglycan recognition protein-L is an-acetylmuramoyl- L-alanine amidase. Journal of Biological Chemistry, 2003, 278(49): 49044–49052
WEI X M, YANG D L, LI H Y,. Peptidoglycan recognition protein of(SgPGRP-S1) mediates immune recognition and bacteria clearance. Fish and Shellfish Immunology, 2018, 73: 30–36
WU F C, QUE H Y, ZHANG G F.. Marine Sciences, 2020, 44(8): 56–68 [吳富村, 闕華勇, 張國范. 我國皺紋盤鮑底播增養(yǎng)殖歷史、現(xiàn)狀及未來發(fā)展趨勢. 海洋科學(xué), 2020, 44(8): 56–68]
YANG D L, HAN Y J, LIU Y L,. A peptidoglycan recognition protein involved in immune recognition and immune defenses in. Fish and Shellfish Immunology, 2019, 88: 441–448
YANG D L. Study on the immune defense functions of peptidoglycan recognition protein in razor clam (). Master′s Thesis of Shanghai Ocean University, 2014 [楊頂瓏. 大竹蟶肽聚糖識(shí)別蛋白的免疫防御功能研究. 上海海洋大學(xué)碩士研究生學(xué)位論文, 2014]
YANG J L, WANG W, WEI X M,. Peptidoglycan recognition protein of(CfPGRP-S1) mediates immune defenses against bacterial infection. Developmental and Comparative Immunology, 2010, 34(12): 1300–1307
YANG J L. Study on the mechanism of immune response mediated by key pattern recognition receptors in Zhikong scallop. Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2011 [楊嘉龍. 櫛孔扇貝關(guān)鍵模式識(shí)別受體介導(dǎo)的免疫應(yīng)答機(jī)制研究. 中國科學(xué)院研究生院(海洋研究所)博士研究生學(xué)位論文, 2011]
ZAIDMAN-RéMY A, HERVé M, POIDEVIN M,. Theamidase PGRP-LB modulates the immune response to bacterial infection. Immunity, 2006, 24(4): 463–473
A Peptidoglycan Recognition Protein (PGRP) from: Possible Roles in Antibacterial Properties
CHEN Yuying1,2,3, HAN Yijin3, LIU Xiangquan2, HE Jinxia2, YANG Dinglong3①
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Shandong Marine Resource and Environment Research Institute, Shandong Key Laboratory of Marine Ecological Restoration, Yantai, Shandong 264006, China; 3. Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai, Shangdong 264003, China)
In this study, peptide PGRP (designated HdPGRP) was identified and characterized from the abalone. Multiple alignments and phylogenetic analyses strongly suggested that HdPGRP is a new member of the PGRP superfamily and belongs to the short PGRP family, similar to peptides from other marine mollusks. The full length of HdPGRP is 1467 bp, encoding a polypeptide of 354 amino acids (aa) with a signal peptide (1~18 aa), an SH3b domain (93~160 aa), a typical PGRP domain (179~322 aa), and an Ami_2 domain (191~322 aa). In addition, four conserved Zn2+-binding sites (H209, Y255, H318, and C330) and five conserved amide-catalysis sites (H209, Y255, H318, T328, and C330) were found in the HdPGRP sequence. In abalone,exhibited different tissue expression patterns, and was strongly expressed in the hepatopancreas, moderately expressed in hemocytes, mantle, and gills, and slightly expressed in muscle.is one of the main pathogens of; afterinfection, expression ofin hemocytes showed a trend of first increasing and then decreasing, reaching a maximum at 24 h. Subsequently, expression of HdPGRP decreased, and there was no significant difference compared with the control group at 72 h, demonstrating that expression of HdPGRP had returned to normal levels. SDS-PAGE results showed that recombinant HdPGRP (rHdPGRP) has a molecular mass of 30 kDa, which is in line with the value predicted for HdPGRP. PGRPs usually have amidase activity, degrading peptidoglycan by hydrolyzing the amide bond that links peptide units to muramic acid residues of glycan strands. rHdPGRP exhibited Zn2+-dependent amidase activity and catalyzed the degradation of insoluble peptidoglycan. In addition, rHdPGRP exhibited significant antibacterial activity against the gram-positive bacteriumin the logarithmic phase in the presence of Zn2+, indicatingtheof HdPGRP might beamidase. In summary, HdPGRP plays an important role in PGRP-mediated antibacterial mechanisms, especially for eliminating invading bacteria.
; Peptidoglycan recognition protein; Immune response
YANG Dinglong, E-mail: dlyang@yic.ac.cn
10.19663/j.issn2095-9869.20210427001
S917.4
A
2095-9869(2022)04-0234-09
*國家自然科學(xué)基金(41806196)、山東省自然科學(xué)基金(ZR2019BD022)和煙臺(tái)市科技發(fā)展計(jì)劃(2020MSGY066)共同資助[This work was supported by National Natural Science Foundation of China (41806196), Natural Science Foundation of Shandong Province (ZR2019BD022), Yantai Science and Technology Development Project (2020MSGY066)]. 陳鈺瑩,E-mail: c19121695907@163.com
楊頂瓏,副研究員,E-mail: dlyang@yic.ac.cn
2021-04-27,
2021-06-15
http://www.yykxjz.cn/
陳鈺瑩, 韓怡靜, 劉相全, 何金霞, 楊頂瓏. 皺紋盤鮑肽聚糖識(shí)別蛋白在免疫防御中的作用. 漁業(yè)科學(xué)進(jìn)展, 2022, 43(4): 234–242
CHEN Y Y, HAN Y J, LIU X Q, HE J X, YANG D L. A peptidoglycan recognition protein (PGRP) from: Possible roles in antibacterial properties. Progress in Fishery Sciences, 2022, 43(4): 234–242
(編輯 馬璀艷)

