完井液用加重劑有機鹽中硫化物質量分數檢測方法優化
張文龍,朱良根,趙秀峰,范 磊
(1.新疆塔里木油田建設工程有限責任公司油田化學助劑廠,新疆 庫爾勒 841000;2.中國石油集團工程材料研究院有限公司,陜西 西安 710000)
硫化物質量分數是完井液用加重劑有機鹽(以下簡稱“有機鹽”)質量檢測指標中比較重要的檢測項目。目前,國內針對有機鹽中硫化物質量分數的檢測方法主要是碘量法和碘滴定法,兩種方法均以淀粉溶液為指示劑[1]。淀粉與碘單質發生化學顯色反應時,會消耗一定量碘標準溶液,消耗量與滴定速度、環境溫度等因素有一定關系,因此,兩種方法的準確度較低。本研究介紹了有機鹽中硫化物質量分數4種檢測方法的優缺點,并對碘量法進行了優化。
1 材料、試劑與儀器
完井液用加重劑有機鹽(甲酸鈉):分析純;硫化鈉:分析純;碘化鉀(KI):分析純;硫代硫酸鈉(Na2S2O3)標準滴定溶液:0.1 mol/L,按GB/T 601配制;淀粉指示劑:0.500%,按GB/T 603配制;蒸餾水(或去離子水):不低于GB/T 6682中的三級水;碘標準溶液:0.1 mol/L,按GB/T 601配制;雙氧水:分析純;氯化鋅:分析純;無水乙醇:分析純;含硫試樣:將0.500 0 g硫化鈉與99.500 0 g甲酸鈉混合均勻(理論上硫化鈉質量分數為5.000%)。
2 實驗方法
2.1 碘量法
采用Q/SY TZ 0470—2019《完井液用甲酸鈉技術要求及檢驗方法》中硫化物質量分數的檢測方法(滴定至錐形瓶中,當溶液顏色由棕色變為黃色或淡黃色時,加入淀粉指示劑)。
2.2 碘滴定法
采用HG/T 5390—2018《工業甲酸鈉》中硫化物質量分數的檢測方法。
2.3 氧化沉淀法
稱取20.000 0 g(精確至0.000 1 g)待測試樣,用200 mL蒸餾水溶解,加入10 mL雙氧水與5 mL 1.0 mol/L鹽酸溶液,在磁力攪拌器上攪拌10 min,用已恒重的定量濾紙進行過濾,將濾紙與不溶物一同放入干燥箱中,105 ℃烘至恒重,硫化物質量分數X用以下公式計算:
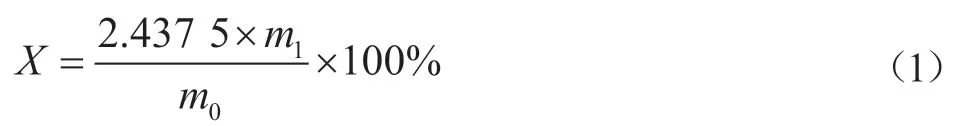
式中:m0為稱取的試樣質量,m1為沉淀物質量,2.437 5為硫化鈉與單質硫的質量換算系數。
2.4 無機鹽沉淀法
稱取50.000 0 g(精確至0.000 1 g)待測試樣,用200 mL蒸餾水溶解,加入1.000 0 g氯化鋅,在電爐上加熱至沸,保持微沸狀態10 min,冷卻至50 ℃左右,用已恒重的定量濾紙進行過濾,將濾紙與不溶物一同放入干燥箱中,105 ℃烘至恒重,硫化物質量分數X用以下公式計算:
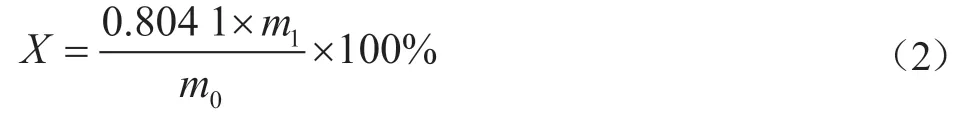
式中:m0為稱取的試樣質量,m1為沉淀物質量,0.804 1為硫化鈉與硫化鋅的質量換算系數。
3 結果與討論
用4種方法分別測定試樣中硫化物的質量分數,并進行10次平行檢測,按照試樣中硫化鈉理論質量分數為5.000%計算檢測結果的平均值、相對標準偏差(Relative Standard Deviation,RSD)與檢測回收率(以對比不同檢測方法的準確度),具體實驗結果如表1所示。通過這樣的實驗方式,可以了解到不同方法對檢測回收率的實際影響。
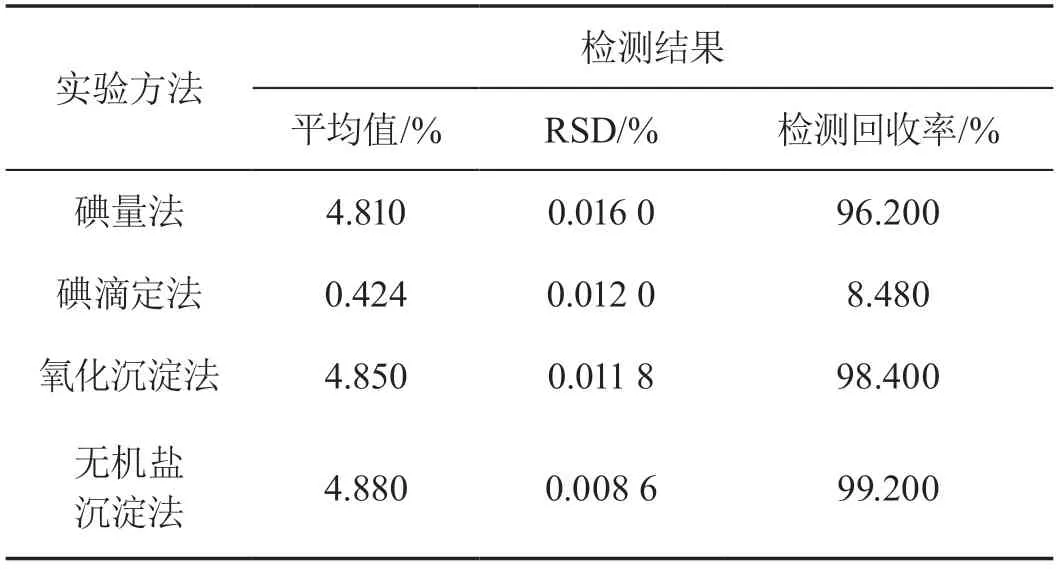
表1 4種方法的硫化物質量分數檢測結果
對比4種檢測方法發現,無機鹽沉淀法和氧化沉淀法的準確度較高,并且實驗結果更接近真實值;碘滴定法的準確度最低,且與實際值相差較大,因此,在常規檢測中不建議使用該方法。
依據實驗原理分析對比,碘量法、碘滴定法以及氧化沉淀法可將試樣中所有硫化物以及亞硫酸鹽氧化變成單質硫或硫酸鹽,但氧化沉淀法是根據沉淀質量反推算試樣中硫化物的質量分數,因此,當試樣中含有亞硫酸鹽時,此方法的檢測結果偏低,同理,無機鹽沉淀法也存在同樣的問題(亞硫酸鹽不會發生沉淀)。需要注意的是,在分析過程中,除了碘滴定法,檢測回收率基本上保持在96.000%以上,呈現出較為明顯的實驗效果,可以為后面的原因分析提供較為準確的參數指標。
3.1 原因分析
碘量法和碘滴定法采用淀粉溶液作為指示劑進行硫化物質量分數檢測,因為淀粉與單質碘的反應速度比S2-被單質碘氧化的速度快得多,并且淀粉會消耗一定量的碘單質產生顏色變化,所以指示劑加入量、指示劑加入時間會對檢測結果造成較大影響[2]。因此,用碘量法測定有機鹽中硫化物質量分數時,指示劑加入時間、指示劑加入量以及滴定速度都會對實驗結果造成影響。
碘滴定法因在滴定開始前將淀粉指示劑加入待測溶液中,用碘標準溶液進行滴定時,碘單質與淀粉發生顯色反應的速度比碘單質氧化S2-成單質S的速度快,使滴定結果提前出現,無法真實地反映出試樣中S2-的質量分數,相當于在蒸餾水中加入淀粉指示劑后直接用碘標準溶液進行滴定,所以該方法的檢測結果平行性較高,但實驗結果的準確度以及檢測回收率均最低。碘滴定法需要在實驗過程中對其操作細節進行把控,相關人員通過調節滴定過程中的速度和溫度,保障實驗過程中的數據可靠。但是這樣的處理方式也要保障其他變量的穩定,以完成可靠的對比實驗分析,提升實驗處理的整體效果。
采用氧化法測定硫化物質量分數時,需對試樣中硫化物的質量分數進行預判。隨著反應的進行,試樣溶液的pH也會發生變化。當溶液pH發生較大變化時,已形成的單質硫會與氫氧化鈉發生化學反應,重新生成硫化鈉及亞硫酸鈉。因此,在實驗過程中需加入一定量鹽酸溶液控制其pH。另外,雙氧水在酸性條件下的氧化能力較強,能夠更好地將S2-氧化成單質S。但是,雙氧水的加入量不得過多,如果加入量過多,生成的單質硫會在雙氧水和氫氧化鈉的共同作用下生成溶于水且無色透明的硫酸鈉,實驗溶液中的渾濁會消失,造成實驗結果偏低。
相比于以上3種檢測方法,無機鹽沉淀法操作簡便、干擾因素少,利用Zn2+與S2-接觸即發生化學反應且生成物硫化鋅不溶于水的特點,通過收集、干燥并稱量得到硫化鋅的質量,反推算出試樣中硫化物的質量分數。硫化鋅性質較穩定,且生成過程中無副反應發生,因此,該方法的準確度和檢測回收率最高。另外,還要有針對性地處理一些操作過程造成的不良影響,以免化學反應出現一定的滯后性。只有采用合理的檢測方法,才能得到準確的數據信息,提升化學實驗的可靠性。
3.2 檢驗方法的改進
在影響實驗檢測結果準確度的因素中,最容易被忽略的是溫度。試樣溶液的溫度對實驗過程中離子間化學反應速度、滴定終點的顯現都有至關重要的作用。為了實現檢驗方法的全面優化,需要合理把控溫度,將其控制在良好的范圍內,促進實驗的發展。
為驗證實驗溫度對有機鹽中硫化物質量分數檢測結果的影響,分別將實驗溶液加熱至25、30、35、40、45、50 ℃(考慮到碘量法和碘滴定法會用到碘標準溶液,實驗溫度未考慮超過50 ℃的情況,以免因溫度過高造成碘單質升華,影響實驗結果的準確度),分別按照4種硫化物檢測方法檢測試樣中硫化鈉的質量分數,并計算檢測回收率,根據不同溫度下檢測回收率的變化(見圖1),判斷實驗溫度是否會對檢測結果產生影響。
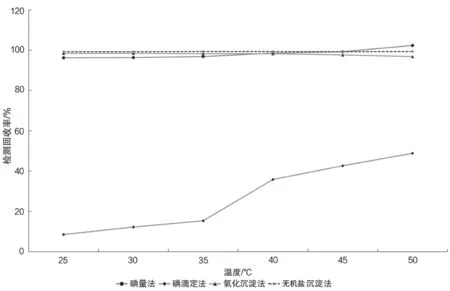
圖1 4種方法的實驗結果
4 結果與分析
從實驗結果中可以看出,實驗溫度的改變對無機鹽沉淀法幾乎沒有影響;隨著實驗溫度的升高,氧化沉淀法的檢測回收率呈不明顯的下降趨勢,碘滴定法的檢測回收率明顯上升,而目前常用的碘量法的檢測回收率出現先上升后下降的趨勢(當實驗溫度超過45 ℃時,實驗檢測回收率呈下降趨勢)。現分析原因如下。
4.1 碘量法
在實驗過程中,將待滴定溶液(加入定量的碘標準溶液后)在暗處靜置5 min左右,溫度的升高加快了S2-被氧化的速度,所以檢測結果也隨之升高。但溶液溫度超過45 ℃后,待測液中的碘單質會升華,造成實驗結果超過100.000%的現象。
4.2 碘滴定法
淀粉與碘發生顯色反應是因為淀粉遇碘后形成包合物,該包合物處于不穩定狀態,當溫度升高時,被淀粉包裹的碘單質會被釋放出來,溫度越高,碘單質釋放的速度就越快。因此,隨著溫度的升高,檢測回收率呈現上升趨勢。溫度超過50 ℃后,碘單質升華會隨著溫度的升高而越發嚴重,影響實驗結果的準確度。
4.3 氧化沉淀法
氧化沉淀法存在較多的副反應,所以溫度的升高雖然加快了S2-被氧化的速度,但也給副反應的發生創造了條件,并且溫度越高,副反應越快、越徹底。因此,隨著反應溫度的升高,檢測回收率呈下降趨勢。
4.4 無機鹽沉淀法
無機鹽沉淀法是4種方法中準確度和檢測回收率最高的檢測方法,因為S2-與Zn2+發生沉淀反應不會消耗或產生熱量,所以溫度的變化對該方法的檢測回收率無任何影響。
5 結論
無機鹽沉淀法和碘量法檢測有機鹽中硫化物質量分數的準確度和可操作性較高,氧化沉淀法和碘滴定法不適用于有機鹽中硫化物質量分數的測定。在時間充裕并且只需要測定試樣中硫化物含量時,建議使用無機鹽沉淀法進行檢測(過濾及烘干過程較為耗時,共計需耗時5.0 h左右);若檢測時間較緊張或需要測定試樣中硫化物以及亞硫酸鹽的總量,建議用碘量法測定,溫度最好控制在35~45 ℃,此時檢測結果的準確度較高。
若需要單獨測定試樣中亞硫酸鹽的質量分數,可用碘量法的測定結果減去無機鹽沉淀法的測定結果,然后乘以1.487(亞硫酸鈉與硫化鈉分子質量的比值),可得到試樣中亞硫酸鹽的質量分數,若試樣為甲酸鉀,計算結果則乘以1.436(亞硫酸鉀與硫化鉀分子質量的比值)。因此可見,不同的實驗條件會對實驗的結果造成直接的影響。現階段,要結合實際的實驗條件,有針對性地調整實驗方法,保障在實驗檢測過程中得到較為準確的數據,為相關領域的工作人員提供可靠的參考。

