老年糖尿病足混合細菌感染病原菌分布及與免疫功能的相關性
鄭海龍 那涵 陳小盼 蔡舒婷 韓鋒 吳海麗
(海南醫學院第一附屬醫院 1內分泌科,海南 海口 570102;2檢驗科;3皮膚病科)
糖尿病足(DF)是糖尿病(DM)患者最常見、最嚴重的慢性并發癥之一,在我國50歲以上的DM患者中,DF的發病率高達8.1%〔1〕,糖尿病足潰瘍(DFU)和糖尿病足感染(DFI)是導致DM患者截肢、死亡的主要原因,根據相關估計數據,全球每20 s就會有1例DFU截肢,總截肢率高達19.03%,DFU患者的年病死率高達14.4%〔2〕,而我國DFU患者的年病死率和截肢率分別為11%和22%〔3〕。細菌感染是影響DFU創面難愈和復發的核心因素,臨床就診的DFU患者幾乎全部存在不同程度的足部感染,老年DFI患者因具有合并基礎疾病、機體器官功能減退、組織修復和再生能力弱等特點,其治療難度更高、感染難以有效控制。及時全身性應用廣譜抗菌藥物是治療DFI的基礎,但在老年患者中治療效果往往難以令人滿意,這與老年DFI患者創面病原菌的復雜性和耐藥現象有關,隨著第三代頭孢菌素等廣譜抗菌藥物的廣泛應用,病原菌耐藥現象更加嚴重〔4〕。混合細菌感染和多藥耐藥菌(MDROs)檢出率升高是DFI病原學特征的重要變化趨勢〔5〕,但目前關于DFI混合細菌感染的病原菌分布和相關因素研究結果分歧較多,同時,雖然研究證實了DFI的發生與機體免疫功能下降有關,但混合細菌感染的發生是否也與之相關,學術界仍未達成共識〔6〕,基于此,本研究針對老年DF患者混合細菌感染的病原菌分布及與免疫功能指標的相關性進行了分析,旨在為臨床治療工作提供研究依據。
1 資料與方法
1.1臨床資料 選取2019年10月至2021年3月海南醫學院第一附屬醫院收治的85例老年DFI患者作為研究對象,根據創面樣本病原菌分布將其分為混合感染組(36例)和非混合感染組(49例),兩組患者均簽署知情同意書,自愿參與本研究,研究方案經醫院醫學倫理委員會審核通過。納入標準:DFI的診斷依據《中國糖尿病足診治指南》〔7〕和國際DF工作組制訂的《糖尿病足感染診斷和治療指南(2019年更新)》〔8〕,患者年齡均大于60歲,Wagner分級均為2~5級,均于入院當日行常規入院檢查并采集感染創面樣本行細菌培養,住院資料完整。排隊標準:合并嚴重肝腎功能障礙、惡性腫瘤、自身免疫疾病、血液系統疾病、腦卒中、糖尿病急性并發癥者;入組前3個月內有高壓氧、臭氧及其他創面治療史者。
1.2觀察指標
1.2.1創面病原菌分布及耐藥性 于入院后當日應用抗菌藥物治療前首次傷口換藥時采集患者的足部創面樣本,樣本提取液于37℃下恒溫培養48~72 h后,采用MA120型微生物鑒定藥敏分析系統(珠海美華醫療科技有限公司)對分離菌株進行菌種鑒定,質控菌種為金黃色葡萄球菌ATCC25923、大腸埃希菌ATCC25922、白假絲酵母ATCC90028,質控菌種均購自南京樂診生物技術有限公司。將合并兩種及以上細菌感染判定為混合細菌感染,采用紙片瓊脂擴散法對分離菌種進行藥物敏感性檢測,參照美國臨床和實驗室標準協會指南〔9〕對藥敏結果進行判定,將對三類或三類以上抗菌藥物同時耐藥的病原菌判定為MDROs。注意事項:創面樣本采集過程均嚴格執行無菌操作,采樣試管嚴格執行滅菌處理,針對淺表潰瘍患者以滅菌鹽水棉拭子蘸取潰瘍底部分泌物或膿液進行采集,注意避免沾染創面周圍皮膚;針對深潰瘍及足壞疽患者于清創后以探針采集潰瘍深部分泌物或膿液,采樣后立即送實驗室進行檢測。
1.2.2臨床特征 通過查閱住院病歷對兩組患者的年齡、性別、DM病程、DFU病程、Wagner分級、抗菌藥物應用史及入院當日的空腹血糖(FBG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、白細胞計數(WBC)、中性粒細胞百分比(NEU%)、降鈣素原(PCT)、C 反應蛋白(CRP)、踝肱指數(ABI)、經皮氧分壓 (TcPO2)等指標進行比較,其中,FBG、血脂指標、CRP的檢測采用Cobas 501型全自動血液生化分析儀(瑞士Roche公司),WBC、NEU%的檢測采用 XT-2000i型五分類血液分析儀(日本Sysmex公司),PCT的檢測采用E601電化學發光免疫分析儀(瑞士Roche公司),HbA1c的檢測采用LC-30A型高壓液相色譜儀(日本Shimadzu公司),ABI的檢測方法為測定踝部脛后動脈或脛前動脈及肱動脈的收縮壓而后計算其比值,TcPO2的檢測采用TCM4 監測系統(丹麥 Radiometer公司)。質控措施為:在開展研究前,針對參與研究者進行質控培訓,主要是對于研究對象的納入排除標準、病史問診要點、實驗室檢測標準方法和關鍵步驟進行培訓,要求檢測人員在開展研究前認真閱讀儀器及試劑盒使用說明書,嚴格按照說明書步驟進行操作,在提取數據時采用雙人分別提取病歷進行數據錄入,由研究組質控人員對數據進行最終復核和確認。
1.2.3外周血T淋巴細胞亞群 于兩組患者入院當日采集外周靜脈血樣本2 ml,經乙二胺四乙酸抗凝處理后,采用BD Accuri C6 Plus型流式細胞儀(美國BD公司)對血清中的CD3+T淋巴細胞比例、CD4+T淋巴細胞比例、CD8+T淋巴細胞比例、CD4+/CD8+T淋巴細胞比值進行檢測,試劑盒為儀器配套試劑盒。
1.3統計學方法 采用SPSS20.0軟件進行t檢驗、χ2檢驗、Fisher確切概率法、Logistic回歸分析。
2 結 果
2.1兩組創面病原菌分布及耐藥性 混合感染組創面中檢出病原菌72株,非混合感染組創面中檢出病原菌49株,兩組創面病原菌分布的差異均無統計學意義(P>0.05)。見表1。混合感染組感染類型以金黃色葡萄球菌+大腸埃希菌〔7例(19.44%)〕、表皮葡萄球菌+大腸埃希菌〔6例(16.67%)〕、銅綠假單胞菌+大腸埃希菌〔6例(16.67%)〕占比較多;其余變形桿菌+大腸埃希菌、金黃色葡萄球菌+肺炎克雷伯菌各4例(11.11%),金黃色葡萄球菌+鮑氏不動桿菌3例(8.33%),變形桿菌+糞腸球菌、變形桿菌+摩氏摩根菌、糞腸球菌+摩氏摩根菌各2例(5.56%)。藥敏試驗結果顯示,混合感染組創面中金黃色葡萄球菌、大腸埃希菌中MDROs檢出率高于非混合感染組,差異均有統計學意義(P<0.05)。見表2。

表1 兩組創面病原菌分布〔n(%)〕

表2 兩組創面病原菌MDROs檢出率的比較〔n(%)〕
2.2兩組外周血T淋巴細胞亞群比較 混合感染組外周血CD3+T淋巴細胞比例、CD4+T淋巴細胞比例、CD4+/CD8+T淋巴細胞比值均低于非混合感染組,差異均有統計學意義(P<0.05)。見表3。
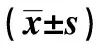
表3 兩組外周血T淋巴細胞亞群比較
2.3兩組臨床特征比較 混合感染組DFU病程、抗菌藥物治療史、Wagner分級為4~5級比例、HbA1c水平高于非混合感染組,ABI和TcPO2水平低于非混合感染組,差異均有統計學意義(P<0.05)。見表4。
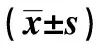
表4 兩組臨床特征比較
2.4DFI患者混合細菌感染的相關因素分析 將上述有統計學差異的指標作為自變量納入Logistic多元回歸模型進行分析,結果顯示,老年DFI混合細菌感染的發生與抗菌藥物治療史、Wagner分級、ABI、TcPO2、CD4+T淋巴細胞比例、CD4+/CD8+T淋巴細胞比值具有相關性(P<0.05),其中,抗菌藥物治療史、Wagner分級為危險因素,ABI、TcPO2、CD4+T淋巴細胞比例、CD4+/CD8+T淋巴細胞比值為保護因素。見表5。

表5 老年DFI混合細菌感染相關因素的Logistic多元回歸分析
3 討 論
與非老年DM患者相比較,老年DM患者的血糖波動幅度大、低血糖發生率較高、血糖波動具有性別差異、預后與HbA1c密切相關,上述血糖波動特點導致老年DM患者的氧化應激和炎癥反應更加嚴重,血管內皮細胞功能障礙更加明顯,同時,老年DM患者還具有機體器官功能減退、組織修復和再生能力降低等生理變化,常規合并有多種基礎慢性代謝疾病,導致其DFU愈合速度明顯低于非老年患者,感染程度更加嚴重,治療難度更高。本研究結果可見,在老年DFI患者中,混合細菌感染病例的占比較高,超過了40%,這與相關研究〔10〕報道的水平基本一致。本研究報道了大腸埃希菌和金黃色葡萄球菌是引起DFI的主要病原菌,相關研究〔11〕結果與本研究結果一致,但有研究〔12〕中也得出了差異化的結論,這可能與選取的研究對象在病變程度和抗菌藥物應用史方面存在異質性有關。DFI的感染類型比較多樣,包括了淺表的蜂窩織炎、皮膚淺表感染性潰瘍和深部的軟組織膿腫、壞死性筋膜炎、骨髓炎、壞疽等,相關的病原學研究〔13〕結果顯示,未接受過抗菌藥物治療的急性DFI通常由葡萄球菌和鏈球菌引發,在臨床實踐中針對輕度的局灶性淺表潰瘍DFI的經驗性抗感染治療通常是針對金黃色葡萄球菌和鏈球菌。然而,深部潰瘍DFI則多由混合細菌感染所致,病原菌不僅包括革蘭陽性球菌,而且包括大腸埃希菌、克雷伯菌、產氣腸桿菌、變形桿菌等革蘭陰性桿菌和脆弱類桿菌、消化鏈球菌等厭氧菌,這導致了不同病情患者創面病原菌構成出現了明顯的差異,加之相當一部分患者在入院前已接受了全身性或局部抗菌藥物治療,進一步對創面的病原菌分布狀態產生影響。通過本研究可見,混合細菌感染DFI患者的主要創面病原菌的MDROs檢出率較高,相關研究〔14〕結果顯示,DFI的病原學特點主要是兩種或兩種以上細菌混合感染占比較高和所感染的病原菌對多種抗菌藥物耐藥性較強,而在過去十年中,DFI病原菌的重要變化趨勢是MDROs檢出率的增加,其中,最重要的病原菌是耐甲氧西林金黃色葡萄球菌(MRSA)和產超廣譜β-內酰胺酶(ESBLs)大腸埃希菌,故金黃色葡萄球菌和大腸埃希菌也是臨床上最常見的MDROs菌株。DFI中混合細菌感染和MDROs菌株的出現具有密切的相關性,相關研究〔15〕證實,混合細菌感染是導致DFI患者MDROs感染風險升高的獨立危險因素,而MDROs感染進一步提升了抗感染治療難度,從而導致了創面難愈和DFU復發,最終提升了患者的截肢和死亡風險。這提示了臨床醫生在DFI治療中應注意進行創面病原學的分離和鑒定,對于混合細菌感染患者應高度警惕MDROs感染的發生,在臨床治療中盡量依據藥敏試驗結果選取敏感性抗菌藥物開展抗感染治療。
通過本研究結果可見,除抗感染治療史外,DFU病情、末梢血管灌注和供氧情況、機體免疫功能均可對DFI混合細菌感染風險產生影響。在本研究選取的觀察指標中,Wagner分級是學術界公認的反映DFU病變程度的可靠指標,相關研究〔16〕結果顯示,隨著DFU病變程度的加重,不僅病原菌中革蘭陰性桿菌的感染率升高,而且混合細菌感染概率和病原菌耐藥性也會顯著提升,MRSA、產ESBLs革蘭陰性腸桿菌等MDROs菌株的檢出率也隨之增加。ABI是一種簡便易行、無創血管灌注評價方法,已被用于冠心病、急性冠狀動脈綜合征、外周血管疾病、2型糖尿病、腎功能不全等疾病的診斷和評價之中,相關研究〔17〕證實,隨著ABI的降低,DFI患者的下肢缺血程度加重,患者細菌感染程度與ABI呈負相關關系。TcPO2能夠直接反映皮膚組織細胞的氧合狀態,從而提示局部血液循環情況,而DFI病變的直接原因是下肢皮膚微循環功能障礙導致皮膚氧供應減少,故TcPO2可用于準確評價DFI病變局部末梢的缺血缺氧程度,相關研究〔18〕結果顯示,DFI患肢足背ABI和動脈血流量與TcPO2水平均呈正相關關系,并可預測DFU創面的細菌清除效果和遠期愈合情況。上述三個指標能夠綜合性反映DFU的宏觀病情和末梢組織灌注狀態,DFU病情的加重一般會導致創面加深和局部細菌清除能力的下降,最終通過影響創面病原菌的分析提升了混合細菌感染的發生率。本研究結果提示DFI患者機體免疫功能的下降與混合細菌感染風險有關,其原因可能包括以下方面:①DFI患者的免疫功能下降可加重病原微生物的感染程度和深部感染風險〔19〕,從而提升了混合細菌感染風險;②DFI患者機體免疫功能的下降可引起血清促炎因子的反應性過表達和皮質醇水平的升高,而全身性炎癥反應的加重進一步促進了免疫內環境紊亂、血管內皮功能損害、凝血功能障礙等病理改變〔20〕,從而導致了機體對病原菌的防御和清除下降,最終提升了混合細菌感染風險;③在DFU的病理過程中,病灶局部存在著由肥大細胞、自然殺傷細胞、CD8+T細胞、單核細胞等參與的免疫調節和主動角化過程〔21〕,而免疫細胞水平的降低可影響皮膚局部的免疫調節能力,從而造成再上皮化障礙、影響創面的愈合過程、提升混合細菌感染的風險。這提示了臨床醫生應對DFI患者的病情狀態和免疫功能進行全面的評價,并積極采取干預措施,努力糾正免疫功能失衡和血管灌注障礙,從而達到降低混合細菌感染率、加速創面病原菌清除、促進創面愈合的目的。
由于患者的臨床資料有限,本研究未對負壓吸引等局部治療因素及抗菌藥物種類等因素進行研究,也未對患者的肝腎功能、其他慢性并發癥情況進行分析,這是不足之處。

