Li4SiO4基CO2吸附材料研究進展與趨勢
胡希璇,潘 登,薛天山,黃 亮,王 強
(1.北京林業大學 環境科學與工程學院,北京 100083;2.武漢凱迪水務有限公司,湖北 武漢 430000;3.中國環境科學研究院 大氣環境研究所,北京 100012)
0 引 言
自工業革命以來,空氣中溫室氣體日益增加,溫室效應加劇,危害人類健康[1-2]。其中CO2被認為是最主要的溫室氣體,隨著水泥、鋼鐵和燃煤電廠等工業的快速發展,人為源CO2排放量快速增加,導致全球氣候變化[3]。為降低氣候變暖帶來的生態風險,控制大氣中CO2含量是首要研究課題。在全球CO2排放中,能源消費排放量占80%以上[4],考慮到清潔能源代替化石資源需要時間,同時部分行業(如水泥、航空等)幾乎無法從能源結構調整上實現CO2凈零排放,在全球碳中和背景下,世界能源組織(IEA)稱CCUS是不可或缺的技術[5-7]。不論CO2利用還是封存,捕集都是必要前提,因此,工業源CO2捕集受到重視。目前,唯一被應用于工業的CO2捕集技術是液胺吸收法,該工藝利用有機胺溶液吸收工業尾氣中的CO2經加熱完成CO2脫附,實現氣體分離。但由于有機胺易揮發,吸收液在使用過程中不斷損耗,且胺溶液具有較強的腐蝕性,會造成設備結垢等一系列問題。另一種CO2捕集技術——膜分離法在CO2捕集領域也有較廣闊的應用前景,但CO2分離膜成本較高,且穩定性和選擇性有待進一步提升,目前處于基礎研究階段[8-10]。相比前2種方法,固體吸附法由于吸附劑種類多樣,不同固體材料可適配各類CO2捕集工況,具有較寬的應用溫度窗口,是唯一適用于高溫CO2捕集的技術方案。同時固體吸附材料成本相對較低、且其循環使用過程中不會出現材料大量損失的現象,第2代低能耗固體吸附劑的開發成為研究熱點,固體吸附材料在吸附增強型產氫工藝等中高溫反應中也表現出巨大的應用潛力。
對于甲烷蒸汽重整產氫工藝,反應溫度在600 ℃ 以上,若在反應工況下對產生的CO2直接高溫吸附,可減少CO2排放,避免降溫捕集過程帶來的能量消耗,同時還能推動反應平衡右移,提高H2產率,該反應成功的關鍵是開發合適的高溫CO2捕集材料。傳統CO2吸附材料,如多孔碳、沸石、MOFs等,對CO2捕集主要基于物理吸附,吸附量隨溫度升高而降低,應用溫度一般小于100 ℃。對于高溫捕集,吸附材料一般通過與CO2發生化學反應實現對其固定。目前廣泛關注的高溫CO2吸附劑主要包括CaO[11]、堿金屬硅酸鹽[12]、堿金屬鋯酸鹽[13]、堿金屬鈦酸鹽[14-15]等。其中CaO具有成本低、來源廣泛和理論吸附量高等優點,但CO2吸脫附循環中吸附容量衰減嚴重是最大問題[16-17]。這是由于CaO的塔曼溫度較低,在高溫中易發生燒結導致吸附劑顆粒變大,隨CaO吸附CO2反應的進行,材料表面形成的產物層過厚導致CO2擴散困難,吸附反應不完全。目前通過摻雜等手段引入惰性分隔材料可減輕CaO燒結現象[18-20],但在較高吸附溫度下,CaO吸附材料還存在失活問題,這也是其在商業應用中面臨的巨大挑戰之一。堿性陶瓷是另一類高溫CO2吸附材料,具有吸附容量高、吸附速率快、循環穩定性較好等優點,其中Li2ZrO3和Li4SiO4是目前主要的堿性陶瓷吸附劑。21世紀初期Li2ZrO3引起關注,關于堿金屬元素摻雜[21-22]、Li原子替代[23-25]等改性工作研究較多[26-27],但近幾年,這種吸附劑研究熱度有所下降[28]。相比之下,Li4SiO4基吸附材料具有高吸附容量(理論吸附容量為36.67%)、較高熱穩定性、更快吸脫附動力學和較低再生溫度[29-31],使其備受關注。雖然與Li2ZrO3相比,Li4SiO4成本較低,但仍存在許多問題[32-34],如對低濃度CO2吸附能力較差、吸附活性有待進一步提升、存在燒結問題等。同時,鋰電池行業的快速發展導致Li4SiO4生產成本增加,因此原料價格也是Li4SiO4面向工業應用中必要的考慮因素。
為解決上述問題,推動Li4SiO4基CO2吸附材料的工業化應用,關于Li4SiO4材料合成、改性、成型、機理解析等研究工作較多。筆者總結了近3 a Li4SiO4基CO2吸附材料的最新研究進展,綜述了Li4SiO4基CO2吸附材料在吸附機理、制備方法、改性方案和成型及應用情況等,助力Li4SiO4材料后續工業化應用。
1 Li4SiO4吸附CO2機理研究
Li4SiO4對CO2的捕集通過化學反應實現,一般認為CO2與Li4SiO4的反應主要分為快速吸附和緩慢擴散2個階段,分別受表面化學反應和擴散動力學控制[34-35]。首先,CO2與Li4SiO4吸附劑在表面發生反應形成產物殼層,產物殼層可能是由Li2CO3和Li2SiO3混合組成的單殼層結構,或由內到外依次為未反應的Li4SiO4、Li2SiO3殼層和Li2CO3殼層組成的雙殼層結構,如圖1所示[6]。表面吸附反應結束后,反應進入擴散控制階段,此時,CO2、Li+和O2-的擴散成為吸附過程的決定因素[36]。ZHANG等[37]使用密度泛函理論(DFT)對Li4SiO4吸附CO2過程進行模擬,通過計算吸附能和模型結構的變化確定了CO2在Li4SiO4上的吸附機理為化學吸附,這與CO2與Li4SiO4形成Li2CO3殼層的試驗研究一致[38],反應過程[39]為
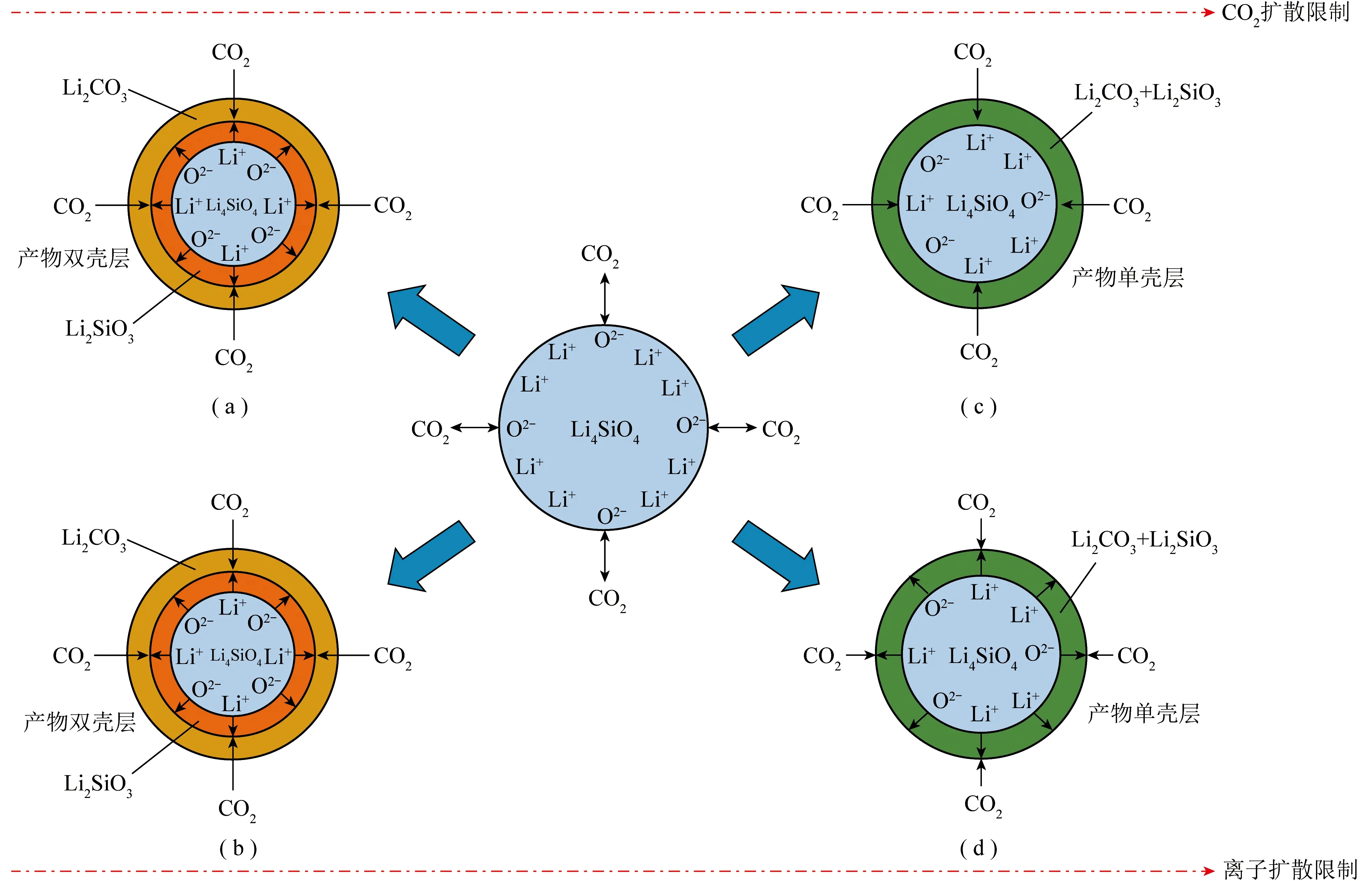
圖1 Li4SiO4吸附劑的不同吸附模型[6]Fig.1 Different adsorption models on Li4SiO4 sorbents[6]

(1)
通過分析Li4SiO4吸附動力學模型更有利于理解Li4SiO4捕獲CO2的反應機理,為吸附劑和吸附環路系統的設計提供依據和指導[40-41]。為解析Li4SiO4吸附CO2的化學吸附過程和擴散控制過程,PELTZER等[42]使用雙指數模型對Li4SiO4吸附曲線進行擬合,雙指數模型是一種動力學模型,能準確反映吸附反應中發生的2種過程,其表達式為
y=Aexp (-k1t) +Bexp(-k2t)+C。
(2)
其中,y為被吸附CO2的質量分數;t為吸附時間,s;k1、k2分別為Li4SiO4吸附過程和擴散過程的速率常數,s-1;指前因子A、B為2個階段的過程控制系數;C為Li4SiO4材料的最大吸附量。PELTZER等[42]研究發現化學吸附階段的速率常數k1比擴散控制階段的速率常數k2高出一個數量級,且二者都隨吸附溫度的增加而變大,但k1始終遠大于k2。這說明Li4SiO4吸附CO2過程的速率由CO2擴散決定,吸附溫度的升高有利于CO2向Li4SiO4內部擴散,但擴散過程仍是該材料吸附過程的決速步驟[13,43]。而RODRGUEZ-MOSQUEDA等[44]和NAMBO等[45]認為Li4SiO4吸附CO2的擴散過程是離子向外擴散的過程而非CO2向內擴散。通過改變CO2流量分析其對吸附過程的影響,并使用雙指數模型對該吸附過程進行擬合,證明了離子擴散過程是材料吸附過程的決速步驟,擴散階段的吸附速率與CO2流量無關。
2 Li4SiO4基吸附劑制備方法
雖然對于Li4SiO4吸附CO2過程的決速步驟是CO2擴散還是離子擴散存在爭議,但普遍認為通過調控Li4SiO4材料的粒徑結構有助于提高其CO2吸附活性。這是因為Li4SiO4材料通常結構致密,顆粒尺寸較大,導致Li4SiO4內部難以與CO2反應,影響材料的吸附活性。較大的顆粒還會導致Li4SiO4吸附反應中形成過厚的碳酸鹽殼層,從而影響CO2向內部擴散(圖2)[34]。

圖2 CO2在Li4SiO4上吸附/解吸過程的雙殼機制[34]Fig.2 Double-shell mechanism for the CO2 sorption/desorption process on Li4SiO4[34]
此外,Li4SiO4材料還面臨燒結問題,易造成其CO2吸附活性隨吸脫附循環的進行而持續降低。為解決上述問題,可選用合適的制備方法,調控合成Li4SiO4材料顆粒大小及孔道結構。目前已有多種合成方案,包括固相法[46-47]、溶膠凝膠法[39,48]、沉淀法[49-50]、溶液等離子體法[45]、噴霧干燥技術[51]和燃燒法[52]等被用于Li4SiO4的制備。
2.1 固相法制備Li4SiO4基吸附劑
固相法是一種將Li源和Si源機械混合并經過高溫煅燒制備Li4SiO4基吸附劑的方案,具有生產率高、成本低、操作簡單等優點,是一種最常見的Li4SiO4合成技術,所制備吸附劑的物理化學特性主要由Li源和Si源的選用、反應溫度、反應時間以及混合均勻程度決定。近年來,關于固體法制備Li4SiO4的研究有很多,BELGAMWAR等[46]通過優化Li源選擇、合成溫度和煅燒時間等,發現Li∶Si物質的量比為4.66∶1.00時,通過物理混合LiNO3和樹枝纖維狀納米硅,一般情況下Li∶Si理論物質的量比應為4∶1,但為補償Li在煅燒過程中的升華損失,Li源通常會被過量添加。研究發現在空氣中、650 ℃下熱處理6 h合成的Li4SiO4納米片具有最高的CO2吸附活性和較快的CO2吸附動力學,這是由于Li4SiO4納米片本身的特殊結構,使CO2高效擴散并與Li位點發生相互作用,最優吸附劑的CO2捕集能力接近Li4SiO4吸附理論值。吸脫附循環過程中,Li4SiO4納米片既未形成碳酸鹽外殼,也未出現燒結現象,循環穩定性優異。YANG等[47]以Li2CO3和SiO2為前驅體,采用傳統固相法合成了Li4SiO4材料,并在此基礎上通過兩步法對其進行丙酸酸化和Na摻雜(圖3)。結果表明,2種改性方法均有助于提高Li4SiO4吸附劑的性能。研究還發現丙酸酸化主要改善了吸附劑的孔隙結構,擴大了吸附劑的比表面積。而摻雜的Na2CO3可與吸附產物Li2CO3組成共晶熔融態軟殼,CO2更易通過液態殼層,從而有助于提升材料的CO2吸附量。丙酸酸化和Na摻雜改性的Li4SiO4吸附劑經多次CO2吸脫附循環后,轉化率能保持在87%以上。在傳統固相法的基礎上,多使用球磨法對Li源和Si源混合。相比人為研磨,該方法具有耗時少、人為干擾小和混合均勻度高等優點。SUPRIYA等[53]采用行星球磨機對LiOH和SiO2進行機械混合,并于700 ℃下焙燒制備了Li4SiO4。經高頻率球磨合成的Li4SiO4吸附劑顆粒近似為球形,對CO2的吸附容量可達30.5%,循環10次后仍能保持穩定的吸附能力。分析該吸附劑的形貌和比表面積發現材料表面呈致密的片狀形態,具有較小的粒徑和豐富的孔道結構。吸附劑與CO2反應后,其表面微觀形貌由片狀變為長方體,而CO2解吸后,Li4SiO4吸附劑又恢復為原有的片狀結構。通過對吸附前后和再生后的材料進行XRD分析發現材料的吸附態和解吸態之間可以完全轉化,這種可逆的變化特征使得該材料表現出良好的循環穩定性。
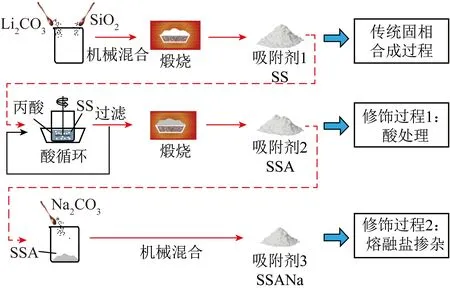
圖3 兩步法改性Li4SiO4吸附劑的制備工藝示意[47]Fig.3 Schematic sketch of the preparation process of the two-step modified Li4SiO4 absorbents[47]
2.2 溶膠凝膠法制備Li4SiO4基吸附劑
Li4SiO4的溶膠凝膠法合成通常包括3個步驟(圖4)[39]:① 將Li和Si的前驅體(在液相中)均勻混合,通過水解和縮合化學反應形成穩定的透明溶膠體系(通常是含有高度化學活性成分的化合物);② 凝膠化顆粒緩慢聚合形成三維網狀結構的凝膠,且凝膠網絡中充滿失去流動性的溶劑;③ 通過烘干、煅燒凝膠,最終得到Li4SiO4材料。與固相法相比,溶膠凝膠法中Si源和Li源混合更均勻,有利于形成均一的空間網絡結構,從而使Li4SiO4合成反應更易進行,溫度通常較低。ZUBBRI等[48]以LiNO3和正硅酸乙酯(TEOS)為前驅體,采用溶膠凝膠法合成Li4SiO4,對Li、Si物質的量比、煅燒溫度和煅燒時間等參數進行優化,并對優選材料進行多次CO2循環吸脫附試驗。研究發現700 ℃為Li4SiO4材料的最佳合成溫度,最佳煅燒時間為5 h。所合成材料在700 ℃時的CO2吸附量可達理論吸附值的93%。但吸附劑的循環穩定性較差,10次循環后,CO2吸附能力下降16.2%。WANG等[54]以氣相法制備的SiO2、LiOH和檸檬酸為原料,采用溶膠凝膠法合成了Li4SiO4吸附劑,研究了金屬元素摻雜對Li4SiO4的影響。通過對該吸附材料進行結構分析和性能測試,發現Ce、Cr和K摻雜后的Li4SiO4顆粒變小,比表面積和孔徑均有所提高,通過動力學模擬發現其吸附量和吸附速率相對于未摻雜的Li4SiO4有極大提升,尤其以Ce摻雜表現最好,其速率常數較純Li4SiO4提升了1倍。
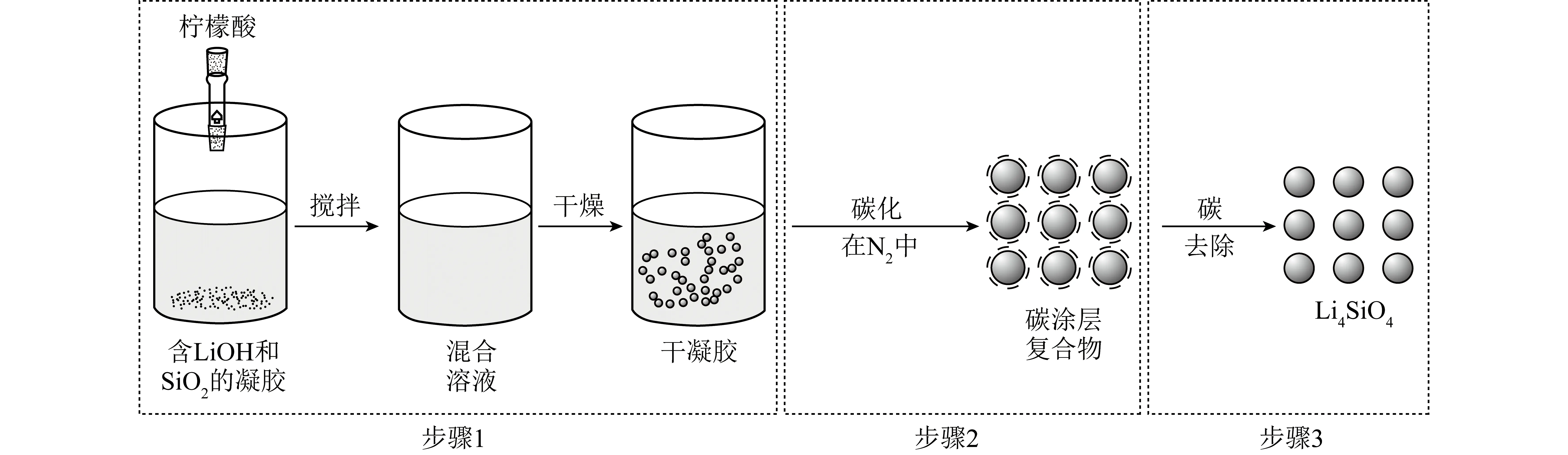
圖4 檸檬酸基溶膠凝膠法結合碳包覆法合成示意[39]Fig.4 Schematic sketch of citric acid sol-gel method combined with carbon coating method[39]
2.3 沉淀法制備Li4SiO4吸附劑
沉淀法是一種將含有Si源與Li源的溶液混合,所得懸浮液在高溫下攪拌、干燥,最后煅燒得到Li4SiO4吸附劑的制備方法。由于制備過程中各組分分散在液體中,與固相法相比,沉淀法合成過程中Si源和Li源混合相對均勻,通過該方法獲得的Li4SiO4粒徑可低至3 μm,僅為固相法制備材料的1/10[55],因此沉淀法合成的Li4SiO4顆粒通常具有更強的吸附能力和更快的吸附速率[49]。SHAN等[49-50]以硅藻土為Si前驅體,采用浸漬沉淀法合成了Li4SiO4基吸附劑,并與以硅藻土和SiO2為原料使用固相法合成的Li4SiO4吸附劑進行CO2吸附性能比較。吸附溫度700 ℃、吸附時間100 min時,通過浸漬沉淀法合成的Li4SiO4的CO2最大吸附量達到29.89%,高于固相法合成的以SiO2為Si源合成的Li4SiO4樣品(11.34%)和以硅藻土為Si源合成的Li4SiO4樣品(24.23%)。此外,通過浸漬沉淀法合成的材料吸附15 min后,其吸附容量可達到最大吸附量的96%,且經過15次循環后,CO2吸附量僅下降了1.05%,材料具有快速的吸附速率和良好的循環穩定性。YANG等[52]利用SiO2溶膠和2種不同的有機Li(無水醋酸鋰和乳酸鋰),通過浸漬沉淀法制備了Li4SiO4。該吸附劑表面粗糙,有助于增加其CO2吸附活性點位數量,從而使材料表現出更高的CO2捕集容量。測試該材料的CO2循環吸脫附性能發現,CO2體積分數15%時,其吸附量約為固相法制備Li4SiO4的8倍,且在40次循環吸脫附測試中,該材料的CO2吸附量持續增加(圖5),這主要是由于CO2脫附過程促進了Li4SiO4材料形成微孔。

圖5 Li4SiO4吸附劑合成工藝及吸附性能[52]Fig.5 Synthesis process and adsorption performance of Li4SiO4 adsorbent[52]
2.4 其他方法制備Li4SiO4吸附劑
除固相法、溶膠凝膠法、沉淀法外,近年來,其他新的合成方法陸續被報道,如溶劑等離子體法、噴霧干燥法和燃燒法等。其中溶劑等離子體法僅需1 min即可合成Li4SiO4吸附劑,大幅縮短合成時間,這是由于等離子體火焰中產生的自由基和離子對Li4SiO4相的快速成核和生長動力學起關鍵作用;噴霧干燥法可通過減少Li4SiO4前驅體烘干過程所用時間,達到降低能耗的要求;而燃燒法可通過降低煅燒溫度減少Li源損失以制備純Li4SiO4相,提高活性組分含量。NAMBO等[45]對混合后的吸附劑前驅體進行等離子體氧化成功合成了Li4SiO4納米線(圖6),納米線吸附劑比表面積達10.2 m2/g,平均孔徑為11.5 nm,其CO2吸附量在3 min內即可達到25%,CO2吸附速率非常快,經160 min吸附,其飽和吸附量可達35%。然而,這種Li4SiO4納米線的再生性能較差,僅經過1個吸脫附循環后,其CO2吸附容量便從33%降至25%。對于大多數Li4SiO4合成方法,干燥步驟通常在烘箱或水/油浴中進行,消耗能量且過程緩慢。為實現快速高效制備,HU等[51]采用噴霧干燥技術對Li4SiO4前驅體進行霧化并與熱空氣接觸后被迅速干燥,從而節省了傳統合成方法中烘干過程所需時間。該吸附劑具有CO2吸附量高和循環穩定性好等特點,在體積分數15%的CO2氣氛下循環吸脫附50次后,CO2吸附量僅從27.5%降至24.8%,這主要歸功于其細小的粒徑、較高的比表面積、大孔容和豐富的孔隙率。此外,RAO等[56]通過溶液燃燒法以甘氨酸作為燃料,硅酸和LiNO3為前體合成了Li4SiO4納米粒子。燃料氧化劑比例對燃燒過程和合成演化影響較大,通過對其進行調控,合成溫度700 ℃時制備出純度較高的Li4SiO4,平均粒徑為72 nm,比表面積為26.7 m2/g,700 ℃時其CO2吸收容量可達30.7%。但溶液燃燒法制備的Li4SiO4粉末更易發生燒結,燃燒至900 ℃時,線性收縮率為11.1%,而固相法制備的Li4SiO4粉末線性收縮率為4.67%,說明溶液燃燒法更易導致材料在吸脫附循環過程中的球團化。

圖6 溶劑等離子體合成方法示意[45]Fig.6 Schematic of the solvo-plasma synthesis method[45]
合成路線對Li4SiO4吸附劑的粒徑、孔隙率、比表面積等特性有重要影響,而這些特性又影響吸附劑的CO2吸附性能。從合成溫度來看,生產Li4SiO4通常需要較高的煅燒溫度,這意味著材料生產能耗高。此外,高溫煅燒易導致Li源損失和材料孔道結構坍塌。而溶膠凝膠法、沉淀法等能保證前驅體中Li和Si分布更均勻,從而降低Li4SiO4材料合成溫度、縮短合成時間。從CO2吸附容量看,溶膠凝膠法、沉淀法和燃燒法所得的Li4SiO4吸附劑粒徑相對較低,因此CO2吸附性能普遍較好(通常在30%左右)。但考慮經濟效益,固相反應法相比其他工藝,材料生產過程簡單,合成成本更低,仍是合成Li4SiO4吸附劑的主要途徑。但傳統固相法衍生的Li4SiO4吸附劑的CO2吸附性能還有待提升。因此,綜合考慮生產成本、合成材料的CO2捕集活性、循環穩定性等因素,針對現有方法進行改進或開發新型低成本合成技術,高效生產Li4SiO4吸附材料,對推動固體吸附劑捕集CO2的工業應用具有重要意義。
3 Li4SiO4基吸附劑的改性研究
雖然優化制備方法可合成具有較高比表面積和孔隙率的Li4SiO4吸附劑,但由于所制備的吸附劑對吸附溫度及CO2濃度要求較高,仍未充分發揮其理論潛力。考慮到Li4SiO4基吸附劑可在火電廠煙氣中及一些可逆反應(如水煤氣變換反應和蒸汽甲烷重整)中原位去除CO2,其溫度通常控制在450~700 ℃,CO2體積分數在4%~20%[57-58]。在相對較低的吸附溫度和CO2濃度下,Li4SiO4吸附劑的吸附活性、吸脫附速率和循環穩定性都需進一步提高[57,59-61]。因此研究人員使用不同制備方法合成Li4SiO4吸附劑的過程中對材料進行改性,主要包括改進吸附劑的微觀結構、優化吸附劑前驅體、摻雜金屬離子和負載熔融鹽等手段。
3.1 微觀結構優化
固體Li4SiO4吸附劑對CO2捕集是一種氣固反應,固體材料的粒徑、表面結構和孔隙率等對其吸附活性影響很大,大多研究通過合成Li4SiO4納米材料提高其CO2捕獲容量[45,62-64],這是由于納米顆粒中CO2和離子等擴散路徑比傳統微米級團聚體短,緩解了Li4SiO4基吸附劑在擴散控制階段動力學受限問題。此外,Li4SiO4納米結構粉體在吸脫附循環中也表現出更好的可逆吸附活性,更適用于實際工程中CO2捕獲。而WANG等[65]使用葡萄糖對吸附劑前驅體進行輕微燃燒以改性吸附劑結構。首先將吸附劑前驅體和葡萄糖混合并在500 ℃和純N2氣氛下進行熱解,最后在700 ℃空氣中煅燒4 h,合成了一種具有明顯高孔隙狀納米團簇(50~100 nm)形貌的Li4SiO4吸附劑,有利于CO2在材料表面的快速吸附(圖7,透明孔代表大孔)。吸附過程中,Li2CO3層上存在一種納米級的Li2SiO3覆蓋層,這種特殊的結構可加速CO2遷移和熔融層上Li+和O2+的擴散,增強了吸附材料對CO2的吸附速率。YANG等[47]使用丙酸處理合成的Li4SiO4,發現酸化過程可顯著減小吸附劑晶粒尺寸,促進其孔隙形成并增大了材料比表面積。這是由于酸化過程中,丙酸填充了Li4SiO4吸收劑本身存在的裂縫或孔隙,進而在煅燒過程中,丙酸迅速分解釋放出豐富的氣體,氣體壓力沖擊使吸附劑形成大量微孔,這種多孔材料更有利于CO2吸附反應的發生。LI等[66]發現經木醋酸處理后的Li4SiO4表面呈波紋狀,具有較高的比表面積,這有利于其對CO2的吸附。通過吸附性能測試發現,處理后的Li4SiO4不僅具有相對較高的吸附容量,還具有優良的循環穩定性。而YANG等[67]為降低改性成本,向Li4SiO4吸附劑中加入等量水并通過球磨機進行機械化學活化,所制備吸附劑的活性明顯提升,這是由于該活化過程產生了層狀納米LiOH顆粒,有效增大了吸附劑的比表面積和孔隙率。一般認為較大的比表面積有利于Li4SiO4基吸附材料的吸附動力學,但GRASSO等[68]發現室溫下比表面積較大的Li4SiO4會出現老化現象,空氣中水蒸氣會促使比表面積較大的Li4SiO4活化生成Li2O和Li2SiO3,隨后Li2O出現羥基化,形成的LiOH和LiOH·H2O會覆蓋在Li4SiO4表面,降低Li4SiO4吸附量,但老化后的Li4SiO4吸附容量可通過高溫煅燒恢復。

圖7 Li4SiO4雙殼反應機制示意[65]Fig.7 Schematic of double-shell mechanism occurred in Li4SiO4[65]
3.2 Si源和Li源的選擇
一般來說,含Li鹽類都可作為Li源用于合成Li4SiO4吸附劑,目前利用較多的主要有LiNO3、LiOH、Li2CO3及有機Li源等。FANG等[69]分析了無機Li源對Li4SiO4吸附劑結構和CO2吸附/解吸性能的影響,發現以LiNO3為原料,在較低溫度下合成可以減緩材料燒結,提高其比表面積。合成材料的CO2初始吸附量高于Li2CO3制備的Li4SiO4吸附劑。經過15次循環后,LiNO3制備的Li4SiO4表現出優異的循環穩定性,而LiOH合成的Li4SiO4循環后吸附量下降了80%。這是因為LiNO3衍生Li4SiO4表現出較高的比表面積和孔隙率,且其比表面積會隨循環繼續增加。雖然LiOH制備的Li4SiO4孔道結構豐富,但其在吸脫附過程中出現了燒結問題,導致循環吸附活性下降。而由Li2CO3合成的Li4SiO4材料比表面積較低,在CO2吸附/解吸過程中活性較低,循環前后其形貌和表面積幾乎沒有變化。除無機Li源,有機Li鹽被認為更有利于制備具有高孔隙率的Li4SiO4顆粒,HU等[70-71]研究了多種有機Li源制備的Li4SiO4吸附劑,發現較傳統吸附劑,有機Li制備的Li4SiO4在低CO2濃度下的循環吸附性能更優,其中由Li2C2O4合成的Li4SiO4吸附劑在CO2體積分數15%、經100個循環后,其吸附量仍達27.14%。為降低Li源成本,TONG等[72]開辟了一條從廢棄鋰電池中獲得Li源的路線,并成功合成了Li4SiO4。對比可知其合成成本僅為Li4SiO4常規合成成本的1/20~1/3。通過吸脫附循環測試發現,CO2體積分數15%、經42個循環后,該材料的吸附容量穩定在19%左右。由于可選Li原料相對有限,與探索Li源相比,研究人員更關注選用不同Si源以直接調控吸附劑顆粒的形貌。在合成過程中SiO2將形成Li4SiO4骨架,對其孔隙結構影響更大,直接決定了材料的吸附活性。由于分子篩具有豐富的孔隙率和較高的比表面積,與普通SiO2粉末相比,與Li+接觸更充分,有望制備出更高活性的Li4SiO4吸附劑[73]。PAN等[74]以SBA-15為原料成功合成了Li4SiO4。優化后,材料的CO2捕獲能力高達36.3%,遠高于傳統SiO2合成的Li4SiO4,達到其理論吸附量的99%。該材料也表現出較高的循環穩定性,15次循環后其容量損失僅為1%。SUPRIYA等[75]研究了多種有機Si合成的Li4SiO4材料,發現甲基三甲氧基硅烷所合成的Li4SiO4在10個CO2吸脫附循環中,吸附能力保持在31%,說明可水解的脂肪族有機Si是較好的Li4SiO4吸附劑制備前驅體。隨著工業界對CO2捕集技術需求日益增加,吸附劑合成成本受到關注,天然含硅礦物[76-78]和含硅廢料[79-80]開始作為合成原料。天然礦物中Si質量分數在45%~70%,Si含量決定了Li4SiO4基吸附劑純度,從而影響其吸附活性。此外,礦石中還存在雜質組分,可能造成活性組分含量降低,但也有部分雜質元素能促進材料的CO2吸附過程[76]。NI等[77]選用膨脹珍珠巖作為Si源制備了Li4SiO4材料,極大提升了其在500~650 ℃溫度窗口的吸附活性。這是由于與SiO2合成的Li4SiO4相比,膨脹珍珠巖制備的吸附劑顆粒尺寸更小、表面更粗糙,這主要基于膨脹珍珠巖的多孔結構。此外,該吸附劑還表現出了良好的CO2吸脫附穩定性,這可能得益于礦石中惰性組分的支撐作用。YANG等[81]發現以天然硅灰石為原料合成Li4SiO4基吸附劑,在體積分數15%的CO2氣氛下吸脫附循環過程中,吸附容量可達17.5%,證明天然硅灰石中存在的CaO在吸附反應中可與Li2SiO3發生作用生成Li2CaSiO4,可促進Li4SiO4吸附反應,同樣,Li4SiO4也可與CaCO3生成Li2CaSiO4以促進CaO吸附反應。但該材料循環穩定性較差,主要是由于吸附劑中CaO的存在易導致材料發生燒結。LI等[82]以典型農林廢棄物甘蔗渣為Si源,制備了具有優異CO2吸附性能的Li4SiO4基吸附劑。認為甘蔗渣灰中雜質元素的存在會導致吸附劑制備過程中產生復雜的副反應,從而降低吸附劑的吸附性能。為克服這種負面影響,首先對甘蔗渣進行酸洗,去除樣品中的金屬離子(Ca2+、Fe3+等)及水溶性雜質(K、P、S等)。經酸洗后甘蔗渣合成的吸附劑最大吸附量約32%,且循環10次以上后仍能保持良好的吸附性能。ALCNTAR-VZQUEZ等[80]使用鋼鐵渣為原料合成Li4SiO4基吸附劑。研究發現在高溫和低CO2濃度條件下,該吸附劑相比純Li4SiO4具有更高的吸附容量、更快的吸附速率和更高的吸脫附循環穩定性。此外,LI等[79]使用煤渣合成的Li4SiO4吸附劑在650 ℃,CO2體積分數100%吸附條件下吸附容量為36.3%,但材料循環穩定性較差。
3.3 金屬離子摻雜
研究發現Li4SiO4合成過程中使用一些異質元素替換部分Li+,在降低材料合成成本的同時還獲得了比純Li4SiO4具有更好CO2吸附性能的Li4SiO4基材料。HIRAI等[83]對Li3NaSiO4的CO2吸附性能進行評價,發現Li3NaSiO4對CO2的吸附和脫附反應可逆,即使在較低CO2濃度下,Li3NaSiO4仍能進行較快的表面反應,且其反應速率高于Li4SiO4。KWON等[84]也得到了相似結論。除Na摻雜,K摻雜Li4SiO4已被證明是提升材料CO2吸附活性的有效手段。SALAZAR HOYOS等[85]發現K摻雜后吸附劑的吸附能力對溫度的依賴性降低,在500 ℃、CO2體積分數50%氣氛下其吸附容量遠高于未摻雜的Li4SiO4吸附劑,吸附量相差10%左右。研究發現K+會替換Li4SiO4中部分Li+生成KLi3SiO4,該物相的存在有利于提高吸附劑的吸附速率[54,85-87]。研究發現在Li4SiO4吸附劑中添加某些金屬雜質元素可緩解材料在吸附/解吸循環過程中出現的燒結問題[88]。因此,為了提高Li4SiO4在高溫條件下的穩定性,加入熱化學穩定的第二相是解決方案之一。ZHANG等[37]通過DFT計算對B、Al和Ga的摻雜,并研究其在Li4SiO4表面的促進作用,發現B、Al和Ga的摻雜對Li4SiO4與CO2相互作用的影響主要取決于被替換元素的類型。B、Al和Ga被負載在Li4SiO4晶格表面或替換Li進入晶格時,元素摻雜抑制了材料對CO2的吸附過程,促進了吸附后材料的解吸,而當Si作為被替換原子時則顯現相反機制。此外,Al元素摻雜還可提高Li4SiO4吸附劑的循環穩定性[89]。而LIU等[90]持相反觀點,使用含有Ti4+和Al3+的硅源制備Li4SiO4基吸附劑時,發現該Li4SiO4基吸附劑的吸附速率高于純Li4SiO4吸附劑,研究認為Li4SiO4樣品中均勻分布的Ti4+和Al3+會取代Li4SiO4晶格中的Li+,增強Li+和O2-的擴散,從而促進晶粒外表面與CO2的反應(圖8)。YANG等[91]采用石墨模壓法一步制備了摻Nd的Li4SiO4吸附劑顆粒(圖9),結果表明,Nd摻雜對制備的球團具有三重效應,包括合成Li4SiO4球團的煅燒過程中,Nd(NO3)3摻雜劑分解釋放出大量氣體,會在球團內部形成新的孔隙和縫隙,有利于增大球團的孔隙率和CO2吸附能力;摻Nd后的大部分Li4SiO4顆粒之間形成了惰性Nd2O3骨架,可有效緩解Li4SiO4球團在高溫再生過程中的燒結現象,從而提高了球團的循環穩定性;少量Nd可轉化為納米級的Nd顆粒覆蓋在Li4SiO4晶格表面,并引起晶格壓縮和缺陷,提高了吸附劑球團對CO2的吸附性能。上述作用使摻雜Nd后的Li4SiO4具有較高的穩定容量,CO2體積分數為15%時,經過20次吸附循環后的吸附劑吸附容量可達20%,且摻雜后的吸附劑轉化率提高了13.63%。GONG等[92]通過試驗證明Al的摻雜替換了Li4SiO4中部分Si。此過程增加了Li4SiO4的晶格畸變,從而降低了晶粒生長的活化能,明顯提高了Li4SiO4的抗壓強度和導熱系數。WANG等[54]比較了K、Mg、Cr、Ce等金屬元素摻雜對Li4SiO4的影響。XRD結果表明,在相同條件下,Ce比其他金屬元素更難摻雜到Li4SiO4晶格中,但Ce的摻雜更有效抑制了晶體聚集。Ce摻雜后的Li4SiO4吸附解吸過程更快,吸附容量更高,這主要是由于CeO2在Li4SiO4吸附劑中阻止了顆粒燒結,因而Ce-Li4SiO4在10次吸附/解吸循環后仍保持良好的吸附性能。但CeO2作為一種惰性添加劑,不參與CO2吸附,CeO2添加量過多時,會導致材料吸收能力下降。WANG等[93]使用NaBr對Li4SiO4吸附劑進行修飾,發現Na+和Br-均可被摻雜到Li4SiO4結構中。而Br-的摻雜使Li4SiO4吸附劑顆粒具有更小的尺寸及更豐富的孔道結構,這些都有利于化學吸附,證明了非金屬離子改性的可行性。
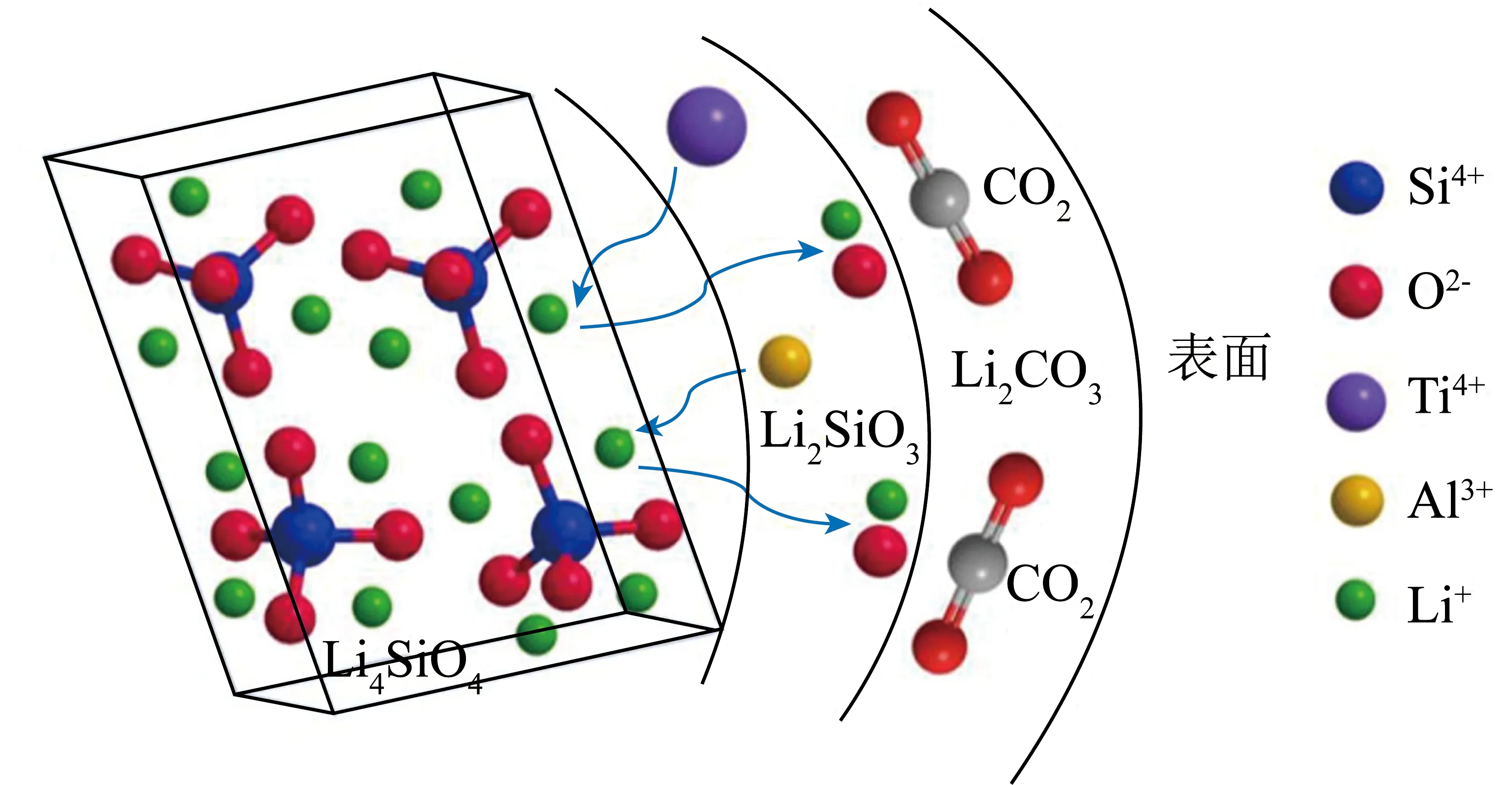
圖8 金屬摻雜后的Li4SiO4材料的吸附機理示意[90]Fig.8 Schematic of adsorption mechanism of metal doped Li4SiO4 material[90]
3.4 熔融鹽負載

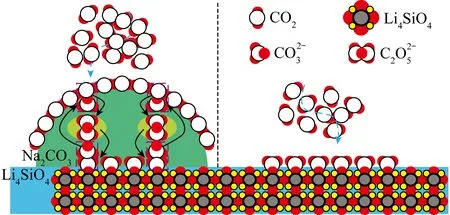
圖10 有無Na2CO3負載對Li4SiO4不同CO2捕獲過程示意[94]Fig.10 Schematic drawing of different CO2 capture processes by Li4SiO4 with or without Na2CO3 load[94]
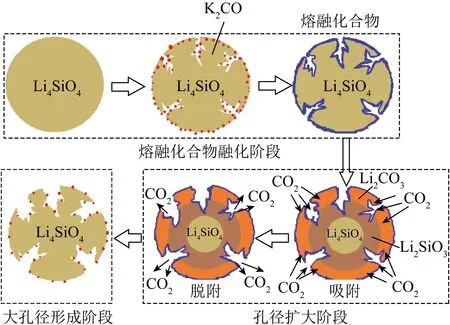
圖11 K2CO3負載Li4SiO4吸附劑的孔核模型示意[96]Fig.11 Schematic of proposed pore-core model for K2CO3 loaded with Li4SiO4 sorbent[96]
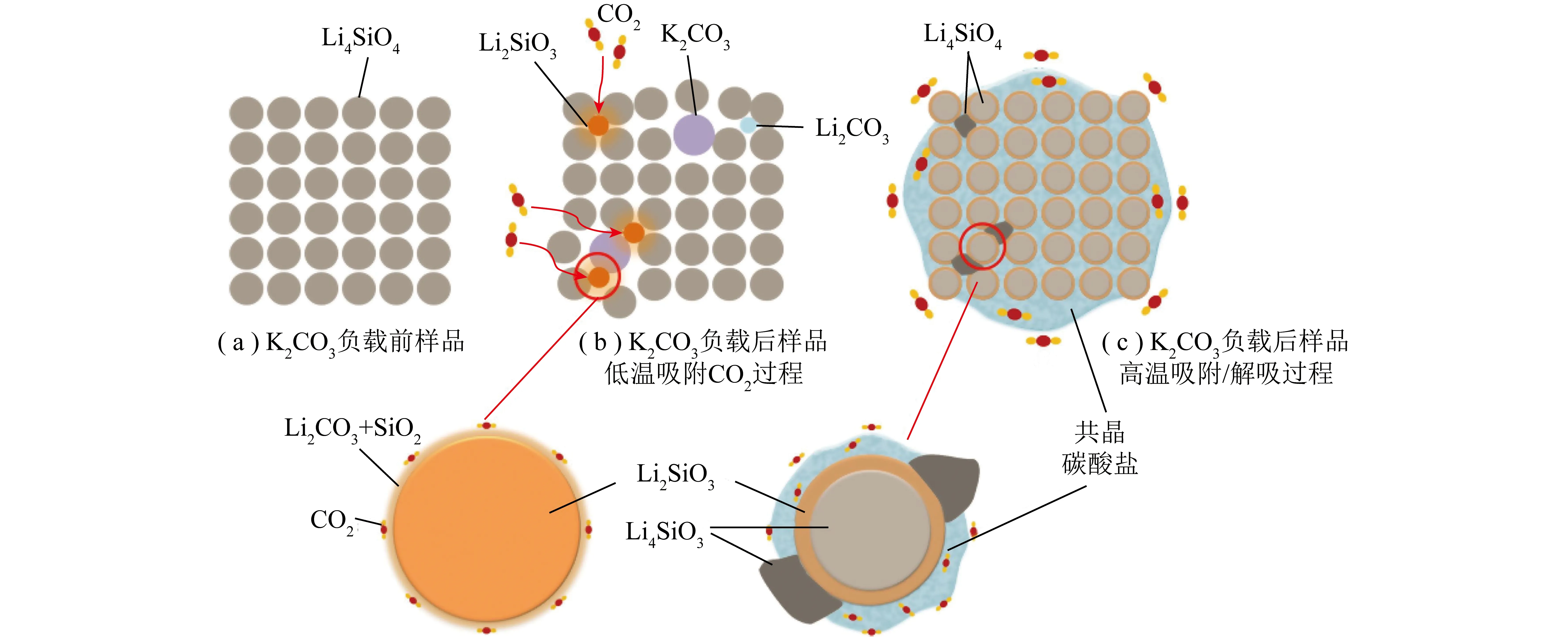
圖12 負載K2CO3后的Li4SiO4吸附劑對CO2的吸附示意[97]Fig.12 Schematic of CO2 adsorption on K2CO3 loaded with Li4SiO4 sorbent[97]
目前低CO2濃度下的動力學限制是Li4SiO4吸附劑面臨的主要問題。Li4SiO4吸附CO2的吸附速率由擴散控制,提高材料比表面積和孔隙率是解決該問題的有效途徑。表面處理方法可改變吸附劑結構,進而提高材料吸附活性。Li4SiO4改性策略及最終循環捕集容量見表1,可知Li源和Si源作為參與合成Li4SiO4反應的主要物質,其性質直接影響吸附劑的粒徑和微觀結構,達到調控Li4SiO4的CO2吸附性能的目的。此外,通過調控材料吸附過程中表面生成的Li2CO3殼層也能提高CO2擴散速率,一般通過負載碳酸鹽形成混合鹽體系,使Li2CO3殼層形成熔融態混合鹽,以增加Li4SiO4吸附活性。Li4SiO4材料的CO2吸附活性可通過多種方法改善,負載堿性碳酸鹽最常見,但可能加劇循環設施結垢結渣等。
4 Li4SiO4基吸附劑的成型及應用
通過優化合成條件、改性等手段可以得到具有較高CO2吸附活性和循環穩定性的Li4SiO4材料,但是目前研究報道多集中于粉末吸附劑,而非成型材料實際應用中淘析、壓降過大等問題。因此,Li4SiO4投入工業應用前,吸附劑的成型是關鍵步驟。常見的成型方法有機械擠壓法、擠壓滾圓法、涂覆法等,一般根據吸附工藝所需應用場景選用不同的造粒技術獲得具有特定形貌的吸附材料。對于成型吸附劑,除了考慮其CO2吸附活性外,機械強度也是評價其性能的重要指標。Li4SiO4作為高溫CO2吸附材料,還可以被用于吸附增強型產氫反應的CO2捕獲分離[98],但缺少應用實例。因此,對于Li4SiO4在蒸汽重整制氫反應中的CO2捕集、放大試驗等也是研究重點。
4.1 成型研究
機械擠壓法是傳統的吸附劑成型手段,有學者通過擠出機[99-100]和機械壓機[101]生產出圓柱形Li4SiO4顆粒,但非球形顆粒在流化床中易磨損,造成吸附材料損失。對此,研究人員通常利用滾圓等手段制備球形Li4SiO4吸附劑,以契合流化床的應用。HU等[102]使用擠壓滾圓法制備了Li4SiO4球團,該顆粒具有良好的機械強度,可以承受3 N擠壓力。但擠壓成型過程通常會造成材料被壓實,吸附劑比表面積下降,導致其CO2吸附性能明顯下降。為了解決該問題,在吸附劑造粒過程一般會加入造孔劑,以增加材料比表面積(表2)。NI等[77]和LI等[103]向合成的Li4SiO4基吸附劑球團中添加瓊脂優化其孔道結構,造孔劑在高溫煅燒過程中會產生大量氣體使得球團產生豐富的孔隙結構,增大了比表面積,從而改善吸附劑球團的吸附性能,與未添加造孔劑的材料相比,吸附性能分別提升了3.65%和2.10%。MA等[104]利用聚乙烯作為造孔劑,使合成的Li4SiO4吸附劑球團形成了多孔的微觀結構。與未使用造孔劑的材料相比,其吸附性能提升了19%。所制備顆粒材料的CO2吸附容量經4個循環后穩定在31%,同時具有一定的抗壓強度和耐磨性。而HU等[105]使用低成本的稻殼作為成孔劑,研究發現稻殼成孔劑不僅能夠改善Li4SiO4微球結構,稻殼中含有的堿性成分在吸附過程中還會與Li2CO3形成熔融相從而降低CO2擴散阻力,促進該吸附劑微球對CO2的吸附,其吸附量幾乎是未使用造孔劑材料的2倍。但研究同時也發現高溫燃燒后的稻殼灰會堵塞吸附劑微球的部分孔隙,從而降低了材料的比表面積。此外,YANG等[107]采用石墨成型法直接合成Li4SiO4吸附劑球團,所制備的吸附劑球團粒徑比較均勻,在2.0~2.5 mm,吸附劑微球50次循環后的吸附容量達到22%,循環吸脫附2 000次后的吸附量損失僅為6.72%。YANG等[91]將合成、造粒和摻雜相結合,一步制備出高性能Nd摻雜的Li4SiO4基吸附劑球團。除了將Li4SiO4基吸附劑造粒外,SUBHA等[108]通過涂覆得到了以多孔碳板為載體支撐的成型Li4SiO4吸附劑。通過性能測試發現該成型吸附劑的吸附容量為21.4%,經8次循環后,吸附量不變。此外,該成型材料的CO2吸附速率提升至37.5 mg/(g·min)。
4.2 Li4SiO4吸附劑的應用
對于Li4SiO4高溫CO2捕集應用,HU等[6]提出了Li4SiO4環路系統的概念(圖13),該系統主要由一個吸附反應器和一個解吸反應器組成。待處理氣體流經吸附反應器時,CO2組分與活性Li4SiO4吸附劑發生反應從而被固定。吸附后的材料(Li2CO3、Li2SiO3)被送入脫附反應器實現再生,而后被運回吸附反應器實現循環吸脫附。同時,在解吸反應器出口處可得到濃縮CO2,進一步用于運輸和儲存。值得注意的是,盡管上述過程可以在填料床反應器中通過變壓吸脫附(PSA或VSA)實現材料循環利用[109],但目前多通過調控循環流化床反應器溫度使吸附劑再生,稱為變溫吸附(TSA)。雖然Li4SiO4吸附劑并未投入實際CO2捕集應用,但越來越多的研究開始關注材料吸附CO2的工程能耗評測,為吸附劑的實際應用奠定理論基礎。SALEH等[110]通過工程模擬評估了基于Li4SiO4的環路系統與天然氣聯合循環(NGCC)發電廠結合后的熱集成,發現吸附材料的性能和再生溫度對該應用路線的發電效率和能量損失影響較大。由塔曼溫度與熔點成正比可知,Li2SiO3和Li2CO3塔曼溫度低于Li4SiO4,而操作溫度高于塔曼溫度時,材料發生燒結,這說明Li2SiO3和Li2CO3相比Li4SiO4更易發生燒結。而解吸過程中,CO2的存在會阻礙解吸反應進行,加劇材料燒結情況,從而導致吸附劑在循環過程中CO2吸附量降低[66,111]。研究認為使用改性后的Li4SiO4吸附劑,即具有高活性且低再生溫度的材料,可進一步降低該工程能耗。考慮到煙氣中可能存在SO2、NOx、O2等氣體,YUAN等[112]發現在有氧條件下,Li4SiO4吸附劑極易發生硫酸化。該反應會降低Li4SiO4基吸附劑的CO2捕獲性能,因此CO2捕集裝置應設置在煙氣脫硫脫硝之后。

圖13 基于Li4SiO4吸附劑的TSA再生循環CO2捕集過程示意[6]Fig.13 Schematic of the cyclic CO2 capture process based on Li4SiO4 sorbents by TSA regeneration[6]
吸附增強型產氫工藝通過將CO2捕集與蒸汽重整過程結合,使蒸汽重整反應的化學平衡向產氫方向進行[113]。QIAO等[114]利用農業廢棄物稻殼作為Si源制備Li4SiO4基吸附劑,并將其應用于吸附增強型乙醇蒸汽重整過程中。通過建立固定床系統模型來評估系統能耗,研究發現添加Li4SiO4會降低重整能耗同時提高H2產率。溫度600 ℃,蒸汽流速0.2 m/s,乙醇與水的物質的量比為1∶6時,該過程的H2產率可達99.54%。而WANG等[115]利用2個平行固定床反應器交替進行吸附增強型乙醇蒸汽重整反應,測試K改性的Li4SiO4基吸附劑在重整反應中的CO2捕集性能。研究發現前40 min,重整產物始終只有H2和CH4,此時產生的CO2被完全吸附,即使反應時間延長至400 min,重整生產的H2純度仍保持在95%以上。DOMENICO等[116]發現相比CaO,使用Li4SiO4更有利于煤氣化反應,Li4SiO4不僅可作為CO2吸附劑促進產氫,在煤氣化反應中還存在催化效應,這與Li4SiO4吸附CO2后生成的Li2CO3有關。煤氣化反應中,生成的Li2CO3在高溫下被還原為Li,單質Li可作為催化劑降低氣化反應的活化能。同時氣化過程又可促進Li2CO3生成,加強催化反應。在吸附和催化作用的協同下,煤氣化反應速率提高了10倍以上。此外,對CO2吸附材料進行捕集/催化轉化一體化是其另一個應用方向,該過程可對CO2進行捕獲隨后轉化為高附加值化學品。KIM等[117]以CaO為CO2吸附劑、Ni/MgO-Al2O3為催化劑,將2種材料按質量比1∶1混合作為集吸附催化一體的多功能材料,使用CH4在720 ℃下對吸附后材料再生,可在反應器中直接釋放捕獲的CO2,并將CO2還原成H2和CO。該系統中CO2轉化率可達96.3%,經10個循環后轉化率降至95.3%。ZHOU等[118]制備了2D層狀Ni-MgO-Al2O3納米片,用于集成CO2捕集和甲烷化。該過程共分為2步:第1步可以吸附CO2,第2步可在H2吹掃下轉化為CH4。這一過程中,被吸附的CO2直接作為原料轉化,可避免傳統CCUS途徑中解吸能耗。對于恒溫吸脫附,長時間循環測試發現該過程幾乎100%去除CO2,為傳統TSA和PSA技術效率提升提供了解決方案。但對于Li4SiO4吸附劑,其在CO2原位轉化方面研究較少,基于MgO、CaO等的捕集/催化轉化技術可為Li4SiO4吸附劑的應用提供借鑒。
Li4SiO4吸附劑的成型是其工業化應用的前提,越來越多研究開始關注Li4SiO4吸附劑的造粒成型技術。對于成型顆粒,機械強度是重要指標,傳統方法通過添加黏合劑提高顆粒的抗壓強度,但黏合材料過量又會造成吸附劑CO2捕集性能下降。為提高成型材料的吸附活性,造孔劑常被用來改善顆粒的孔道結構,但會影響顆粒的機械強度。同時具有高吸附活性和高機械強度的球形Li4SiO4吸附劑制造技術仍有待開發。此外,為了考察Li4SiO4吸附劑對工業CO2捕集應用的可行性,許多研究開始關注放大試驗、工藝能耗、工程模擬等,說明Li4SiO4基吸附劑已開始從基礎研究向工程應用過渡,但還存在較多問題。其中,開發低CO2濃度下具有高吸附動力學和優異循環穩定性的成型Li4SiO4吸附劑仍是主要任務。
5 結語與展望
分別從Li4SiO4制備方法、改性方法和成型及應用3方面梳理了Li4SiO4吸附劑在高溫CO2捕集領域中的最新研究進展。目前合成Li4SiO4吸附劑的制備方法較多,其中固相法更具有經濟性并適用于大規模生產,但得到的吸附劑活性有待提升。溶膠凝膠法、沉淀法和燃燒法所得Li4SiO4吸附劑的吸附效果優良,但生產成本高、合成工藝復雜,不適于工業生產。低CO2濃度下的動力學限制被認為是Li4SiO4吸附劑面臨的主要挑戰。為提高吸附材料在低CO2濃度下的吸附性能和循環穩定性,可通過堿性碳酸鹽負載和惰性元素摻雜等方式,還可利用部分天然礦石及廢棄物中存在的雜質組分制備具有高活性的Li4SiO4吸附劑。此外,吸附劑成型及適配工藝開發也備受關注,表明Li4SiO4基吸附劑已從基礎研究向工程應用過渡。
但對于工業化應用,目前還需重點解決以下問題:
1)研究人員通過各種方法制備了不同形貌的Li4SiO4吸附劑,但目前尚無可直接使用的吸附劑材料,因此開發高活性和高循環穩定性的Li4SiO4吸附劑是首要問題。此外,Li4SiO4吸附劑的生產成本也需考慮,雖然已有研究證明使用廉價礦石或工業廢料成功合成Li4SiO4吸附劑可有效降低其生產成本,同時原料中的雜質組分還能提高Li4SiO4吸附活性和循環穩定性,但目前Li源的低成本替代方案極少,尋找廉價的Li源或替代元素是堿金屬硅酸鹽材料研究的重點方向之一。
2)目前成型Li4SiO4顆粒生產已有大量研究報道,為保證顆粒材料的機械強度,造粒過程中對材料進行壓實,不僅破壞了材料的孔道結構,也減小了材料比表面積,導致成型Li4SiO4的CO2吸附性能劣于粉末材料。通過尋找高效的成孔劑、黏合劑以及開發新型造粒技術,制備兼具高吸附活性和機械強度的成型Li4SiO4顆粒也是急需解決的關鍵問題。
3)為推進CCUS技術,服務我國“雙碳”重大戰略目標,將開發的吸附材料應用于工業CO2捕集場景是該領域的重點課題。對于Li4SiO4基吸附材料,設計合適的反應器(流化床、移動床等)和吸脫附工藝、降低材料的吸脫附能耗等還有待進一步優化。
4)對于捕集后CO2的處理處置也是CCUS技術成功的關鍵,目前大規模CO2利用與封存僅限于CO2驅油或地質儲存等,但在全球近300億t/a CO2排放現狀下,對多路徑CO2利用技術需求迫切。目前已有大量工作關注CO2熱催化[119]、電催化[120-122]、光催化[123-124]及協同催化[125],制備高附加值燃料或化工原料。但我國CO2轉化技術起步較晚,高效CO2還原及規模化CO2轉化技術有待進一步開發。

