植物MYB轉錄因子調控次生代謝及逆境響應的研究進展
位欣欣 蘭海燕
(新疆大學生命科學與技術學院 新疆生物資源基因工程重點實驗室,烏魯木齊 830017)
轉錄因子又稱反式作用因子,可與基因啟動子區相關順式作用元件特異結合,激活基因的表達。目前已經報道了多種植物相關轉錄因子,如MYB、bHLH、AP2/ERF、WRKY、NAC等[1],其 中MYB轉錄因子家族是分布最廣、功能最強的一類。MYB轉錄因子由N端保守的MYB域得名,由于進化上的保守性使其幾乎存在于所有真核生物中。v-Myb是在禽類成髓細胞病毒(avian myeloblastosis virus,AMV)中發現的第一個MYB 轉錄因子,Kranz等[2]在玉米(Zea mays)中克隆了首個植物MYB基因,隨后,在真菌和動植物中又發現了眾多的MYB轉錄因子。植物中的MYB轉錄因子的結構和功能更為保守,在調節植物的生長發育、初級和次級代謝以及生物和非生物脅迫響應中發揮著重要作用[1]。本文基于前人的研究成果,總結并討論了植物MYB轉錄因子的結構、相關生物學功能以及參與植物激素應答調控機制等方面的研究進展,以期為相關研究提供借鑒。
1 植物MYB轉錄因子的結構與分類
MYB 轉錄因子的共同特征是具有保守的MYBDNA結合域,該結構域由1-4個不完整的重復片段(R)組成,每個重復序列編碼3個α-螺旋,包含大約50-53個氨基酸殘基。在這3個螺旋中,第二和第三個螺旋形成螺旋-轉角-螺旋(helix-turn-helix,HTH)結構。MYB轉錄因子可以通過HTH結構插入到靶DNA的大溝中進行結合,從而調控靶基因的表達。通常每個MYB重復結構域包含3個保守的色氨酸殘基,這些殘基被18-19個氨基酸隔開形成二級結構[3]。
根據結合結構域所包含的R結構的數目,MYB家族被分為4個亞類:1R-MYB家族、R2R3-MYB家族、3R-MYB家族和4R-MYB家族(圖1)[3]。其中,1R-MYB家族包含一個MYB結構域,在調控植物轉錄和維持染色體結構中起重要作用[4];R2R3-MYB家族基因在MYB結合結構域中包含兩個保守的R2和R3重復序列,同時在C末端可變區內包含一個調控結構域(激活或抑制功能)。其成員眾多,功能多樣,廣泛參與細胞分化、次生代謝[5]、環境脅迫以及病蟲害的侵襲[6];3R-MYB家族基因保守結構域由R1、R2和R3組成,多參與細胞分化及細胞周期的調控;4R-MYB亞家族基因的保守結構域由4個R1/R2重復序列組成,目前在植物中發現的該亞家族基因數目還很少。
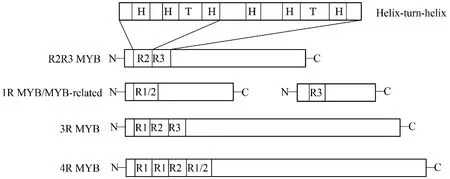
圖1 植物MYB轉錄因子的分類Fig.1 Classification of plant MYB transcription factors
2 MYB參與植物次生代謝調控
2.1 在黃酮生物合成中的作用
黃酮類化合物主要包括花青素、異黃酮、黃酮醇等,這些化合物能夠幫助植物抵御非生物和生物脅迫,MYB則通過激活黃酮類代謝合成途徑中的多個基因,參與此類化合物的生物合成。已知花青素生物合成受MYB-bHLH-WD(MBW)三元復合物的轉錄調控,目前已在植物中鑒定出多種與花青素合成相關的MYB蛋白,如楊梅(Myrica rubra)MrMYB1與MrWD40-1和MrbHLH1相 互 作 用,形成MBW復合體調節楊梅中花青素的積累[5]。美洲黑楊(Populusdeltoides)PdMYB118可與bHLH轉錄因子PdTT8相互作用,從而調節創傷誘導的花青素的積累[7]。類似的還有茄子(Solanum melongena)SmMYB75[8]、紅 梨(Pyrus pyrifolia)PyMYB10和PyMYB114[9]等。除了正調控外,楊樹(Populus)中PtrMYB57可 與bHLH131和PtrTTG1相 互 作 用負調控花青素的生物合成[10],行使類似功能的還有 葡 萄(Vitis vinifera)中 的VvMYBC2L2[11]、菊花(Chrysanthemum morifolium)中的CmMYB #7和CmMYB6等[12]。除了廣泛參與花青素的生物合成,MYB在其他黃酮類化合物的合成中也發揮重要作用。如杜梨(Pyrus betulifolia)PbMYB12b[13]、蘋果(Malus domestica)MdMYB22[14]等可正向調控黃酮醇的生物合成。大豆(Glycine max)GmMYB176通過激活大豆查爾酮合成酶基因的表達調控異黃酮類生物合成[15]。
2.2 在木質素生物合成中的作用
木質素是維管植物次生細胞壁的重要組成成分,木質素賦予植物細胞壁機械強力,增加莖的硬度和強度,從而抵御外界環境造成的傷害。MYB轉錄因子廣泛參與木質素的次生代謝調控,如擬南芥AtMYB20、AtMYB42和AtMYB43可激活木質素合成相關基因并介導次生壁形成,沉默該基因使擬南芥木質素合成大量減少并導致植株生長發育缺陷[16]。其他物種MYB轉錄因子參與木質素生物合成也得到證實,如玉米ZmMYB167[17]、毛白楊(Populus tomentosa)PtoMYB216[18]等。此外,MYB轉錄因子也可抑制木質素的生物合成,菊花CmMYB8可導致轉基因植物中木質素含量降低并改變木質素的組成[19]。柳橙(Citrus sinensis)中的CsMYB330和CsMYB308具有相反的調控作用,前者可激活木質化過程,后者則抑制木質化過程[20]。桉(Eucalyptus)EgMYB1可與組蛋白變體EgH1.3發生特異性相互作用,強烈抑制木質素在木質部細胞壁的沉積,從而防止次生壁過早或不適當的木質化[21]。此外,香蕉(Musa nana)MusaMYB31[22]也能抑制木質素合成。
2.3 參與合成其他次生代謝產物
除了參與黃酮類、木質素等的合成,MYB轉錄因子還參與其他次生代謝產物的合成調控。番茄(Solanum lycopersicum)表皮毛狀體調節因子Woolly和SlMYB31通過調控SlCER6的表達,協同作用于番茄角質層蠟質的生物合成[23]。麻瘋樹(Jatropha carcas)JcMYB1通過調控脂肪酸(fatty acid,FA)和甘油三酯(triglyceride,TG)生物合成基因的表達,參與種子油脂的合成,并改變FA的組成[24]。研究發現,辣椒(Capsicum annuum)中的CaMYB31可能是辣椒素類合成基因的主調控因子[25]。丹參(Salvia miltiorrhiza)SmMYB98可能調控丹參毛狀根中丹參酮和丹酚酸的生物合成[26]。表1總結了MYB轉錄因子在不同植物次生代謝過程中的主要調控作用。
3 MYB參與植物非生物和生物脅迫響應
鹽、干旱、高低溫、病蟲害等因素嚴重影響植物的生長和發育,植物則進化出一系列內在分子機制響應各種環境脅迫,其中MYB轉錄因子在應對生物和非生物脅迫中起到積極的作用。
3.1 鹽脅迫響應
MYB轉錄因子通過提高植物的抗氧化能力應對鹽脅迫。擬南芥AtMYB49通過上調過氧化物酶和胚胎晚期豐富蛋白基因,提高植株抗氧化能力;其突變體atmyb49則表現較高的電解質滲漏率和較低的耐鹽性。同時,AtMYB49還可直接與AtMYB41、ASFT、FACT、CYP86B1等角質、木質和蠟質生物合成相關基因的啟動子結合并激活其表達,促進角質層的形成[28]。水稻OsMYB6通過提高脯氨酸(proline,Pro)含量及各種抗氧化酶(peroxidase,POD;catalase,CAT;superoxide dismutase,SOD)的活性耐受鹽脅迫[29]。玉米ZmMYB3R還能調節氣孔開度賦予玉米耐鹽性[30]。
MYB轉錄因子還可調節下游基因表達增強植株耐鹽性。植物中SOS2(salt overly sensitive 2)編碼絲氨酸/蘇氨酸蛋白激酶,通過磷酸化激活Na+/H+反向轉運體SOS1,促進Na+外流,增強植物的耐鹽性。AtMYB42可調節SOS2的表達正調控耐鹽性,與野生型相比,AtMYB42過表達株系耐鹽性增強,而atmyb42突變體則表現鹽敏感[31]。AtMYB30通過調節線粒體選擇性氧化酶AOX1a(alternative oxidase 1a)基因的表達調節植物耐鹽性,鹽脅迫下,AtMYB30可結合在AOX1a的啟動子上促進該基因表達,維持細胞氧化還原穩態,從而賦予植株耐鹽性[32]。AtMYB12除了促進類黃酮合成和清除活性氧(reactive oxygen species,ROS)外,還可上調脫落酸(abscisic acid,ABA)和脯氨酸合成相關基因的表達[33]。在擬南芥中過表達野草莓(Fragaria vesca)FvMYB24基因能夠上調鹽脅迫相關基因SOS1、SOS2、SOS3、NHX1、LEA3等的表達,從而提高轉基因擬南芥的耐鹽性[34]。將獼猴桃(Actinidia chinensis)AcMYB3R基因在擬南芥中過表達,可顯著上調RD29A、RD29B、COR15A、RD22等應激反應基因的表達,使轉基因植株的耐鹽性顯著增強[35]。
MYB蛋白的修飾在鹽脅迫響應中起重要作用。AtMYB74在鹽脅迫下的表達受RdDM(RNA-directed DNA methylation)通 路 控 制,24-nt siRNA靶 向AtMYB74轉錄起始位點上游約500 bp的區域,使其高度甲基化,使得過表達AtMYB74的轉基因種子萌發表現出超敏反應[36]。此外,鹽脅迫可以改變水稻OsMYB91啟動子區的甲基化,從而誘導OsMYB91在鹽脅迫條件下的高水平表達[37]。蒺藜苜蓿MtMYBS1在鹽脅迫下高表達,由此導致其啟動子及基因的3'末端的DNA甲基化水平降低,而啟動子區及翻譯起始位點附近組蛋白的H3K9ac修飾水平升高,從而增強耐鹽性[38]。
3.2 干旱脅迫響應
MYB作為植物生物合成代謝中最重要的轉錄因子家族之一,可通過調節黃酮類及花青素等化合物的合成參與植物耐旱性。擬南芥MYB12和MYB75可促進黃酮醇和花青素積累及相關基因(CHS[chalcone synthase]、FLS[flavonol synthase]、DFR[dihydroflavonol reductase]、LDOX/ANS[leucoanthocyanidin dioxygenase/anthocyanidin synthase])的表達,從而增強植株對干旱的耐受性[33,39-40]。過表達大豆GmMYB12可增加下游類黃酮的產生和黃酮生物合成途徑相關基因的表達,從而提高種子萌發、根系發育和生長過程中對干旱脅迫的抗性[27]。
角質層是植物葉表面重要的結構層,也是氣孔的組成部分。角質層包括角質和蠟質,其生物合成受到MYB轉錄因子的廣泛調控。在擬南芥中,AtMYB30、AtMYB94和AtMYB96是蠟質合成基因的正調控因子。AtMYB96的過表達可促進表皮蠟質合成,從而增強擬南芥的抗旱性;而atmyb94和atmyb96雙突變體的角質層失水速率加快,由此表明AtMYB94與AtMYB96在角質層形成過程中具有協同作用[41]。研究發現,與AtMYB96同源的小麥TaMYB31也可通過上調蠟質生物合成基因和干旱響應基因的表達發揮耐旱作用[42]。另一方面,AtMYB41可負調控角質層合成基因ATT1和LACS2的表達,其過表達導致植株矮化、細胞變小、葉片表面滲透性增強等,對干旱脅迫表現超敏性[43]。
氣孔孔徑的調節是植物控制水分流失的重要方式。AtMYB60是第一個被發現參與氣孔運動調控的轉錄因子,其在保衛細胞中特異表達并受白光和藍光誘導促進氣孔開啟;黑暗、干燥、ABA等信號則抑制其表達,導致氣孔關閉。在atmyb60突變體中,光誘導的氣孔開放受到抑制,從而增強植物的抗旱性;而AtMYB60過表達則使擬南芥植株對干旱表現超敏反應[44]。AtMYB44在保衛細胞中高表達,然而它對干旱的響應存在相反的論點。Jung等[45]的研究表明,AtMYB44過表達增強了種子萌發和氣孔關閉過程中對ABA的敏感性,從而提高了植株的耐旱性。Jaradat等[46]則認為AtMYB44能夠與ABA受體RCARs/PYR1/PYLs特異結合從而負調控ABA信號。AtMYB96主要表達于葉片的保衛細胞,其過表達能夠提高氣孔對ABA和干旱的敏感性[47]。棉花GaMYB85則通過降低葉片的氣孔密度和氣孔開度,使ABA誘導下氣孔迅速關閉,從而降低失水率,提高植株耐旱性[48]。
3.3 極端溫度脅迫響應
MYB轉錄因子參與植物低溫響應的機制目前存在兩種假說,依賴CBF/DREB(C-repeat binding transcription factor/dehydrate responsive element binding factor)轉 錄 因 子 的ICE1(inducer of CBF expression)-CBFs機制和不依賴CBF的機制。研究發現,AtMYB96可被冷脅迫誘導,并通過HHP1/2/3(heptahelical protein)蛋白激活ICE1的轉錄活性,從而誘導下游CBF因子的表達,增強植物抗凍性[49]。而AtMYB15在翻譯后受MPK6的修飾,使其Ser-168位點發生磷酸化,從而降低MYB15與CBF3啟動子的親和力,最終抑制CBF基因的表達[50]。此外,受冷脅迫誘導的蘋果MdMYB23轉錄因子直接與MdCBF1/2的啟動子結合并激活其表達,通過CBFs低溫調控途徑賦予轉基因植物抗寒性[51]。大部分MYB轉錄因子可能通過CBFs非依賴途徑調控植物耐寒性,如AtMYBC1過表達植株對低溫脅迫敏感,而atmybc1突變體和AtMYBC1過表達植株中CBF途徑中的CBF/DREB低溫脅迫響應關鍵基因表達無明顯區別;而CBF過表達植株中AtMYBC1的轉錄水平也無明顯差異,由此表明,AtMYBC1通過不依賴CBF途徑的方式負調控擬南芥的低溫耐受性[52]。
MYB 轉錄因子也參與植物的高溫脅迫響應。在擬南芥中,AtMYB30通過Annexin介導的胞質鈣信號調控氧化和熱脅迫應答[53]。百合(Lilium longiflorum)LlMYB305在熱脅迫下激活LlHSC70啟動子活性參與植株耐熱性[54]。番茄MYB轉錄因子SlLeAN2可調控花青素合成,并通過調節光合作用和提高POD、SOD、CAT的活性增強耐熱性[55]。過表達水稻OsMYB55可增強轉基因水稻的氨基酸代謝,從而提高植株的耐熱性并降低高溫對籽粒產量的影響[56]。
3.4 其他非生物脅迫響應
MYB轉錄因子在應對低磷脅迫中具有重要作用。大豆GmMYB48可與GmSPX1相互作用增強轉基因植株對低磷脅迫耐受性[57]。過表達小麥MYB轉錄因子TaPHR3-A1可增強轉基因植物對低磷耐性,并可調節小麥產量相關性狀[58]。此外,水稻MYB轉錄因子OsARM1受砷離子的誘導并與砷轉運蛋白相結合調節水稻對砷的吸收[59]。MYB還參與金屬離子脅迫響應。擬南芥AtMYB4通過增強抗氧化能力、提高植物螯合素合成酶1(phytochelatin synthase,PCS1)和金屬硫蛋白1C(metallothionein,MT1C)的表達來調節鎘耐受性[60]。在矮牽牛中過表達蘿卜(Raphanus sativus)RsMYB1基因,能促進重金屬解毒相關基因的表達,如谷胱甘肽巰基轉移酶基因GST(glutathione S-transferase)、絡合素酶基因PCS(phytochelatin synthase)以及SOD、CAT等,從而賦予轉基因植物對鋅、銅、鎘等重金屬離子的耐受性[61]。鹽角草(Salicornia brachiata)SbMYB15通過限制轉基因植物對金屬離子的攝取并調節抗氧化防御系統,從而緩解鎘、鎳離子對轉基因煙草的脅迫作用[62]。
3.5 參與植物生物脅迫響應
自然界中的生物脅迫可大致分為真菌、細菌及植食性昆蟲的侵害,MYB轉錄因子在應對真菌和細菌侵染方面具有一定的作用。蘋果MdMYB30通過調節蠟質的生物合成增強了轉基因擬南芥對假單胞桿 菌(Pseudomonas syringae pv tomatoDC3000)的抗性,并提高轉基因蘋果愈傷組織對蘋果炭疽病菌(Glomerella cingulata(Stonem.)Spauld. et Schrenk)的抗性[63]。MdMYB73則通過水楊酸(salicylic acid,SA)途徑提高蘋果對真菌性葡萄孢菌(Botryosphaeria dothidea)的抗性[64]。辣椒感染青枯病菌(Ralstonia solanacerum)后可使MYB轉錄因子CaPHL8上調表達,通過激活免疫相關基因的表達增強辣椒的防御反應[65]。野生葡萄中VdMYB1可激活類黃酮代謝關鍵調控因子二苯乙烯合成酶(stilbene synthase,STS)基因的表達,從而增加白藜蘆醇的含量并提高葡萄葉片對白粉病菌的抗性[66]。芥菜(Brassicajuncea)BjMYB1可通過與幾丁質酶基因BjCHI1啟動子上的W-box-like元件結合,從而提高轉基因擬南芥對灰霉病菌的抗性[67]。
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)是植物防御植食性昆蟲的關鍵酶,水稻OsMYB30可上調OsPAL6和OsPAL8的表達,導致轉基因水稻中SA和木質素的生物合成增加,從而提高轉基因水稻對褐飛虱(Nilaparvata lugens(Stdl))的防御[68]。過表達野生大豆(Glycine soja)GsMYB15的轉基因擬南芥葉片飼喂棉鈴蟲可顯著抑制其幼蟲免疫相關基因的表達水平[6]。表2總結了MYB轉錄因子在植物脅迫響應中的作用。
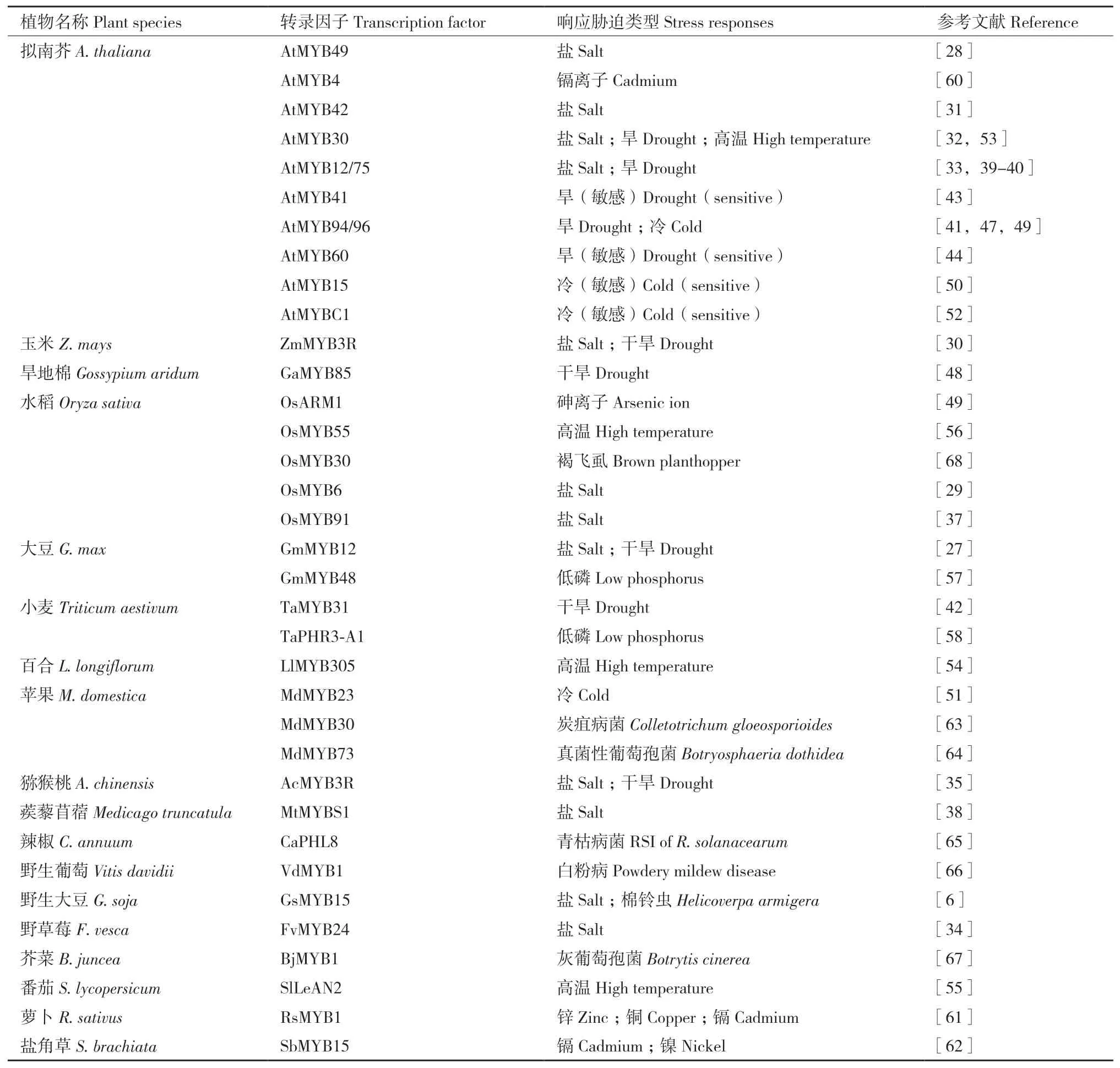
表2 MYB轉錄因子在植物脅迫響應中的作用Table 2 Roles of MYB transcription factors(TFs)in plant stress responses
4 MYB轉錄因子參與植物激素應答調控機制
MYB轉錄因子參與多種生物學過程的調節,雖然信號通路錯綜復雜,但通常與各種植物激素相關。以模式植物擬南芥為例(圖2)[69-78],MYB96不僅可以通過CBFs途徑參與低溫響應,也可通過ABA信號通路調控耐旱性。在高濃度ABA條件下,MYB96可通過調節組蛋白脫乙酰酶HDA15(histone deacetylase)促進組蛋白H3和H4去乙酰化并抑制GTP結合蛋白ROPs(Rho-related GTPases of plants)的表達,從而在ABA途徑中起負調控作用,包括ABA介導的氣孔關閉和干旱響應[69]。在MYB96受MIEL1(RING-type E3 ligase)泛素化介導的降解途徑中,ABA通常會抑制MIEL1的表達,從而促進MYB96的積累,使MYB96在種子萌發期通過促進初級種子休眠的正調節因子ABI4(ABA insensitive 4)的表達,抑制種子萌發[70]。此外,MYB96還可通過RD22(responsive to dehydration 22)介導的ABA信號誘導生長素結合酶GH3的表達,從而將ABA信號途徑與其他激素調節通路聯系起來,共同調控干旱條件下側根的發育以及維持生長素的穩態[71]。不僅如此,MYB96還可將ABA介導的非生物脅迫信號與水楊酸誘導的病原體抗性反應相聯系,其過表達能夠促進SA合成基因SID2(salicylic acid induction deficient 2)的上調表達,導致內源游離態SA和SAG(SA-β-glucoside)濃度升高,從而提高植株抗病能力[72]。
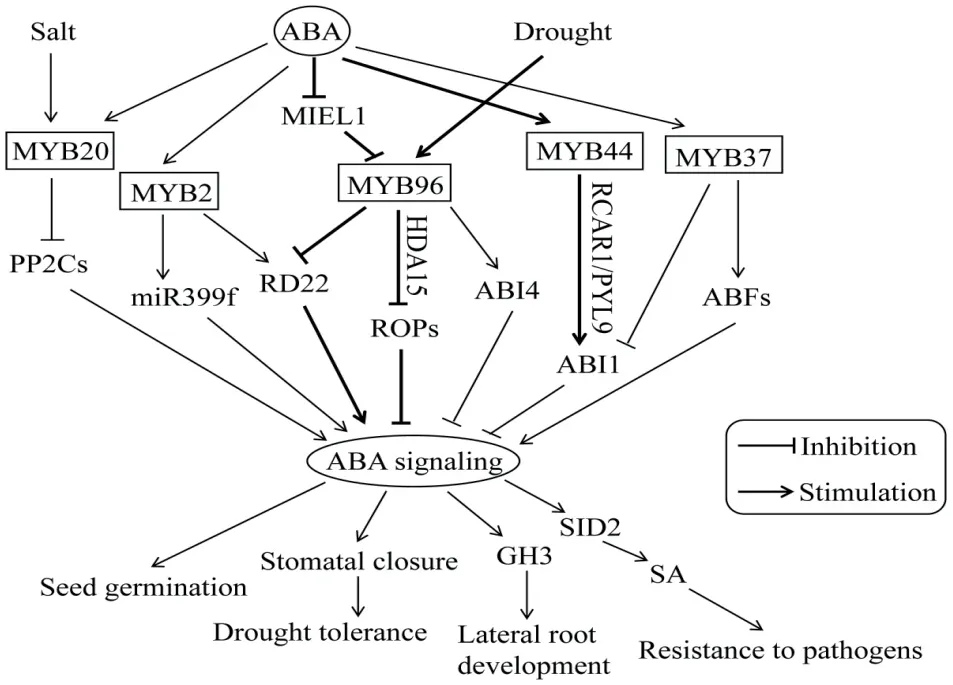
圖2 擬南芥MYB轉錄因子參與ABA介導信號模式圖Fig. 2 Schematic diagram of ABA-mediated signaling in which MYB transcription factors are involved in Arabidopsis
除參與ABA介導的氣孔關閉外,MYB轉錄因子還參與ABA調控的其他信號通路。如MYB33和MYB101已被鑒定為種子萌發過程中ABA信號的正調控因子[73],MYB7則通過抑制ABI5(ABA insensitive 5)的表達作為種子萌發過程中ABA信號的負調控因子起作用[74]。此外,MYB2受干旱和ABA的誘導,通過結合RD22的啟動子正向調控該基因的表達,從而導致種子萌發對ABA敏感性增加;MYB2還可直接結合在miR399f(microRNA399 precursor gene)上的MYB結合元件驅動該基因的表達,從而降低種子萌發和根系生長對ABA的敏感性[75]。過表達MYB37可上調ABF2/3、DREB2A和MYC2等ABA應答與耐受相關基因的表達,從而在耐受細胞脫水過程中發揮作用[76]。
MYB蛋白也通過ABA信號途徑調控植物耐鹽性。蛋白磷酸酶家族PP2C(protein phosphatase 2C,PP2Cs)作為ABA信號轉導途徑中的負調控因子,其主要成員有ABI1、ABI2、HAB1、AHG3和PP2CA。當MYB20受NaCl誘導表達時,可與ABI1和PP2CA的啟動子核心元件ACGT結合,抑制二者的表達,最終提高植物耐鹽性[77]。MYB44也通過調控PP2Cs參與耐鹽反應,在過表達MYB44的轉基因植株中,鹽脅迫下PP2Cs表達降低,而myb44突變體株系的PP2Cs表達增強,導致鹽脅迫耐受性降低[78]。
MYB轉錄因子對植物生長發育的調控機制與植物激素密切相關(圖3)[79-84]。Song等[79]提出模型闡明茉莉酸(jasmonic acid,JA)調控擬南芥雄性育性的分子機制。當JA水平升高時,COI1(coronatine insensitive 1)與JAZs(jasmonate-ZIM domain containing protein,JAZ)蛋白之間相互作用形成復合體,使JAZs在26S蛋白酶體中被泛素化降解,釋放出被JAZs抑制的MYB21和MYB24,隨后二者與bHLH轉錄因子MYC形成 MYB-MYC 復合物,激活調控雄蕊發育所需的相關基因的表達;而在coi1突變體中,MYB21和MYB24的N端與JAZs蛋白相互作用,從而抑制雄蕊發育早期基因的表達。研究發現,赤霉素(gibberellin,GA)對擬南芥雄蕊發育的調控作用位于JA信號通路的上游,GA通過26S蛋白酶體途徑觸發DELLA蛋白降解,從而解除DELLA蛋白對JA生物合成基因DAD1和LOX1的抑制,隨后促進JA的合成并解除被JAZs抑制的MYB21、MYB24和MYB57蛋白,進而促進雄蕊花絲的發育[80]。MYB轉錄因子除參與JA和GA途徑調控雄蕊發育之外,還參與生長素途徑(auxin)調控花藥開裂。生長素應答因子ARF17(auxin response factor 17)可 驅動MYB108和NST1(NAC secondary wall thickening promoting factor 1)的表達促進花藥內壁木質化和開裂[81]。此外,MYB26、ARF8.4(auxin response factor 8.4)和NST1/NST2構成的基因通路也調控花藥內壁的木質化并促進花藥開裂[82]。
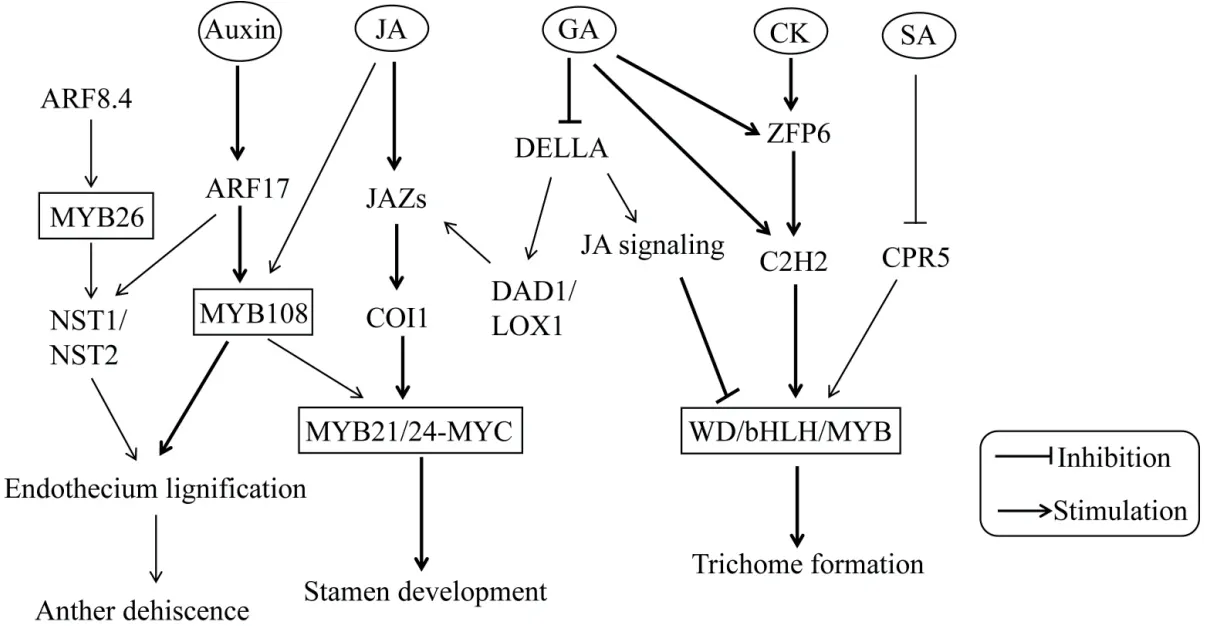
圖3 MYB轉錄因子參與植物激素調控生長發育網絡圖Fig. 3 MYB transcription factors involved in plant hormone regulation of growth and development network
在表皮毛發育過程中,GA、JA和細胞分裂素CK(cytokinin)均具有促進作用,而SA則抑制表皮毛生長。與調控雄蕊發育過程類似,GA和JA信號分別誘導DELLAs和JAZs降解,從而解除對WD/bHLH/MYB(MBW)復合物的抑制,兩條激素調控通路協同作用并相互依賴地調節擬南芥毛狀體發育[83]。此外,CK通過鋅指蛋白ZFP6(zinc finger protein 6)調節MBW復合體,SA則通過細胞周期調節因子CPR5(cell progression regulator 5)調控MBW復合體,進而影響毛狀體的形成[84]。目前植物激素與MYB轉錄因子相互作用調控細胞生長發育的研究已較為深入,但詳細調控網絡還需進一步構建。
5 展望
MYB轉錄因子廣泛存在于植物中,并積極參與植物生長發育調控及脅迫響應。MYB家族內部成員在結構和功能上具有一定的相關性,可通過分析其蛋白結構和表達模式來預測未知MYB轉錄因子的生物學功能。迄今為止,對MYB的研究多集中于單一因子的孤立作用,對其在不同信號通路中與其他因子的相互作用機制尚待深入探索;與此同時,不同MYB轉錄因子存在功能冗余,利用傳統的分子生物學方法難以揭示其作用機制。隨著CRISPR/Cas9等技術的發展,MYB轉錄因子調控網絡的研究將成為熱點,這對進一步揭示MYB響應多種逆境脅迫的作用機制并應用于生產實踐具有重要意義。