霍亂弧菌溶血素HlyA的原核表達、純化及多克隆抗體制備與鑒定
王光麗 范嬋 王輝 盧惠芳 夏靈尹 黃健 閔迅
(1.遵義醫科大學附屬醫院醫學檢驗科,遵義 563003;2.遵義醫科大學檢驗醫學院,遵義 563003)
非O1/非O139群霍亂弧菌是指除O1群和O139群霍亂弧菌以外的其他霍亂弧菌的總稱,可引起局部范圍內的或零星的霍亂樣腹瀉疾病,常表現為輕度和短暫的胃腸道感染[1]。此外,非O1/非O139群霍亂弧菌還可引起腸道外感染,表現為敗血癥[2-4]、皮膚和軟組織感染[5]、腦膜炎[6]、細菌性肺氣腫[7]、甚至致人死亡[8-9]。本課題組前期也從兩例膿毒血癥患者中分離到兩株非O1/非O139群霍亂弧菌,其中一例導致患者死亡[10]。近年來關于非O1/非O139群霍亂弧菌感染的病例報道越來越多[11],但人們對其致病機制知之甚少。因此,對非O1/非O139群霍亂弧菌生物學特性及致病性的研究具有重要價值。
霍亂弧菌溶血素(hemolysin,HlyA)是一種細胞外成孔毒素[12-13],主要由霍亂弧菌El Tor生物型和大多數非O1/非O139群菌株分泌[14-16]。HlyA可在靶細胞膜上形成跨膜寡聚β-桶狀孔導致細胞膜通透性增加[12-13]。霍亂弧菌HlyA對包括Caco-2細胞(人結直腸腺癌細胞)在內的多種細胞系具有空泡化[17]和殺細胞活性[17-18]。HlyA還能誘導Caco-2細胞凋亡[1,19]。純化的HlyA能夠在兔結扎腸環模型、幼兔模型和乳鼠模型中誘導大量的腸液積聚[20-22]。與CT毒素誘導的水樣腹瀉不同,HlyA誘導的腹瀉呈血性黏液樣[23]。此外,在自然水生棲息環境中,非O1/非O139群霍亂弧菌通過分泌HlyA抑制或殺死異源細菌,獲得局部生態環境的競爭優勢[2]。因其強大的細胞殺傷活性,HlyA被認為在霍亂弧菌致病過程中起著關鍵作用,特別是在缺乏霍亂CT毒素的菌株中。在非O1/非O139群霍亂弧菌中HlyA的調控和致病機制目前還知之甚少。本研究擬通過原核表達系統表達純化HlyA蛋白,并制備其多克隆抗體,為后續研究HlyA致病與調控機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌株及質粒 非O1/非O139群霍亂弧菌HN375(中國典型培養物保藏中心CCTCCAB2010-414)、大腸桿菌(Escherichia coli)DH5a 和 BL21(DE3)菌株及pET28a、pET32a、pCold TF質粒為本課題組保存。
1.1.2 實驗動物 BALB /c小鼠(SPF級,6-8周,雌性)購自國家齲齒類動物實驗中心。
1.1.3 主要試劑 蛋白質Maker、DL2000 DNA Maker、DL5000 DNA Maker、T4 DNA 連 接 酶、Primer Star高保真DNA聚合酶、限制性內切酶、DNA純化試劑盒購自TaKaRa公司;質粒抽提試劑盒、瓊脂糖凝膠回收試劑盒、細菌基因組DNA提取試劑盒購自北京天根公司;辣根過氧化物酶(HRP)標記的山羊抗鼠抗體購自Proteintech公司;Ni-NTA親和層析柱購自美國GE Healthcare 公司;Omni-ECLTM基礎型化學發光檢測試劑盒購自雅酶公司;異丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、氨芐青霉素、LB培養基等其他生化試劑購于生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 引物設計 根據標準菌株HN375中hlyA基因序列,為了構建pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA原核表達載體,分別設計了下列引物:pET28a-hlyA:上游引物F:5'-TTCCATATGTTAGTTC AAATCAAATTGAACCCCTTT-3',下游引物R:5'-CG GGATCCATGCCAAAACTCAATCGTTGC-3',下劃線部分分別為Nde I和BamH I酶切位點。pET32a-hlyA:上游引物F:5'-GCGGCCGCTTAGTTCAAATCAAAT TGAACCCCTTT-3',下游引物R:5'-CGGGATCCAT GCCAAAACTCAATCGTTGC-3',下劃線部分分別為Not I和BamH I酶切位點。pCold TF-hlyA上游引物F:5'-TTCCATATGTTAGTTCAAATCAAATTGAACCC CTTT-3',下游引物R:5'-CGGAATTCATGCCAAAAC TCAATCGTTGC-3',分別為Nde I和EcoR I酶切位點,引物由上海生工生物工程技術服務有限公司合成。
1.2.2 PCR擴增及切膠回收目的基因 以霍亂弧菌標準菌株HN375 DNA為模板進行PCR擴增hlyA基因。PCR 反應體系為 50 μL :ddH2O 31.5 μL、5×PSBuffer 10 μL、dNTP Mixture 4 μL、DNA模板2 μL、上游、下游引物各1 μL、Prime Star酶0.5 μL。PCR擴增條件為:98℃變性20 s,55℃退火15 s,72℃延伸2 min 30 s,30個循環,72℃延伸5 min。用1%瓊脂糖凝膠對PCR產物進行電泳鑒定,再用瓊脂糖凝膠DNA回收試劑盒進行純化回收目的基因。
1.2.3 pET28a-hlyA、pET32a-hlyA和 pCold TF-hlyA重組質粒的構建 分別用相應的限制性內切酶對hlyA基因及pET28a、pET32a、pCold TF質粒進行雙酶切,酶切條件為37℃,4 h。酶切后用1%瓊脂糖凝膠對酶切產物進行電泳鑒定,然后純化回收酶切質粒和目的基因,二者按摩爾比1∶10比例混合后加入T4 DNA連接酶在16℃條件下連接16 h。將連接產物轉化入E.coli DH5a感受態細胞中,在含有相應抗生素的LB平板上涂布接種,培養24 h后挑選陽性克隆菌進行菌液PCR鑒定,陽性克隆增菌后提取重組質粒行雙酶切驗證,并送江蘇塞索飛生物科技有限公司進行測序。
1.2.4 pET28a-hlyA、pET32a-hlyA和 pCold TF-hlyA重組質粒的誘導表達 將構建成功的pET28a-hlyA、pET32a-hlyA和 pCold TF-hlyA重組質粒分別轉入E.coli BL21(DE3)表達菌中,分別涂布于含相應抗生素的LB平板上,培養24 h后篩選陽性菌落行菌液PCR鑒定。吸取陽性克隆菌液按1∶50比例轉接于相應抗生素的LB培養液中,37℃,180 r/min恒溫搖床中培養至OD600吸光度值約為0.6時,在不同的誘導條件下誘導后離心收集菌體,用1×Binding Buffer(300 mmol/L NaCl、10 mmol/L PBS,pH 8.0)重懸然后超聲破菌,行SDS-PAGE電泳分析HlyA蛋白在上清和沉淀中的表達情況。
1.2.5 純化誘導表達在上清的HlyA蛋白 使用Ni-NTA親和層析柱純化破菌后的上清,將上清液與Ni-NTA瓊脂糖珠混合30 min以充分結合,再用含有10、20、30、40 mmol/L 咪唑的 1×Washing Buffer洗雜蛋白,最后使用含有300 mmol/L咪唑的1×Washing Buffer洗脫結合在Ni -NTA柱中的目的蛋白。行SDS-PAGE電泳分析蛋白純度,以超濾杯進行脫NaCl、脫咪唑并濃縮蛋白。行BCA法對濃縮蛋白定量后分裝保存于-80℃備用。
1.2.6 HlyA蛋白溶血活性分析 用生理鹽水將新鮮兔紅細胞配制成2%(V /V)的紅細胞懸液,用PBS溶液將純化的全長HlyA蛋白稀釋至不同濃度(0,4和8 μg/mL)。再將2%兔紅細胞懸液與稀釋的HlyA蛋白溶液等體積混合,以PBS為陰性對照,以1%Trion-X為陽性對照,37℃溫育3 h后低速離心取上清200 μL于96孔板,酶標儀測定541 nm處的光密度值。
1.2.7 多克隆抗體的制備及抗體效價的檢測 將純化HlyA蛋白與等體積Alum佐劑充分混合后,通過皮下多點注射免疫劑量為30 μg /只的BALB /c小鼠,同時設置注射Alum佐劑作陰性對照組。每次免疫間隔兩周,共免疫3次,末次免疫后一周采尾靜脈血分離血清測抗體效價。將HlyA蛋白用抗原包被液(pH 9.6的碳酸鹽緩沖液)稀釋為濃度10 μg/mL,100 μL/孔加至96孔酶標板,4℃過夜包被;以間接ELISA法測定抗體效價,顯色終止后于酶標儀上讀取450 nm下的吸光度值。結果判定標準:以稀釋的待測標本A450/Alum佐劑對照A450≥2.1的最大稀釋倍數判定為該抗體的滴度。
1.2.8 抗HlyA多克隆抗體抑制霍亂弧菌培養基上清溶血活性分析 收集OD600≈0.6時霍亂弧菌培養基上清預先與抗 HlyA抗血清按40∶1比例稀釋,室溫孵育1 h;再以上述抗體中和后的菌液上清:紅細胞懸液按9∶1的比例加入玻璃試管中,以未加抗體的霍亂弧菌培養基上清作為未處理對照,以1%Trion-X為陽性對照,將試管放置于37℃恒溫水浴箱中溫育3 h后,低速離心取上清用酶標儀測定其在波長541 nm的光密度值并計算其溶血率。實驗數據均重復3次以上,使用SPSS統計學軟件進行數據分析,選用未配對的雙尾t檢驗分析兩組之間的差異,以P < 0.05表示差異有統計學意義。
1.2.9 Western blot檢測HlyA蛋白的表達 將霍亂弧菌HN375野生菌株(WT)及其hlyA基因敲除菌株(HN375△hlyA)分別接種于LB液體培養基中,在37℃,180 r/min恒溫搖床中培養至OD600≈0.6時,通過離心分離培養物上清液。如前所述[24],使用三氯乙酸-丙酮沉淀法從2 mL培養物上清液中沉淀出分泌的蛋白質,加1 × SDS -PAGE蛋白上樣緩沖液于沉淀出分泌的蛋白質充分混勻,煮沸15 min,取20 μL樣本行SDS -PAGE電泳,轉膜、封閉后,用1∶1 000稀釋的抗HlyA血清作為一抗,在4℃,80 r/min搖床上孵育過夜;用TBST洗滌3次后,用1∶5 000稀釋的HRP標記羊抗鼠IgG作為二抗,室溫80 r/min搖床上孵育1 h,經TBST洗滌3次后行ECL顯色。取Western blot印跡條帶對應位置的膠條送華大基因進行質譜鑒定分析。
2 結果
2.1 PCR擴增hlyA基因及構建pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA原核表達載體
以霍亂弧菌HN375菌株的DNA為模板行PCR擴增hlyA基因,行1.0%瓊脂糖凝膠電泳分析PCR擴增產物,可見大小與預期分子量相符的目的條帶(圖1-A)。將hlyA基因克隆入pET28a、pET32a和pCold TF載體中,轉化E.coli DH5a后篩選陽性克隆菌落行菌液PCR驗證,結果分別如圖1-B、1-C和1-D所示,均能擴增出與預期大小相符的目的條帶。提取陽性菌落中的重組質粒進行測序,測序結果與GenBank數據庫中hlyA基因序列相符,表明pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA重組質粒構建成功。

圖1 pET28a-hlyA、pET32a-hlyA和pCold TF-hlyA重組質粒的構建Fig.1 Construction of recombinant plasmids pET28ahlyA,pET32 a-hlyA and pCold TF-hlyA.
2.2 pET28a-hlyA和pET32a-hlyA重組質粒中HlyA蛋白的誘導表達
將含pET28a-hlyA和pET32a-hlyA重組質粒的E.coli BL21(DE3)表達菌分別在不同溫度、轉速和IPTG濃度下進行蛋白誘導表達,用SDS-PAGE電泳分析超聲破菌后的沉淀與上清中HlyA蛋白的表達形式。結果如圖2-A和2-B所示,在10℃、15℃和23℃等條件下,pET28a-hlyA- E.coli BL21(DE3)菌株中的HlyA蛋白都以包涵體形式表達,未獲可溶表達形式。同樣,pET32a-hlyA- E.coli BL21(DE3)表達菌分別在15℃、20℃和25℃等條件下誘導,HlyA蛋白也以包涵體形式表達于沉淀中(圖3)。

圖2 pET28a-hlyA在E.coli BL21(DE3)中誘導表達的SDS-PAGE分析Fig.2 SDS-PAGE analysis of pET28a-hlyA expression pro-ducts in E.coli BL21(DE3)induced with IPTG

圖3 pET32a-hlyA在E.coli BL21(DE3)中誘導表達的SDS-PAGE分析Fig.3 SDS-PAGE analysis of pET32a-hlyA expression products in E.coli BL21(DE3)induced with IPTG
2.3 pCold TF-hlyA重組質粒中HlyA蛋白的誘導表達及純化
pCold TF-hlyA-E.coli BL21菌株在15℃、90 r/min、0.05 mmol/L IPTG條件誘導16 h后,在SDS-PAGE電泳圖中可見分子量約為130 kD的目的蛋白表達,即82 kD的HlyA蛋白和48 kD的pCold TF標簽蛋白之和(圖4),超聲破菌后沉淀與上清均有目的蛋白表達,表明在該菌株中可獲得可溶形式的HlyA蛋白,經Ni-NTA柱親和層析純化后,獲較純的HlyA蛋白。

圖4 pCold TF-hlyA在E.coliBL21中誘導表達和HlyA蛋白純化的SDS-PAGE分析Fig.4 SDS-PAGE analysis of pCold TF-hlyA expression products in E.coli BL21 induced with IPTG and the purified HlyA protein
2.4 重組表達的HlyA蛋白的溶血活性分析
將不同濃度的HlyA蛋白與2%的新鮮兔洗滌紅細胞懸液在37℃溫育3 h后,行溶血活性測定。結果顯示4和8 μg/mL的重組HlyA蛋白與兔紅細胞共孵育未見明顯的溶血現象(P>0.05)(圖5),提示重組HlyA蛋白沒有溶血活性。
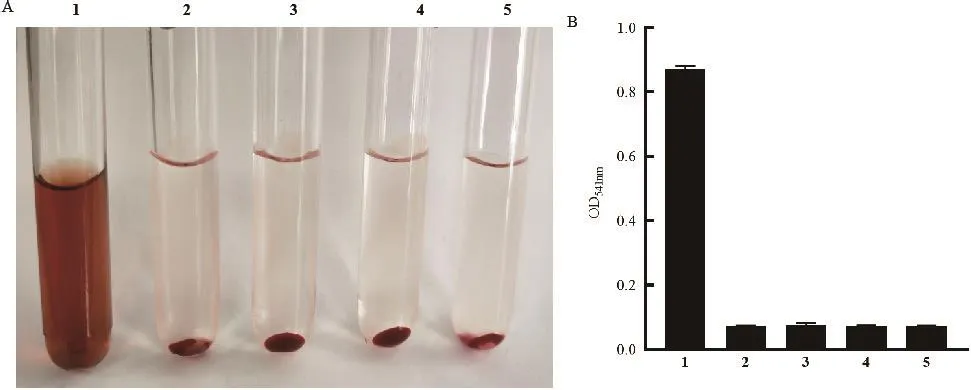
圖5 重組表達的HlyA蛋白溶血活性測定Fig.5 Hemolytic activity determination of recombinant expressive protein HlyA
2.5 間接ELISA法檢測抗HlyA蛋白多克隆抗血清效價
末次免疫一周后取小鼠尾靜脈血行間接ELISA法測抗體效價,結果顯示抗血清效價達到了1∶521 000(圖6)。

圖6 HlyA蛋白免疫前后小鼠血清抗體效價分析Fig.6 Analysis of serum antibody titer in mice before and after immunization with HlyA protein
2.6 抗HlyA多克隆抗體特異性的鑒定
收集霍亂弧菌HN375菌株和HN375△hlyA菌株培養基上清,行Western blot分析,以制備的抗HlyA多克隆抗體作為一抗。結果顯示在霍亂弧菌HN375野生株培養上清中出現了與預期分子量相符的特異性HlyA蛋白印跡條帶,而HN375△hlyA菌株培養上清未見反應條帶(圖7)。為進一步鑒定該條帶為HlyA蛋白,取該位置條帶行質譜鑒定,結果顯示該條帶為霍亂弧菌HN375菌株分泌HlyA蛋白(圖8)。以上結果提示,我們制備的抗HlyA多克隆抗體能特異識別霍亂弧菌中天然表達的HlyA蛋白。

圖7 Western blot分析抗HlyA多克隆抗體的特異性Fig.7 Analysis specificity of anti-HlyA polyclonal antibody by Western blot

圖8 HlyA蛋白的質量圖譜Fig.8 Mass spectrometric profiles of HlyA protein
2.7 抗HlyA多克隆抗體能夠抑制霍亂弧菌培養上清的溶血能力
為了驗證抗HlyA多克隆抗體是否能夠抑制霍亂弧菌HlyA的溶血活性,本研究選擇非O1/非O139霍亂弧菌HN375菌株、HN375△tagH菌株(課題組前期構建的高表達HlyA的菌株)和本課題組前期分離的兩株已鑒定為非O1/非O139霍亂弧菌的臨床菌株進行抗體中和實驗[10]。結果如圖9所示,與未處理血清組和HlyA免疫前血清處理組相比,HlyA免疫后血清處理組明顯抑制HlyA介導的溶血現象(P< 0.001)。

圖9 抗HlyA多克隆抗體中和活性檢測Fig.9 Detection of Anti-HlyA polyclonal antibody neutralization activity
3 討論
HlyA蛋白被認為霍亂弧菌的致病過程中的重要毒力因子,但目前關于HlyA的調控機制和致病作用,尤其是在非O1/非0139群霍亂弧菌中的致病作用尚不完全清楚[1]。為深入研究HlyA的功能,我們擬通過原核表達系統獲取HlyA蛋白并制備高效價的多克隆抗體,為后續研究奠定基礎。目前大多數研究者主要通過快速蛋白液相色譜(FPLC)[1,25]或陰離子交換層析法[26]等方法分離純化霍亂弧菌培養基上清的HlyA蛋白,但這些方法存在操作繁瑣,實驗和技術條件要求高,獲得HlyA蛋白純度不好等缺點。因此,本研究擬建立一種高效、方便的HlyA蛋白原核表達系統,以表達純化可溶形式的HlyA蛋白。
本研究首先嘗試以pET28a載體表達HlyA蛋白,雖經過溫度、IPTG濃度和轉數等條件優化,但是未獲得可溶性表達形式的HlyA蛋白。有文獻報道通過pET32a載體表達出HlyA蛋白,但并未說明其表達形式[22]。本研究也嘗試以pET32a載體表達HlyA蛋白,但是同樣未獲得可溶性表達形式的HlyA。可能是HlyA蛋白在pET28a、pET32a中不能獲得蛋白正確折疊形式,導致了包涵體表達。因此,我們進一步選擇pCold TF載體表達HlyA蛋白,因為該載體帶有可溶性標簽Trigger Factor(TF),TF是原核核糖體相關的分子伴侶蛋白(48 kD),有利于新表達的多肽的共翻譯折疊,且該載體是一種低溫誘導的蛋白表達載體,低溫誘導能增強目的蛋白的穩定性和能促使融合蛋白最大限度地以可溶形式存在,提高目的蛋白質的可溶性[27]。于是本研究嘗試以pCold-TF載體表達HlyA蛋白,并獲得高純度和可溶性表達形式的HlyA蛋白。相比陰離子交換層析法等直接提取法,我們成功構建的以pCold-TF載體HlyA原核表達系統,能高效獲取HlyA蛋白。純化的HlyA蛋白免疫小鼠獲得高效價的多克隆抗體,說明該蛋白具有較好的免疫原性。由于霍亂弧菌溶血素(hemolysin,HlyA)是由hlyA基因首先編碼合成分子量為 82 kD prepro-HlyA前體蛋白,需在胞外經蛋白酶水解修飾后才形成成熟有活性的水溶性穿孔毒素[28-30]。然而在大腸桿菌系統可能缺少特定的蛋白酶水解修飾HlyA蛋白為成熟有活性的蛋白,因此,溶血活性實驗顯示原核表達的HlyA蛋白不能夠裂解兔紅細胞。由于本研究主要目的是制備HlyA多克隆抗體,無活性HlyA蛋白對免疫原性影響不大,抗體效價結果顯示,原核表達的HlyA免疫原性較好,能獲得高抗體效價的多克隆抗體。進一步的Western blot分析顯示,制備的HlyA多克隆抗體能特異識別霍亂弧菌中天然表達的HlyA蛋白,質譜分析也驗證了印跡條帶的特異性,表明所制備的多克隆抗體具有識別天然HlyA蛋白的特異性。而抗體溶血抑制實驗表明制備的HlyA多克隆抗體具備抑制霍亂弧菌HlyA蛋白溶血能力的生物學活性,提示該抗體在以后對抗霍亂弧菌致病過程中有可能作為HlyA中和抗體的潛力。
4 結論
本研究成功表達并純化出可溶性的霍亂弧菌HlyA蛋白,免疫小鼠后獲得高效價的抗HlyA多克隆抗體。該抗體能特異性識別霍亂弧菌天然表達HlyA蛋白,并能有效抑制霍亂弧菌的溶血活性。
(責任編輯 張婷婷)

