乳腺癌肝轉移的臨床病理特征及影響因素
李鵬,周麗麗
1.淄博市婦幼保健院外科,山東淄博 255000;2.桓臺縣中醫院兒科,山東淄博 256400
乳腺癌是目前嚴重威脅我國女性生命健康的惡性腫瘤,其為導致女性死亡的最常見惡性腫瘤前3位,尤其在西方發達國家,其發病率與致死率均為女性腫瘤的首位[1]。隨著診療手段與技術的發展,目前乳腺癌患者確診時以早期局限居多,極少有遠處轉移者,然而少部分患者確診時已經合并遠處轉移[2],同時部分患者手術治療后仍出現遠處轉移,其轉移部位則以骨、肺、肝、腦等常見,對于乳腺癌預后則一旦發生遠處轉移則將顯著增加患者病死率,尤其是河北哪個肝轉移者[3],其預后多較不理想,如未得到及時處理則絕大多數患者僅可存活6個月左右[4]。隨著我國乳腺癌患者的發病率、檢出率等增高,其合并遠處轉移者的數量亦隨之增多[5]。選擇2019年3月—2021年7月淄博市婦幼保健院收治的乳腺癌患者80例為研究對象,探討乳腺癌肝臟轉移者病理特征,并分析其影響乳腺癌肝轉移者預后的相關因素,現報道如下。
1 資料與方法
1.1 一般資料
選擇淄博市婦幼保健院收治的乳腺癌患者80例為研究對象。所有入組者其臨床資料獲取均通過醫院醫學倫理委員會批準,且取得醫務科、病案室許可。入組患者及家屬知情同意并簽署知情同意書。根據是否發生肝轉移分為兩組,其中存在肝轉移者40例,無肝轉移者40例,兩組相關資料見表1、表2。
1.2 納入與排除標準
納入標準:入組者均通過病理組織學檢查確診,并結合醫學影像學檢查明確合并肝轉移;患者既往體健。排除標準:存在嚴重心肺功能不全、精神異常者;預計生存時間在1個月以內者;男性患者;原發病灶非乳腺者;同時合并其他部位原發惡性腫瘤者;臨床資料不完整者。
1.3 方法
首先通過常規肝臟超聲檢查初診乳腺癌肝轉移病灶,隨后實施增強CT檢查,并結合PET/CT針對存在的肝轉移病灶進行精確定位,與此同時結合患者血清腫瘤標記物CA-125,CA-153、癌胚抗原和甲胎蛋白等檢查,并在明確肝臟病灶后通過經皮肝穿刺病理組織活檢確診。
1.4 觀察指標
首先根據乳腺癌患者是否合并肝轉移,統計其年齡、腫瘤大小、腋下淋巴結數量、病程、手術方式和病變部位等一般資料,并對是否合并肝轉移者的組織分化與分級等進行比較,結合免疫組化驗查分析免疫學指標中的ER陽性、PR陽性和Her-2陽性比例,分析肝轉移發生時間與腫瘤大小、腋下淋巴結數量及病程的相關性,針對影響乳腺癌術后肝轉移的影響因素再實施多因素Logistic回歸分析,明確影響乳腺癌術后肝轉移的相關影響因素和獨立危險因素。
1.5 統計方法
采用SPSS 20.0統計學軟件處理數據,符合正態分布的計量資料以(±s)表示,采用t檢驗;計數資料以[n(%)]表示,采用χ2檢驗;肝轉移發生時間與腫瘤大小、腋下淋巴結數量及病程的相關性分析以Pearson法進行,針對影響乳腺癌術后肝轉移的危險因素進行單因素和多因素Logistic回歸分析,P<0.05為差異有統計學意義
2 結果
2.1 肝轉移和無肝轉移患者一般資料比較
肝轉移者腫瘤大小大于無肝轉移者,腋下淋巴結數量多于無肝轉移者,病程長于無肝轉移者,差異有統計學意義(P<0.05)。且手術方式以保乳術居多,見表1、表2。
表1 肝轉移和無肝轉移患者一般資料比較(±s)
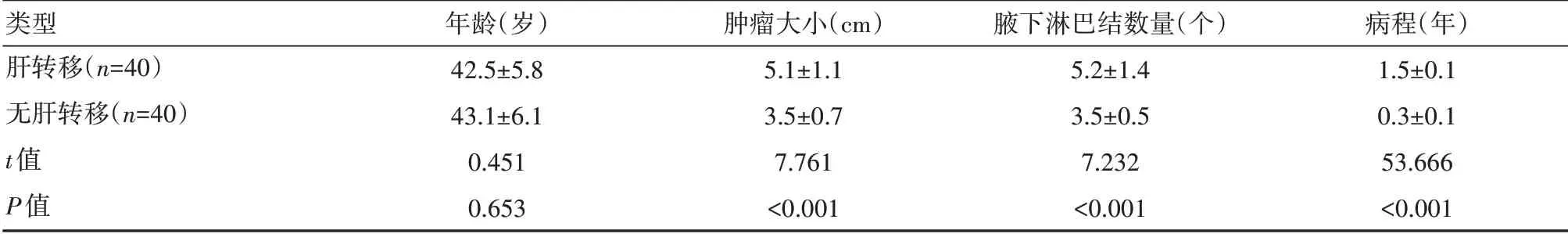
表1 肝轉移和無肝轉移患者一般資料比較(±s)
類型肝轉移(n=40)無肝轉移(n=40)t值P值年齡(歲)42.5±5.8 43.1±6.1 0.451 0.653腫瘤大小(cm)5.1±1.1 3.5±0.7 7.761<0.001腋下淋巴結數量(個)5.2±1.4 3.5±0.5 7.232<0.001病程(年)1.5±0.1 0.3±0.1 53.666<0.001
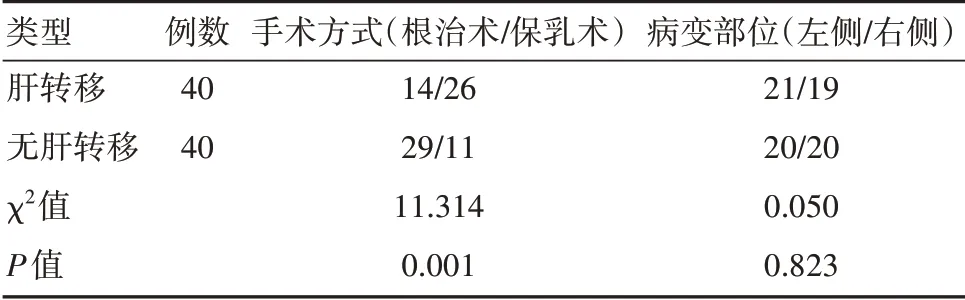
表2 肝轉移和無肝轉移患者一般資料比較
2.2 肝轉移和無肝轉移患者分化情況、組織分級和免疫學指標比較
肝轉移者其低分化、組織學分級Ⅱ級及以上和淋巴結陽性比例高于無肝轉移者,ER陽性、PR陽性和Her-2陽性比例低于無肝轉移者,差異有統計學意義(P<0.05)。見表3。
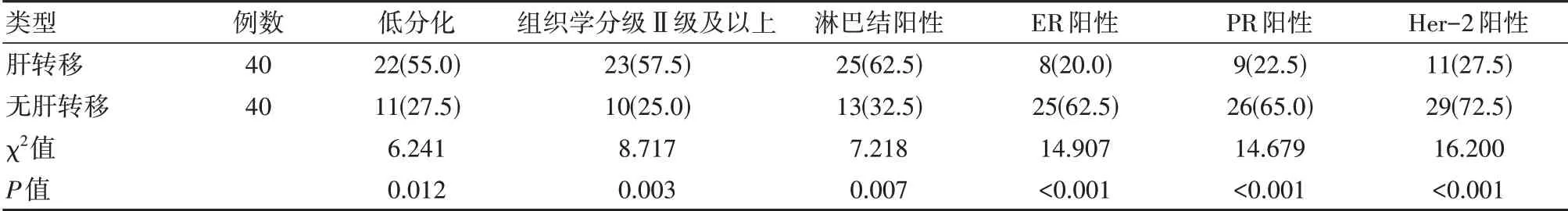
表3 肝轉移和無肝轉移患者分化情況、組織分級和免疫學指標比較[n(%)]
2.3 肝轉移發生時間與腫瘤大小、腋下淋巴結數量及病程的相關性分析
肝轉移發生時間與腫瘤大小呈正相關(r=0.659,P<0.001),肝轉移發生時間與腋下淋巴結數量呈正相關(r=0.826,P<0.001),肝轉移發生時間與病程呈正相關(r=0.716,P<0.001)。
2.4 影響乳腺癌術后肝轉移的多因素Logistic回歸分析
多因素Logistic回歸分析發現,腋下淋巴結數量>3個、手術方式為保乳術、病理類型為低分化、組織學分級Ⅱ級及以上為影響乳腺癌術后肝轉移的獨立危險因素(P<0.05)。患者病程、淋巴結陽性情況、ER陽性、PR陽性以及Her-2陽性等不是乳腺癌術后發生肝轉移的危險因素。見表4。
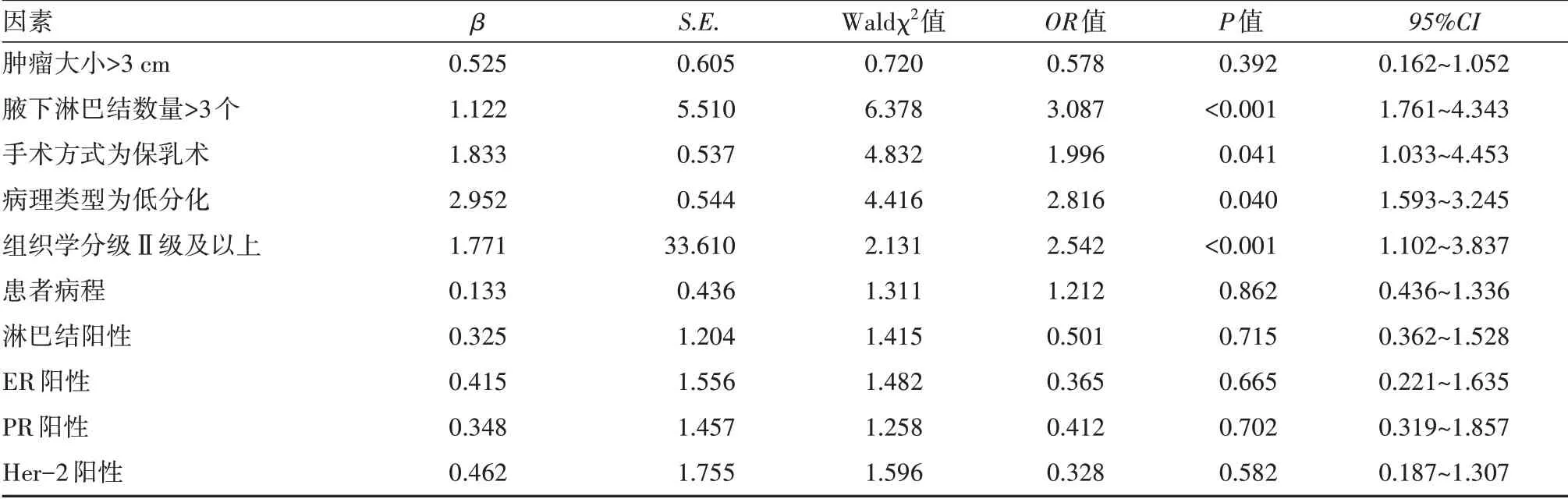
表4 影響乳腺癌術后肝轉移的多因素Logistic回歸分析
3 討論
乳腺癌的發現率隨著近年醫療技術水平的改善,有明顯增高,其中早期乳腺癌亦得以檢出,進而有效降低乳腺癌的病死率。但部分乳腺癌患者雖然及時接受手術治療,仍有發生術后遠隔臟器轉移的概率[6]。其中肝轉移是乳腺癌手術后較為常見的轉移部位,其多數預后不良[7]。因乳腺癌肝轉移后患者早期多無明顯癥狀,發現時多處于肝功能嚴重損傷狀態,此時患者的肝轉移病灶已處于十分嚴重階段,對于常規的化療、靶向藥物干預等效果有限[8-9]。既往研究證實,不同病理類型的乳腺癌患者其發生肝轉移的概率不盡相同[10]。而目前針對病理數據與乳腺癌肝轉移的相關性的報道相對較少,尤其是病理相關指標與乳腺癌術后肝轉移的相關性及對預后的評估方面,有待進一步深入研究。
針對乳腺癌是否發生肝轉移者,本研究發現肝轉移者腫瘤大小大于無肝轉移者,腋下淋巴結數量多于無肝轉移者,病程長于無肝轉移者,且手術方式以保乳術居多。楊平[11]研究稱乳腺癌合并肝轉移者,其腫瘤大小為(5.0±1.0)cm,腋下淋巴結數量為(5.0±1.5)個,且其病程為(1.5±0.1)年,其結果與本研究結果相符。證實乳腺癌患者發病時其病灶相對較大,多合并腋下淋巴結轉移,且病程較長,而且進行手術治療時其多選擇保乳手術。另外肝轉移者其低分化、組織學分級Ⅱ級及以上和淋巴結陽性比例分別為22例(55.0%),23例(57.5%)和25例(62.5%),高于無肝轉移者的11例(27.5%),10例(25.0%)和13例(32.5%)(P<0.05),ER陽性、PR陽性和Her-2陽性比例為低于無肝轉移者(P<0.05)。葉曄等[12]則認為肝轉移者其低分化、組織學分級Ⅱ級及以上和淋巴結陽性比例分別達到55.0%,62.5%及65.5%,兩項研究結果具有顯著一致性。本研究結果發現乳腺癌肝轉移者其病理分化程度以低分化多見,組織學分級Ⅱ級及以上為主,且合并有淋巴結陽性者居多。隨后分析肝轉移發生時間與腫瘤大小、腋下淋巴結數量及病程的相關性發現,肝轉移發生時間與腫瘤大小呈正相關,肝轉移發生時間與腋下淋巴結數量呈正相關,肝轉移發生時間與病程呈正相關。唐鈴豐等[13]亦認為乳腺癌患者肝轉移發生時間與腫瘤大小、腋下淋巴結數量及病程均呈正相關。說明腫瘤病灶越大、發病時腋下淋巴結數量越多、患者病程越長其發生肝轉移的概率越高。最后針對影響乳腺癌術后肝轉移的多因素Logistic回歸分析,腋下淋巴結數量>3個、手術方式為保乳術、病理類型為低分化、組織學分級Ⅱ級及以上為影響乳腺癌術后肝轉移的獨立危險因素。患者病程、淋巴結陽性情況、ER陽性、PR陽性以及Her-2陽性等不是乳腺癌術后發生肝轉移的危險因素。徐偉熙等[14]研究亦提示發病時腋下淋巴結數量≥3個,采取保乳術的低分化組織學分級Ⅱ級以上者,是乳腺癌術后肝轉移的獨立危險因素。
目前針對乳腺癌肝轉移的研究其循證醫學證據級別均相對較低,尚無隨機對照研究結果。故針對乳腺癌肝轉移手術治療選擇指導意義有限。且目前尚無明確指南針對乳腺癌手術后肝轉移的救治進行闡述[11]。乳腺癌患者腫瘤病灶越大、腋下淋巴結數量越多、病程越長,提示腫瘤組織的惡性程度越高,從而更容易發生遠隔臟器的早期轉移[12]。同時其病理類型為低分化、組織學分級Ⅱ級及以上者其腫瘤細胞增殖能力越強,惡性程度越高,提示其早期出現肝轉移的概率亦越高[13]。而且乳腺癌肝轉移者其機體免疫微環境改變,通過腫瘤間質中浸潤淋巴細胞比例進而誘導腫瘤組織與機體的免疫應答失衡,對于ER、PR和Her-2三陰性乳腺癌者,其生物學行為活性更高、病理特征以中、低分化常見,對多種抗腫瘤藥物耐受,其實施免疫治療效果較差,即便實施手術治療,亦存在較高的術后早期遠隔臟器轉移風險[14-15]。
綜上所述,病灶>3 cm、腋下淋巴結數量>3個的低分化、實施保乳術、組織學分級Ⅱ級及以上的乳腺癌患者,其發生肝轉移概率較高,需要引起臨床重視。

