多肽熒光探針HWEHH對水中銅離子的高通量檢測
許迪雅 張海曼 張 新 張雅丹 王 芳 張 琳
(1. 特醫食品加工湖南省重點實驗室,湖南 長沙 410000;2. 中南林業科技大學食品科學與工程學院,湖南 長沙 410000;3. 食品安全監測與預警湖南省重點實驗室,湖南 長沙 410117;4. 湖南省產商品質量檢驗研究院,湖南 長沙 410117)
銅是人體內必不可少的微量金屬元素,其需求量僅次于鐵和鋅[1]。但體內銅離子(Cu2+)含量過多又會對臟器造成負擔,還會導致許多神經系統疾病,如阿爾茨海默癥[2]、威爾遜氏病[3]、唐氏綜合征[4]等。金屬銅被廣泛應用于工業生產中,而生產中的廢銅若未經過處理直接排放會污染環境。動植物能夠從環境中吸收Cu2+,又通過食物鏈富集到人體[5]。此外,人體對于Cu2+的攝入還來源于飲用水。世界衛生組織(WHO)規定,Cu2+在飲用水中的含量不能超過2 mg/L[6],成年人銅的攝取量不應超過10~12 mg/d。目前,Cu2+的檢測方法主要分為直接檢測法和間接檢測法。直接檢測法是利用Cu2+本身的物理、化學特性進行檢測,主要包括原子吸收法[7]、電感耦合等離子體質譜法和生物傳感器法[8]等。在利用原子吸收光譜法進行測定時,不同光源燈對應著不同的元素,對樣品進行測量時需要及時更換光源燈。并且原子吸收光譜法的標準工作曲線線性范圍比較窄,靈敏度低和抗干擾性弱等[9]。電感耦合等離子體質譜法檢測離子的方法簡單、速度快,但儀器價格昂貴[10]。間接檢測法主要是利用Cu2+與熒光探針的特定化學反應進行檢測。例如:熒光光譜法、比色法、免疫分析法、酶分析法等。其中,熒光光譜法因為其高靈敏度、強選擇性、操作簡單和響應速度快的優點[11],可以快速、大批量地檢測樣品中Cu2+的含量,近年來被廣泛關注。
熒光探針分析法是一種建立在熒光分析光譜和探針熒光強度變化上的識別方法[12]。熒光分子探針技術對目標物進行檢測的工作機制主要包括分子內電荷轉移[13]、光致電子轉移[14]、熒光共振能量轉移[15]、聚集誘導發光[16]及激發態分子內質子轉移[17]。近年來,大量有機分子熒光探針被用于Cu2+的檢測,但有機分子熒光探針的合成過程中會使用到大量有毒有害的試劑,污染環境,且水溶性差。基于水溶性較好的多肽熒光探針因具有結構簡單、生物相容性好等特點[18]受到關注。而熒光基團標記探針合成較為復雜,且副產物多。因此采用內源性熒光的多肽熒光探針能簡化合成步驟,提高探針的水溶性,降低成本。
高通量檢測技術是指可以一次檢測多個樣品或者對同一種樣品進行多種檢測的技術[19],被廣泛應用于食品安全、藥物/菌種篩選等領域[20]。高通量檢測多基于酶聯免疫測定技術、多重PCR技術、基因芯片檢測技術等實現單次多個樣品的同時檢測。其中多功能酶標儀因為擁有多種檢測模式(吸光度、熒光強度、時間分辨熒光等)、操作簡單、樣品消耗量少、成本低等優點被廣泛應用于高通量檢測中。
研究擬開發組氨酸—色氨酸—谷氨酸—組氨酸—組氨酸(HWEHH)熒光探針,其中色氨酸(W)具有強熒光,組氨酸(H)可以與Cu2+絡合,谷氨酸(E)可以增加多肽的水溶性和穩定性。根據Cu2+與多肽熒光探針絡合后探針熒光強度的變化,實現對Cu2+的檢測,并結合酶標儀實現多肽熒光探針對水中Cu2+的高通量檢測,為實現水溶液中的Cu2+快速檢測提供一種新方法。
1 材料與方法
1.1 材料與試劑
HWEHH(圖1)多肽熒光探針:分析純,探針序列由實驗室設計,由上海強耀生物集團有限公司合成并純化;

圖1 HWEHH結構Figure 1 The structure of HWEHH
各金屬陽離子:分析純,國藥集團化學試劑有限公司;
濃硫酸、濃鹽酸:分析純,成都市科隆化學品有限公司;
4-(2-羥乙基)-1-哌嗪乙磺酸(HEPES):分析純,美國Sigma公司;
試驗用水為去離子水;
自來水:中南林業科技大學神農樓;
飲用水:中南林業科技大學神農樓直飲水系統。
1.2 儀器與設備
熒光分光光度計:F-4600型,日本高新技術公司;
紫外分光光度計:UV-2600型,日本島津公司;
多功能酶標儀:Spectra Max i3x型,上海美谷分子儀器有限公司。
1.3 方法
1.3.1 溶液的配制 將凍干多肽探針(HWEHH)粉末直接溶于10 mmol/L NaOH溶液中,制成濃度約為1 mmol/L 的探針儲備液,并將其稀釋至2 μmol/L的標準工作液。用紫外分光光度計檢測多肽溶液的濃度。各金屬離子溶液采用其陰離子所對應的酸配制成濃度為1 mmol/L 的離子溶液。
1.3.2 紫外可見分光光度法 掃描范圍200~800 nm,以10 mmol/L HEPES緩沖溶液為空白背景調零,紫外分光光度計對儲備液稀釋液進行檢測。根據朗伯比爾定律[21]按式(1)測定可溶性多肽的濃度。
A=Σbc,
(1)
式中:
A——吸光度;
Σ——色氨酸的摩爾吸光系數,5 400 L/(mol·cm);
b——吸收池的厚度,cm;
c——溶液的摩爾濃度,mol/L。
1.3.3 熒光分光光度法
(1) 測定多肽熒光探針光譜:以280 nm為激發波長,發射波長為290~450 nm,室溫下對HWEHH多肽探針溶液進行熒光測量。狹縫設置10.0 nm,電壓500 V。對HEPES溶液、探針溶液、含有Cu2+的多肽探針溶液進行3次熒光測量。
(2) 溫度對探針穩定性的影響:選取不同的溫度(25,30,35,40,45,50,55,60 ℃)孵育2 μmol/L的標準工作液10 min后進行熒光測量,記錄不同溫度下多肽探針的熒光強度。
(3) pH對多肽熒光探針的影響:使用HCl和NaOH溶液調節HEPES緩沖溶液的pH分別為2.0,4.0,6.0,7.4,8.0,10.0。采用不同pH緩沖溶液稀釋儲備液得2 μmol/L 的標準工作液,進行熒光測量記錄溶液的熒光強度,再向其中滴加Cu2+,使溶液中Cu2+最終濃度為1.5 μmol/L,計算不同pH下多肽探針的熒光變化率。
(4) 標準曲線:
① 單個樣品檢測的標準曲線:向多肽探針溶液中滴加Cu2+進行熒光測量,直至熒光強度不再變化,記錄每次滴加Cu2+的體積、濃度及熒光強度,繪制Cu2+標準曲線,并按式(2)計算解離常數[22]。
ΔF=F0-FL=[(F0-Fα)/2M0]{(L+M0+Kd)-[(L+M0+Kd)2-4M0L]1/2},
(2)
式中:
F0——無Cu2+存在下的熒光強度,AU;
FL——Cu2+存在下的熒光強度,AU;
Fα——Cu2+飽和的熒光強度,AU;
M0——多肽與Cu2+結合的實際濃度,μmol/L;
L——游離的Cu2+濃度,μmol/L;
Kd——解離常數,mol/L。
② 高通量樣品檢測的標準曲線:配置含有不同濃度Cu2+的多肽熒光探針溶液(0.1,0.2,0.3,0.4,0.5,0.8,1.0,1.2,1.5 μmol/L),加入384孔板中,于酶標儀中進行熒光測量,激發波長280 nm;發射波長310~450 nm;記錄熒光強度并繪制標準曲線。
(5) 選擇性試驗:標準工作液中滴加不同的金屬陽離子,使其最終濃度均為1.5 μmol/L,對其進行熒光測量,再向含有不同金屬陽離子的工作液中滴加Cu2+,使Cu2+濃度為1.5 μmol/L。記錄熒光變化強度,并與只含Cu2+工作液的熒光變化強度進行對比。
1.4 HWEHH熒光探針檢測限的確定
重復掃描標準工作液20次,按式(3)計算該熒光探針在該濃度下的檢測限[23]。
LOD= 3σ/S,
(3)
式中:
LOD——檢測限,μmol/L;
σ——空白條件下掃描溶液20次的標準偏差;
S——標準線性方程的斜率。
1.5 實際樣品的測定
對樣品的熒光強度進行測量以排除樣品自有的熒光強度對試驗準確性的影響。測量含有樣品的工作液的熒光強度,根據對應標準曲線計算樣品中Cu2+濃度,并進行樣品加標回收試驗檢測該方法的準確性。
2 結果與分析
2.1 HWEHH的激發特征及Cu2+對其熒光的淬滅作用
由圖2(a)可知,HWEHH熒光探針在280 nm處有最大吸收峰,吸光度為0.033,此時儲備液濃度為1.22 mmol/L。由圖2(b)可知,HEPES緩沖溶液在354 nm處無熒光峰,HWEHH探針溶液在354 nm處有較強的熒光峰。色氨酸的特征熒光峰約在360 nm[23],但是多肽中色氨酸的峰會由于周圍原子和電子的影響而發生偏移,因此HWEHH熒光探針的熒光峰的峰值位于354 nm。當向探針溶液中加入Cu2+后,溶液在354 nm處熒光值大幅度降低,從2 136降低至900.5,表明HWEHH熒光的淬滅是由Cu2+引起的。
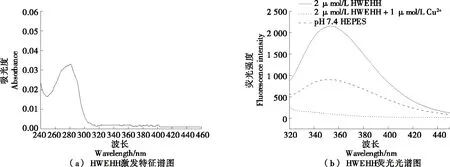
圖2 HWEHH特征譜圖Figure 2 HWEHH characteristic spectrum
2.2 溫度對HWEHH熒光探針穩定性的影響
由圖3可知,在試驗范圍內,30 ℃的熒光強度最大,隨著溫度的升高,探針溶液的熒光強度峰值將會降低(由2 485降至1 877)。這是因為溶液溫度(30 ℃以上)越高,介質黏度越低,分子之間的熱運動越劇烈[24],從而增加熒光分子同溶劑分子之間的碰撞幾率。由此得出熒光探針的最佳工作溫度為30 ℃。而25,30 ℃的熒光強度差異率為6%,考慮工作時的檢測成本,后續所有試驗均在25 ℃ 下進行。

圖3 HWEHH溶液在不同溫度下的熒光強度Figure 3 Fluorescence intensity of HWEHH solution at different temperatures
2.3 pH對HWEHH熒光探針的影響
由圖4(a)可知,當pH為2.0~8.0時,隨著pH的升高,熒光探針溶液在354 nm處的熒光強度也隨之升高。這是因為溶液pH值的變化影響熒光物質的電離狀態,從而影響熒光物質的熒光強度。由圖4(b)可知,Cu2+加入引起的多肽探針熒光變化率也會受到pH的影響,多肽熒光探針在酸性條件下與Cu2+結合較弱,熒光淬滅效果不明顯,變化率為0~0.2。增大pH,淬滅效果越來越明顯,變化率達到0.6以上,說明其靈敏度也升高。當pH增大到7.4,8.0時變化率達到最佳,8.0之后pH越大,靈敏度隨之降低。這是因為酸性條件下,谷氨酸帶正電,與Cu2+產生靜電斥力,難以絡合,中性環境下,谷氨酸帶負電,與Cu2+有靜電吸引作用,使絡合更加穩定[25]。組成多肽的氨基酸等電點均≤7.6,在pH 10時,4個多肽分子均帶較多負電荷有斥力作用,與Cu2+的結合能力比pH 7.4,8.0的穩定性差。通常情況下液體酸堿值大部分為中性,因此后續所有試驗均在pH 7.4下進行。
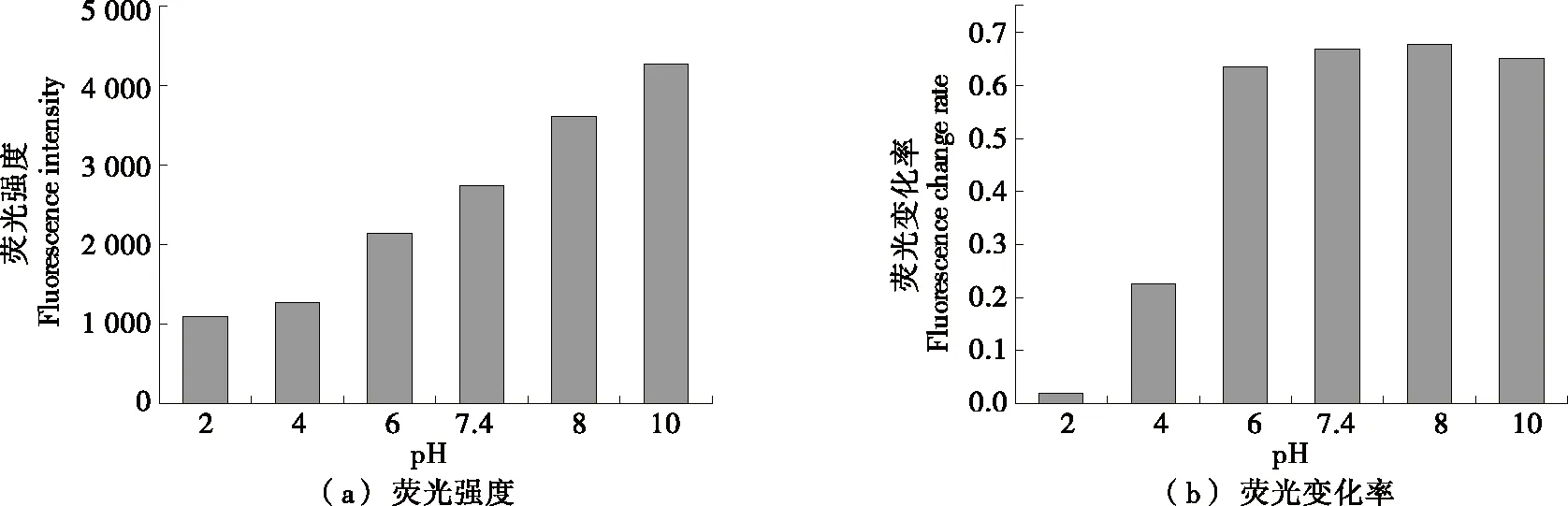
圖4 不同pH下HWEHH熒光探針的熒光強度及熒光變化率Figure 4 Fluorescence intensity and change rate of HWEHH fluorescent probe at different pH value
2.4 HWEHH熒光探針檢測Cu2+的標準曲線、解離常數和檢測限
由圖5(a)可知,Cu2+對該探針的淬滅效果具有濃度依賴性。由圖5(b)可知,當Cu2+濃度為0~1.5 μmol/L時,隨著Cu2+濃度的增加,多肽探針的熒光強度降低,且其熒光強度與Cu2+呈負相關,此時解離常數為7.5×10-7mol/L,絡合常數是解離常數的倒數,為1.3×106L/mol,證明其絡合能力較強。其線性方程為Y= -1 135.085 7X+2 048.187 6(R2=0.999),檢測限為0.036 μmol/L。
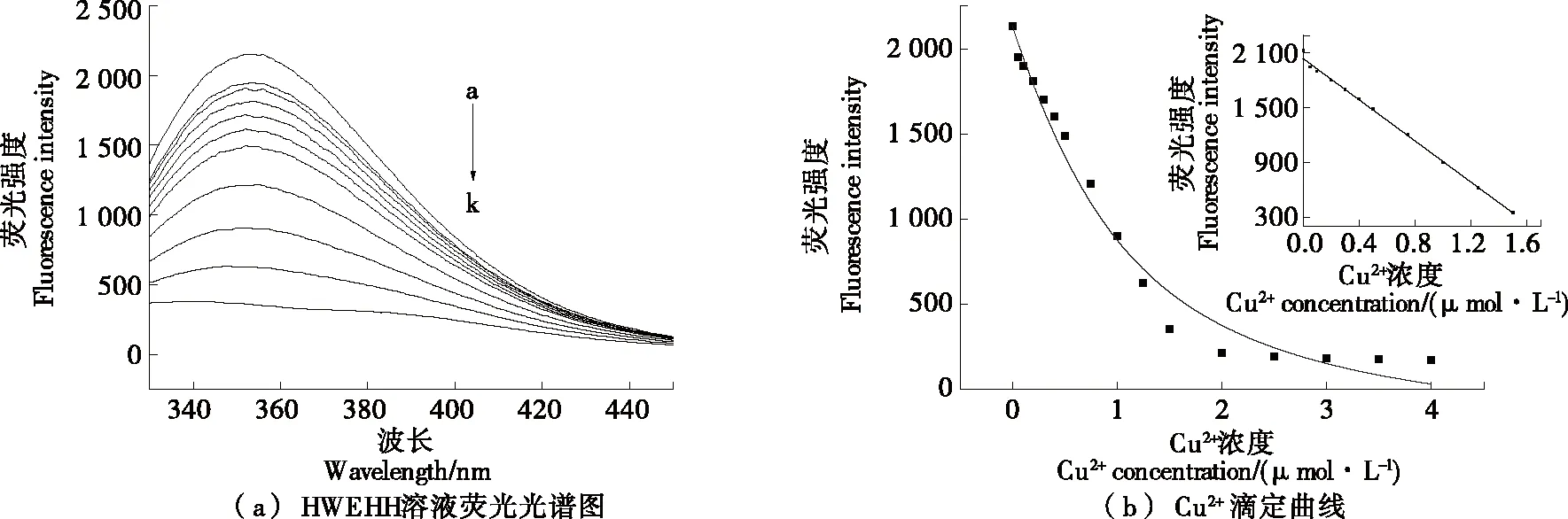
a~k中Cu2+濃度依次為:1.5,0.25,1,0.75,0.5,0.4,0.3,0.2,0.1,0.05,0 μmol/L圖5 不同濃度Cu2+的HWEHH溶液熒光光譜圖及標準曲線Figure 5 Flourescence spectra standard curve of HWEHH containing different concentrations of Cu2+
2.5 HWEHH熒光探針對Cu2+的選擇性
由圖6(a)可知,只有Cu2+能引起探針熒光的顯著變化(0.81),其他金屬陽離子對該探針無明顯的淬滅效果(0.03~0.05)。由圖6(b)可知,當溶液中存在其他金屬陽離子時,不會對HWEHH熒光探針識別Cu2+產生影響。
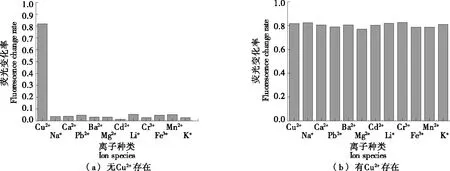
圖6 含有不同金屬陽離子的多肽溶液的熒光變化率Figure 6 Fluorescence change rate of HWEHH peptide solution containing different metal cations
2.6 HWEHH高通量檢測Cu2+的標準曲線
由圖7可知,關于Cu2+濃度的線性方程為Y=-283 958.437X+680 750.954(R2=0.981),說明可以利用多肽熒光探針法同高通量檢測技術結合來檢測食品中的Cu2+濃度。
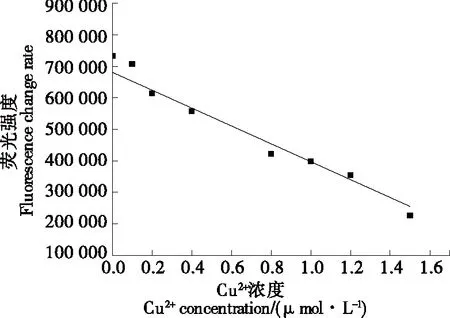
圖7 高通量檢測Cu2+濃度的標準曲線Figure 7 Standard curve of Cu2+ concentration in high-throughput detection
2.7 實際樣品中Cu2+的測定
自來水、飲用水在310 nm左右有水的拉曼峰,在其他位置無峰出現,說明樣品自身在354 nm處無熒光值,不會影響HWEHH熒光探針對樣品中Cu2+濃度的檢測。由表1可知,自來水和飲用水中的加標回收率為93.6%~101.9%,表明該熒光探針可以用于實際樣品中Cu2+含量的檢測。
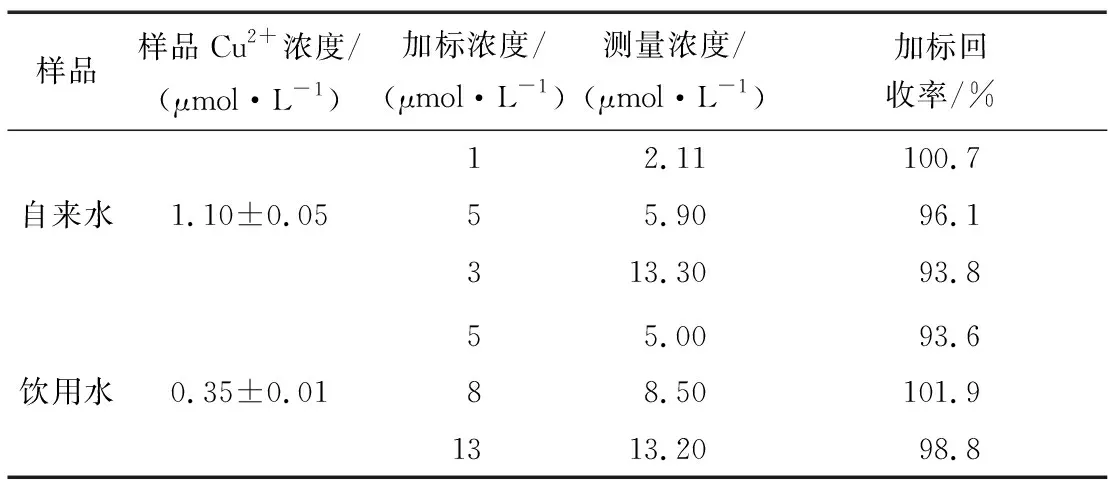
表1 加標回收率Table 1 Standard recovery rate
3 結論
利用組氨酸—色氨酸—谷氨酸—組氨酸—組氨酸(HWEHH)多肽作為熒光探針,檢測了樣品中Cu2+的含量。結果表明,當樣品中存在Cu2+時,Cu2+與HWEHH絡合,阻斷多肽分子內電子轉移,導致HWEHH熒光的淬滅,使探針熒光值降低。當熒光探針濃度為2 μmol/L時,其對Cu2+有較高的選擇性,且檢測的線性范圍為0~1.5 μmol/L,線性方程為Y= -1 135.085 7X+2 048.187 6,檢出限為0.036 μmol/L。利用384孔板結合HWEHH熒光探針可實現對Cu2+的高通量檢測。通過對實際水樣品(自來水、飲用水)中Cu2+進行加標試驗發現其回收率較高,可有效實現水溶液中Cu2+的檢測。此外,該探針與Cu2+的絡合機制沒有進行深入研究,后續可以采取核磁共振、計算機模擬等方法對其作用機理進行進一步探究。

