探討小劑量氯胺酮抑制癌痛大鼠嗎啡耐受機制
張俊霞,梁艷芳,張秀寧,徐貫杰,李志華,劉春曉
(1.內蒙古自治區人民醫院手術麻醉二科,內蒙古 呼和浩特 010017;2.內蒙古醫科大學研究生學院;3.河北醫科大學第三醫院手術麻醉一科)
絕大多數癌癥患者到中晚期后,最難以忍受的臨床癥狀即無法緩解的重度疼痛,重度癌痛具備長期性、漸進性及復雜性等特征,不僅對病人生理、心理及人際關系產生不良影響,而且對機體免疫功能也產生重要影響,其中以骨癌疼痛為著[1]。目前臨床上多采用手術、放化療、阿片類止痛藥物來緩解中重度骨轉移性癌痛。但絕大數患者不能得到滿意的鎮痛效果,這促使最大限度地幫助晚期癌癥患者緩解疼痛、解除疼痛帶來副作用逐漸成為臨床醫生的首要任務。
阿片類止痛藥物被世界衛生組織指定作為抗擊晚期癌痛治療的“第三階梯”用藥,通過與不同腦區阿片受體結合抑制P物質釋放干擾中樞系統發揮鎮痛作用,鞘內給藥長效治療效果廣受臨床醫生認可[2]。但最新研究指出長期應用嗎啡抗擊癌痛除產生的耐藥性及毒副作用外,其亦參與癌細胞的擴散與發展,因此限制了其在臨床中的使用[3]。
氯胺酮是一種N-甲基D-天氨酸受體選擇性拮抗藥,作為短效鎮痛劑,早有報道指出小劑量鞘內注射可以輔助增加嗎啡等阿片類鎮痛藥物的鎮痛效果,同時一定程度逆轉嗎啡長期應用產生機體耐受性[4]。國內外臨床醫生及學者推薦可鞘內注射小劑量氯胺酮聯合嗎啡協同參與鎮痛的治療,減輕嗎啡耐藥性及毒性作用[5]。本研究擬通過觀察小劑量氯胺酮鞘內注射嗎啡癌耐受小鼠模型影響并進行相關機制探討。
1 材料與方法
1.1 細胞及動物
MADB-106乳腺癌細胞(購于拜力生物科技有限公司,上海)。SPF級健康雌性SD大鼠,體質量為230~250 g(購于河北醫科大學動物實驗中心)。飼養環境:室溫(25±0.5)℃,混合飼料和純凈水喂養,自由飲食飲水。
1.2 藥物和試劑
鹽酸嗎啡注射液(購自沈陽第一制藥廠,東北制藥廠批號081105-1,國藥準字H21022436);鹽酸氯胺酮注射液(購自恒瑞醫藥股份有限公司,江蘇,批號KH090501);DMEM高糖(購自GIBCO公司);胎牛血清(購自CLARK公司);二甲基亞砜(購自勃盛化學試劑有限公司);胰蛋白酶-EDTA(購自宏瑞特生物技術有限公司);緩激肽檢測試劑盒(購自R&D公司,美國);兔Substance-P抗體(購自博士德生物工程有限公司);濃縮型DAB試劑盒(購自中杉金橋公司,北京);SP免疫細胞化學試劑盒(購自博海生物工程有限公司);Poly-L-LysineSolution(多聚賴氨酸,購自博海生物工程有限公司,河北)。
1.3 動物模型的制備
1.3.1 在癌痛大鼠模型基礎上制作本研究所用脛骨癌痛模型。將10%水合氯醛350 mg/kg注射入大鼠腹腔麻醉后,將大鼠仰臥位捆綁固定于操作板,使用有齒鑷夾腳趾,直到大鼠對鉗夾無反應,同時均勻自主呼吸,判定為麻醉滿意。穿刺部位統一選為大鼠左側脛骨上段,與膝關節距離1 cm處,模型組(B組)將乳腺癌細胞3μl(大約4.8×106/mL)注入大鼠脛骨骨髓腔,注射完畢后5 min將針頭拔出,并用骨蠟迅速封孔,逐層縫合。空白對照組(A組)以同樣操作規范注射相同容積的生理鹽水,假手術組(C組)進行手術操作,不進行藥物注射。分別于術后8 d、14 d以大鼠自由行走痛行為、輻射熱痛閾、X線影像學及患肢脛骨HE染色驗證癌痛模型建立成功與否。
1.3.2 慢性嗎啡鎮痛耐受模型的制備 建模成功的脛骨癌痛大鼠于手術后21 d連續皮下注射鹽酸嗎啡注射液(10 mg/kg,2次/d,間隔12 h,共9 d),制做嗎啡鎮痛耐受模型;隔天測定痛閾,以監測大鼠痛閾的變化和有無嗎啡鎮痛耐受發生。
1.4 分組及給藥
對癌痛嗎啡耐受大鼠(即手術后30 d)進行鞘內置管,將上述癌痛大鼠模型隨機分為4組,對照組(F組):鞘內注射0.9%生理鹽水10μL,1次/d;氯胺酮組(G組):鞘內注射氯胺酮注射液25μg(10μL),1次/d;嗎啡組(H組):皮下注射嗎啡10 mg/kg,2次/d;氯胺酮聯合嗎啡組(I組):皮下注射嗎啡10 mg/kg,2次/d,鞘內注射氯胺酮25μg(10μL),1次/d。
1.5 監測指標及方法
癌痛模型術前1日至實驗37日通過間斷監測輻射熱痛閾觀察疼痛行為學的變化。
免疫組織化學染色方法和固相夾心法酶聯免疫吸附方法—實驗進行到第37 d時,最后一次給大鼠注藥后,等待1 h,以斷頭法立即處死大鼠,摘取大鼠腰4到腰6脊髓節段,取下約2 cm長脊髓,取1 cm脊髓將上述組織即刻浸泡于濃度為4%多聚甲醛液固定24 h,用免疫細胞化學(IH)染色法檢測SP含量。將余留1 cm脊髓組織置于液氮中保存,取材結束后將其余脊髓標本放置于溫度為-80℃冰箱保存,用ELISA法檢測脊髓BK含量。
1.6 統計學方法
2 結果
2.1 組織病理學改變
癌痛模型建立成功的大鼠8 d后,經HE染色可見左側脛骨骨髓腔內及骨小梁間出現較多形狀改變、多個細胞核的腫瘤細胞,骨小梁組織結構未出現改變;14 d觀察到骨髓腔上述腫瘤細胞有所增加,并且癌細胞絕大多數表現活躍,X線顯示骨小梁遭到廣泛侵襲,骨皮質受破壞后變薄,其周圍可見較多編織骨;37 d經HE染色后,大量腫瘤細胞充斥在骨髓腔內,中央大部分組織已退變壞死,骨髓腔邊緣腫瘤細胞表現活躍。腫瘤組織表現為向外生長造成更大范圍的骨皮質侵襲、破壞(見圖1)。

圖1
2.2 癌痛大鼠模型X線檢查
患肢X線顯示骨質破壞明顯,并且隨時間延長骨破壞程度增加。建模后10 d注射部位松質骨表現為局限的低密度缺如影像;第20 d骨損害逐漸嚴重,骨皮質完全破壞,出現更大面積的病損,2只大鼠已發生病理性骨折(見圖2)。
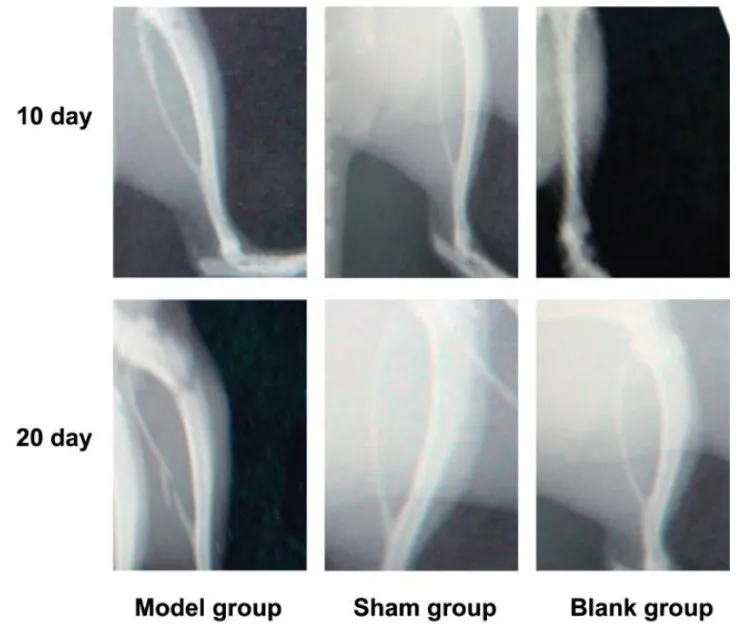
圖2
2.3 大鼠痛閾值比較
癌痛大鼠模型(B組)痛閾值與空白對照組(A組)大鼠和假手術組(C組)大鼠比較差異有統計學意義(P<0.05),即癌痛大鼠模型痛閾值低于正常大鼠和假手術組大鼠(見圖3)。用藥處理前C組、G組、H組及I組間痛閾值差異無顯著統計學意義(P>0.05),用藥7 d后痛閾比較差異有統計學意義(P<0.05)。其中I組痛閾顯著低于F組、H組和G組(P<0.05)(見圖4)。
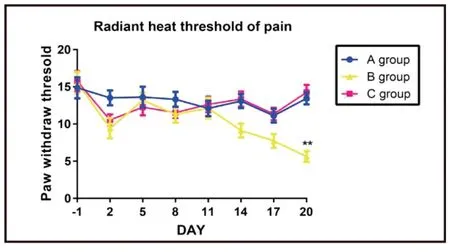
圖3

圖4
2.4 緩激肽表達影響
F組、H組、G組及I組與A組緩激肽表達水平比較差異均有統計學意義(P<0.05)。F組與G組緩激肽表達水平比較差異無統計學意義(P>0.05);F組與H組緩激肽水平比較差異無統計學意義(P>0.05);I組和H組比較,緩激肽表達水平顯著下降,差異有統計學意義(P<0.05)(見圖5)。
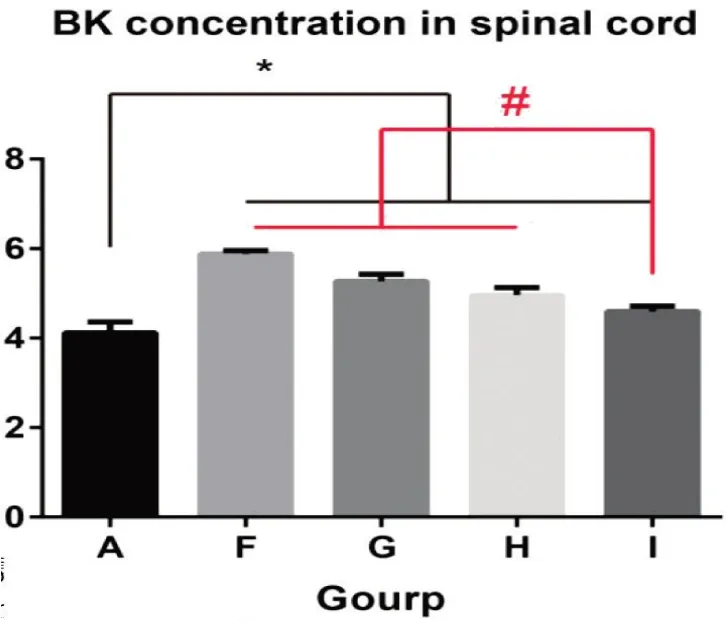
圖5
2.5 大鼠脊髓SP表達變化
F組在3個實驗動物組中的陽性反應最大,陽性指征的黃色顆粒呈密集分布。I組脊髓背角Ⅰ-Ⅱ層突觸素免疫陽性產物表達比H組明顯減少。用IPP圖像分析軟件檢測,結果顯示I組脊髓背角SP平均光密度值明顯低于其他3組[I組(0.02±0.03)、F組(0.25±0.02)、G組(0.21±0.02)、H組(0.22±0.03),P<0.05](見圖6)。

圖6
3 討論
癌痛多指癌癥本身、因癌癥引發的其他病變以及治療癌癥所引起的疼痛,作為癌癥患者最常見晚期并發癥,約38%~56%患者終末期發生中重度癌痛,其中10%~20%發生難治性癌痛。晚期的骨轉移性癌痛不僅在生理上給患者帶來痛苦,而且在心理上給患者帶來極大的不良影響,使患者在癌癥晚期極其痛苦,喪失對生活的希望和信心。阿片類止痛藥是“第三階梯”緩解癌痛的首選藥物,也是WHO推薦控制中重度癌痛的主要用藥。嗎啡一直被公認為是最有效的、最基礎的抗癌止痛劑。但無論是口服、靜脈還是其他方式給藥,單一、長期應用可引起機體耐受,甚至部分患者產生依賴等一系列不良反應[6]。近年來有臨床報道指出,常規給予阿片類鎮痛藥的同時復合低劑量氯胺酮可有效減低阿片類藥物耐藥性的發生。同時證實小劑量氯胺酮可以有效降低嗎啡耐受性的產生,但至今具體機制尚未明確定論[7,8]。本實驗通過給予嗎啡耐受癌痛大鼠模型鞘內注射低劑量氯胺酮,并觀察產生的效果影響,并對其可能存在的機制進行研究,希望可以更好地指導臨床上對于骨癌痛的治療。
癌痛中骨癌痛最常見、顯著、典型;其次,骨癌痛大鼠模型也是成功率最高、疼痛部位最為穩定、行為學改變最接近人類改變的動物模型[9,10]。因此,本研究擬定骨轉移性癌痛大鼠模型作為研究對象。參照既往癌痛大鼠模型制備基礎上,我們選用與本研究實驗動物同源的MADB-106乳腺癌細胞進行脛骨癌痛大鼠模型制備。造模成功后分別從病理組織、X線影像表現及疼痛閾值等幾個角度進行骨癌模型評價。證實MADB-106乳腺癌細胞具備大鼠脛骨建立骨癌痛模型可行性且造模成功率也得到了顯著的提高。
氯胺酮(Ketamine)是苯環己哌啶(Phencyclidine)的衍生物,作為臨床常用靜脈麻醉藥物代表,不同劑量下親和多種受體(阿片受體)與離子通道(鈉鉀離子通道),對不同腦區多種關鍵分子、多種基本神經活動功能存在廣泛影響而產生多樣藥理作用[11]。鞘內給藥的優勢是使得藥物迅速在腦脊液中擴散開來以獲得有效的血藥濃度[12]。Borgbjerg等[13]證實小劑量鞘內給藥不僅無組織學損傷亦可使其發揮有效作用,同時避免大劑量用藥產生的分離麻醉、精神異常等氯胺酮副反應。Fisher等[14]亦提倡鞘內或硬膜外氯胺酮給藥。因此,我們通過鞘內小劑量注射氯胺酮(<1 mg/kg)方式進行給藥干預,以疼痛閾值及自由行走痛行為學指標作為研究觀察指標。結果證實單純鞘內給予小劑量氯胺酮雖然有止疼效果,但因其維持時間較短,故不建議以此方法給藥。氯胺酮干預組嗎啡耐受大鼠模型鎮痛作用較慢性嗎啡耐受模型組鎮痛作用存在統計學意義,證實二者聯合應用可增強鎮痛作用且一定程度緩解了嗎啡用藥產生的耐受性。這一研究與Schmid等[15]的實驗結果相同,即鞘內小劑量氯胺酮能夠降低嗎啡耐受,增強嗎啡對軀體和內臟的止疼效果。眾所周知,嗎啡通過與阿片受體結合,對腺苷酸環化酶-環磷酸腺苷(AC-cA MP)信號轉導通路產生抑制作用而發揮鎮痛效應。長期嗎啡治療使機體產生一系列適應性改變,如阿片類受體出現數量降低、內化、與Gi蛋白脫耦聯及環磷酸腺苷(cAMP)信號轉導系統的上調及超敏等磷酸化反應,最終引起參與疼痛通路傳導中重要緩激肽與腫瘤細胞表面B2受體結合使胞質內產生高濃度Ca2+,激活NOS產生NO激活鳥苷酸環化酶,產生高濃度cGMP引起機體耐受[16,17]。氯胺酮作為少有的用于治療復雜的區域性疼痛綜合征(comp lex regional pain syndrome,CRPS)的有效藥物,鎮痛作用是廣受臨床認可的。但其緩解疼痛的機理較為復雜,目前報道較多的一方面通過與阿片受體相互作用實現鎮痛作用[18]。因此可認為以上機制研究為氯胺酮增強嗎啡耐受癌痛大鼠模型鎮痛作用提供了理論依據。同時有研究指出長期應用嗎啡cAMP/PKA通路上調使得NMDA受體磷酸化及表達量明顯上調,氯胺酮本身為NMDA受體拮抗劑,因此,我們認為抑制NMDA受體發揮作用也是其嗎啡耐受主要機制之一[19]。另一方面作為NMDAR阻斷劑,有報道指出其可通過干預慢性痛中樞(即脊髓及更高級中樞神經系統)敏感化過程實現鎮痛作用[20]。研究表明引發疼痛的關鍵是中樞神經系統敏化和外周神經系統的超敏反應[21]。我們通過觀察氯胺酮干預組脊髓P物質及緩激肽含量表達發現明顯低于單純嗎啡耐受癌痛大鼠模型。脊髓SP是主要的痛覺信號傳遞物質,由背根神經節中的神經元構成,終末端作用在脊髓后角及三叉神經脊束神經核尾側亞核。氯胺酮作用于后激活NMDA受體拮抗劑對疼痛信息疼痛傳遞起到負性調控作用從而減緩嗎啡耐受癌痛大鼠模型疼痛閾值及行為[22]。因此,我們推測氯胺酮通過調節脊髓P物質起到疼痛調節過程。同理,緩激肽釋放也受NMDA激活通路影響。因此,我們有理由推測氯胺酮拮抗嗎啡耐受可通過對脊髓P物質及緩激肽釋放調節輔助嗎啡鎮痛作用。本研究實驗結果顯示,C組、K組、M組及K+M組與Control組的緩激肽水平比較,差異均有統計學意義。K+M組和M組比較,緩激肽表達水平表現為明顯下調。相關分析軟件檢測表明K+M組脊髓背角SP平均光密度值顯著低于其余組。以上結果表明,緩激肽和脊髓SP物質可以用來評價嗎啡耐受癌痛大鼠模型鞘內氯胺酮聯合嗎啡的鎮痛效果。
綜上所述,嗎啡耐受癌痛大鼠模型鞘內氯胺酮聯合嗎啡作用可以增強嗎啡抗擊癌痛作用,同時減輕嗎啡引起耐受及戒斷反應,其中,以脊髓P物質及緩激肽水平表達評價其鎮痛效應具有可行性。

