菊苣酸調控p38 MAPK/NF-κB/NLRP3信號通路對缺血性腦卒中大鼠神經元凋亡及炎癥反應的影響
張富慧, 郝靜峰, 張自艷, 王志海, 律 靜
缺血性腦卒中可導致患者肢體殘疾或認知功能障礙,腦缺血會引起神經細胞凋亡,炎癥反應、氧化應激等是缺血性腦卒中的病理損傷機制,減少神經細胞凋亡、抑制炎癥反應對缺血性腦卒中具有保護作用[1,2]。核苷酸結合寡聚化結構域樣受體蛋白3(NLRP3)與神經炎性損傷發生發展密切相關,核因子-κB(NF-κB)是激活NLRP3炎癥小體的重要因子,p38絲裂原活化蛋白激酶(p38 MAPK)可通過NF-κB通路調節炎癥因子表達,介導炎性損傷,p38 MAPK/NF-κB/NLRP3信號通路對炎癥性疾病發揮重要的調控作用[3]。
菊苣酸(chicoric acid,CA)是從菊苣葉中提取的酚類物質,具有抗氧化、抗炎、抗病毒、心肌保護的作用[4]。研究顯示CA可通過抑制p38 MAPK和NF-κB信號通路,改善炎癥誘導的小鼠認知功能障礙,通過調節抗炎抗氧化作用保護神經損傷[5]。CA對缺血性腦卒中的影響及其機制尚不清楚,本研究探索CA對缺血性腦卒中大鼠神經元凋亡、炎癥反應及p38 MAPK/NF-κB/NLRP3信號通路的影響,初步探討其作用機制。
1 材料與方法
1.1 材 料
1.1.1 動物 SPF級健康雄性SD大鼠,6~8周齡,體質量(230±20)g,購自中山大學實驗動物中心,動物生產許可證號:SCXK(粵)2020-0006,大鼠飼養環境為:(23±2)℃,濕度(60±5)%, 12 h明/暗循環,自由飲水進食。本研究經醫院倫理委員會批準。
1.1.2 主要藥物和試劑 CA(原料藥,純度99.95%,批號C7243)購自武漢東康源科技有限公司;p38 MAPK激活劑(Anisomycin)(批號SC0132)購自美國MCE公司;2,3,5-氯化三苯基四氮唑(TTC)染色液(批號T8877)、尼氏(Nissl)染色液(批號SF3627)、TUNEL細胞凋亡檢測試劑盒(批號C1917)、大鼠腫瘤壞死因子-α(TNF-α)(批號KS40173)、白細胞介素(IL)-1β(批號KS41256)、IL-6(批號KS50197)酶聯免疫吸附檢測試劑盒、蛋白裂解液(批號KL10647)均購自上海碧云天生物技術有限公司;兔抗鼠磷酸化p38 MAPK(p-p38 MAPK)(批號9215)、p38 MAPK(批號9212)、磷酸化NF-κB p65(p-NF-κB p65)(批號3039)、NF-κB p65(批號8242)、NLRP3(批號15101)、β-肌動蛋白(β-actin)(批號01247)單克隆抗體、羊抗兔二抗(批號06211)均購自美國CST公司。
1.1.3 主要儀器 組織切片機(型號YD-315)、熒光顯微鏡(型號JS-750T)、凝膠成像系統(型號JS-M6PH)均購自上海玉研科學儀器有限公司;酶標儀(型號SY96A)購自山東方科儀器有限公司。
1.2 方 法
1.2.1 缺血性腦卒中模型制備、分組及給藥 采用改良線栓法[6]制備缺血性腦卒中大鼠模型,操作如下:異氟烷麻醉大鼠,將大鼠固定,沿頸部切開皮膚,分離頸內動脈、頸外動脈和右側頸總動脈;將頸外動脈和頸總動脈結扎,夾閉頸內動脈,將線栓插入頸外動脈直至到達頸內動脈,向內插入約18 mm,固定2 h后抽出線栓,縫合傷口。術后24 h對造模大鼠進行Zea Longa評分,Zea Longa評分1~3分表示造模成功[7]。將造模成功的大鼠隨機分為:模型組、CA組、CA+Anisomycin組,每組12只。另取12只大鼠作為假手術組,假手術組操作同模型組,但不進行線栓操作。CA組大鼠使用10 mg/kg CA腹腔注射給藥[8];CA+Anisomycin組大鼠使用10 mg/kg CA和2 mg/kg Anisomycin[9]腹腔注射給藥;假手術組與模型組腹腔注射等量的生理鹽水;每天1次,連續給藥2 w。
1.2.2 Zea Longa評分與腦梗死體積百分比檢測 Zea Longa評分:給藥周期結束后,各組均未出現大鼠死亡,采用Zea Longa評分法[7]對各組大鼠進行神經功能缺損評分,評分區間為0~4分,得分越高表示神經功能缺損越嚴重。腦梗死體積百分比檢測:斷頭處死大鼠,迅速取出整腦,選擇其中6只大鼠,-20 ℃冰箱冷凍,沿冠狀面切成6片厚度為2 mm的切片,使用2% TTC溶液37 ℃避光染色30 min,正常腦組織顯色紅色,梗死組織為白色,Image Pro Plus 6.0軟件分析并計算腦梗死體積百分比(腦梗死體積百分比=腦梗死體積/整腦體積×100%)。另外6只大鼠的海馬組織于-80℃保存。
1.2.3 Nissl染色檢測大鼠海馬組織神經元損傷 取出凍存的海馬組織,石蠟切片經脫蠟至水,加入Nissl染色液37℃染色10 min,蒸餾水洗滌,95%酒精脫水,二甲苯透明,中性樹膠封片,在顯微鏡下觀察尼氏體。
1.2.4 TUNEL法檢測大鼠海馬組織神經元凋亡 取海馬組織冰凍切片,0.5%聚乙二醇辛基苯基醚通透30 min后,加入TUNEL染色液,避光孵育1 h,DAPI避光孵育5~10 min復染細胞核,熒光顯微鏡觀察海馬組織神經元凋亡,計算神經元細胞凋亡率(神經元細胞凋亡率=凋亡神經元細胞數/總神經元細胞數×100%)。
1.2.5 酶聯免疫吸附法檢測大鼠海馬組織TNF-α、IL-1β和IL-6水平 將海馬組織(組織:生理鹽水=1∶9)在冰浴條件下研磨勻漿,15000 r/min離心10 min,分離上清,酶聯免疫吸附法檢測海馬組織TNF-α、IL-1β、IL-6水平。
1.2.6 蛋白免疫印跡法檢測大鼠海馬組織p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、NLRP3蛋白表達 蛋白裂解液提取各組大鼠海馬組織中總蛋白,蛋白經定量后,取30 μg樣品經電泳、轉膜與封閉,加入兔抗鼠p-p38 MAPK(1∶300)、p38 MAPK(1∶300)、p-NF-κB p65(1∶500)、NF-κB p65(1∶500)、NLRP3(1∶1000)、β-actin(1∶1000)一抗稀釋液,4 ℃孵育過夜,羊抗兔二抗(1∶3000)室溫孵育2 h,放大顯色后,以β-actin為內參,分析各蛋白相對表達。
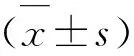
2 結 果
2.1 各組大鼠Zea Longa評分和腦梗死體積百分比比較 與假手術組比較,模型組大鼠Zea Longa評分和腦梗死體積百分比顯著升高(P<0.05);與模型組比較,CA組大鼠Zea Longa評分和腦梗死體積百分比顯著降低(P<0.05);與CA組比較,CA+Anisomycin組大鼠Zea Longa評分和腦梗死體積百分比顯著升高(P<0.05)(見表1、圖1)。
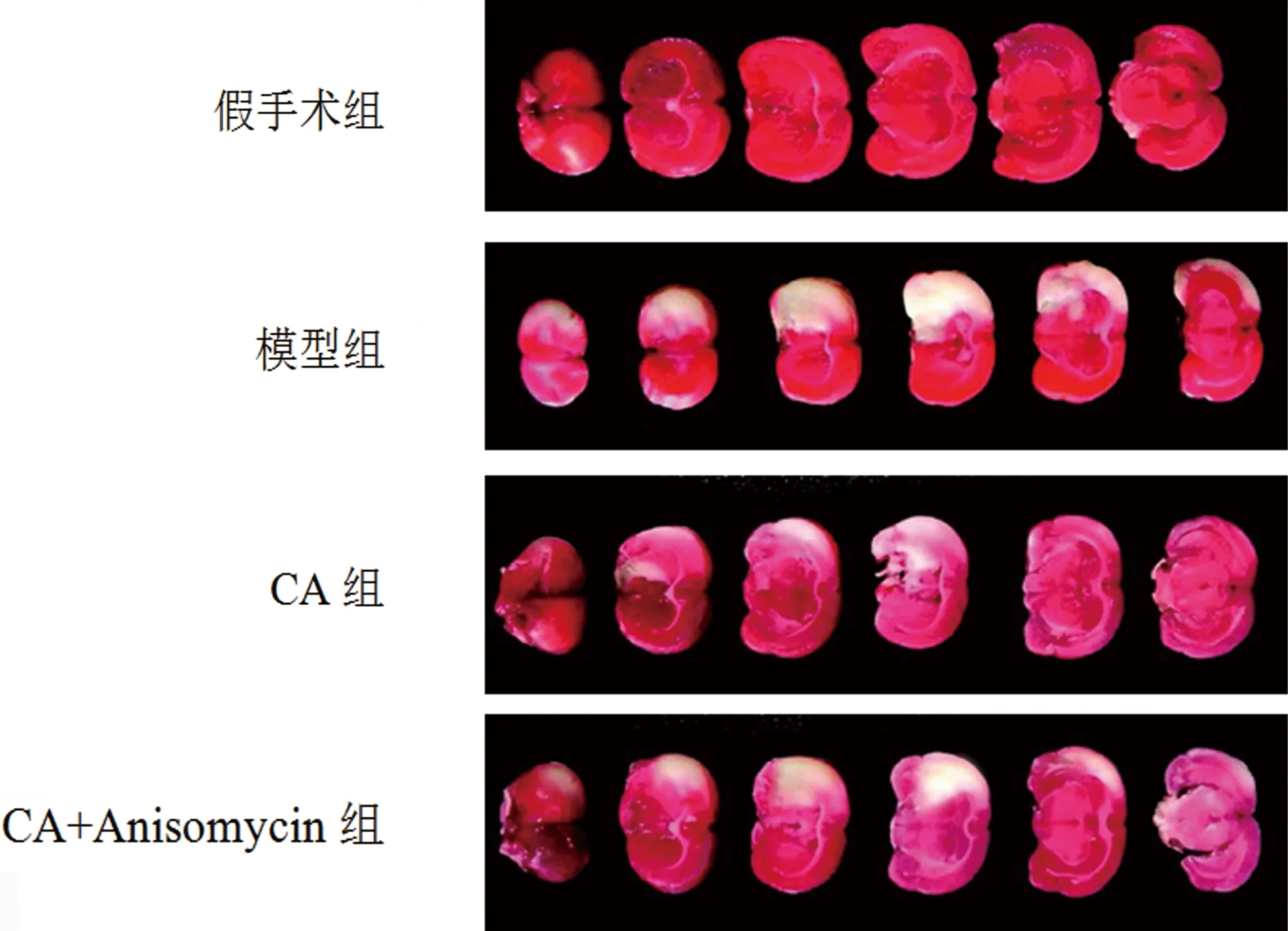
圖1 各組大鼠腦梗死體積觀察(TTC染色)
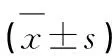
表1 各組大鼠Zea Longa評分和腦梗死體積百分比比較
2.2 各組大鼠海馬組織神經元損傷比較 假手術組大鼠神經元形態規則,結構完整,細胞染色加深,尼氏體數目豐富;模型組大鼠神經元形態不規則、染色較淺,尼氏體數目明顯減少;CA組大鼠神經元形態較模型組明顯改善,形態較飽滿,染色均勻,尼氏體密集;CA+Anisomycin組較CA組神經元損傷嚴重,細胞皺縮,尼氏體數目減少(見圖2)。
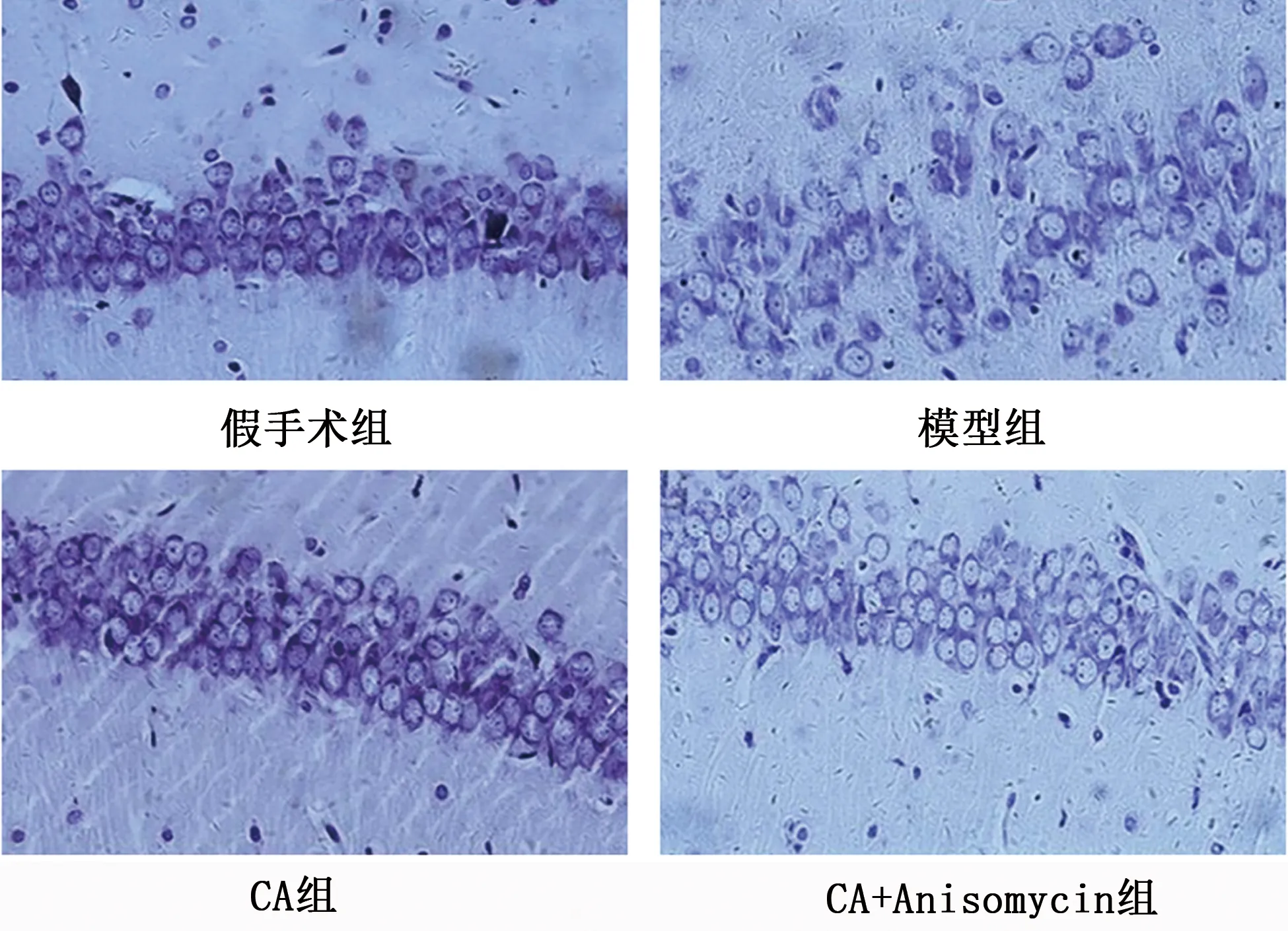
圖2 各組大鼠海馬組織神經元損傷觀察(Nissl染色,×400)
2.3 各組大鼠海馬組織神經元凋亡比較 神經元凋亡顯示為綠色,所有細胞核顯示為藍色,假手術組大鼠幾乎無神經元凋亡。假手術組、模型組、CA組、CA+Anisomycin組大鼠神經元細胞凋亡率分別為(1.83±0.45)%、(34.21±6.33)%、(18.56±3.58)%、(23.59±4.42)%。與假手術組比較,模型組大鼠神經元細胞凋亡率顯著升高(P<0.05);與模型組比較,CA組大鼠神經元細胞凋亡率顯著降低(P<0.05);與CA組比較,CA+Anisomycin組大鼠神經元細胞凋亡率顯著升高(P<0.05)(見圖3)。
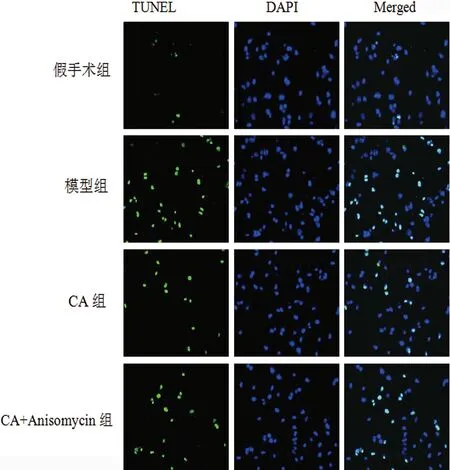
圖3 各組大鼠海馬組織神經元凋亡情況(TUNEL染色,×200)
2.4 各組大鼠海馬組織TNF-α、IL-1β和IL-6水平比較 與假手術組比較,模型組大鼠海馬組織TNF-α、IL-1β和IL-6水平顯著升高(P<0.05);與模型組比較,CA組大鼠海馬組織TNF-α、IL-1β和IL-6水平顯著降低(P<0.05);與CA組比較,CA+Anisomycin組大鼠海馬組織TNF-α、IL-1β和IL-6水平顯著升高(P<0.05)(見表2)。
表2 各組大鼠海馬組織TNF-α、IL-1β和IL-6水平比較
2.5 各組大鼠海馬組織p38 MAPK/NF-κB/NLRP3通路相關蛋白表達水平比較 與假手術組比較,模型組大鼠海馬組織p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表達水平顯著升高(P<0.05);與模型組比較,CA組大鼠海馬組織p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表達水平顯著降低(P<0.05);與CA組比較,CA+Anisomycin組大鼠海馬組織p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表達水平顯著升高(P<0.05)(見表3、圖4)。
表3 各組大鼠海馬組織p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表達水平比較
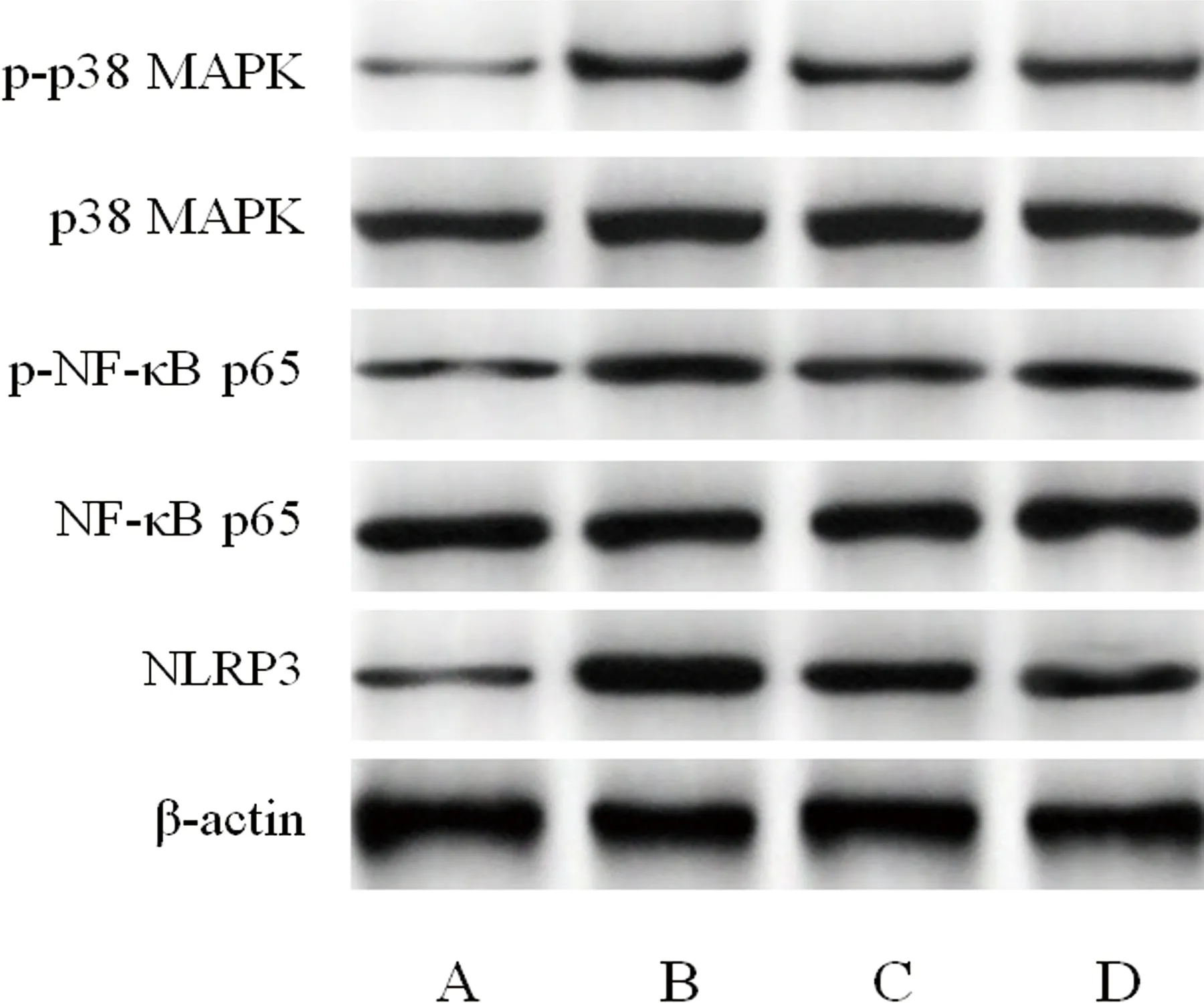
注:A:假手術組;B:模型組;C:CA組;D:CA+Anisomycin組圖4 各組大鼠海馬組織p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、NLRP3蛋白印跡圖
3 討 論
缺血性腦卒中會導致腦組織缺血壞死,引起患者偏癱、失語、記憶力下降等,嚴重影響患者生活質量,缺血缺氧可引起腦組織受損、細胞壞死、神經功能受損、炎癥反應加劇[10]。本研究結果顯示,給予缺血性腦卒中模型大鼠CA治療后,神經功能損傷明顯減輕,腦梗死體積減小,神經元形態較飽滿,染色均勻,尼氏體密集,神經元細胞凋亡率降低,表明CA可減輕缺血性腦卒中大鼠神經功能損傷。
CA是從菊苣和紫錐菊等植物中提取的活性物質,具有抗病毒、抗炎、抗氧化、抑腫瘤、抗衰老、調節糖脂平衡等多種藥理作用[11,12]。高紅藝等[13]研究顯示,CA可上調沉默信息調節因子1(SIRT1)蛋白表達,抑制NF-κB的轉錄活性、海馬氧化應激損傷及炎癥反應,改善膿毒癥相關性腦病小鼠認知功能。另有研究顯示[14],CA可顯著抑制一氧化氮和前列腺素E2的水平及炎癥因子的釋放,減少腦缺血再灌注損傷大鼠的神經功能缺損和梗死體積。以上研究表明[13,14]CA具有神經保護的作用。腦卒中可引起TNF-α、IL-1β和IL-6等多種促炎因子水平升高,lL-1β與腦組織損傷的程度有關,抑制lL-1β的釋放,可顯著減少腦梗死體積[15]。本研究使用CA治療缺血性腦卒中模型大鼠后,大鼠海馬組織TNF-α、IL-1β和IL-6水平顯著降低,與既往報道結果類似[13,14],表明CA通過抑制炎癥反應緩解腦損傷。
NLRP3是炎癥反應的活性核心,缺血性腦卒中發生后,NLRP3轉錄激活,催化IL-1β分泌,加重組織損傷,NF-κB是激活NLRP3炎癥小體的重要因子,CA可抑制NF-κB和NLRP3信號通路的激活[16]。Ding等[17]研究顯示,在脂多糖誘導的小鼠急性肺損傷模型中,CA可顯著抑制MAPK和NLRP3活化,減輕炎癥反應。本研究結果顯示,CA可降低缺血性腦卒中大鼠海馬組織NLRP3的表達水平,與Wang等[16]報道結果一致。p38是MAPK信號通路重要的成員,參與神經元的凋亡,腦部缺血缺氧可引起MAPK信號通路的激活,促進神經元凋亡[18]。NF-κB是p38 MAPK的下游分子,p-p38 MAPK可激活NF-κB,通過調節細胞核凋亡相關基因表達,誘導神經元凋亡;而抑制p38 MAPK通路,可抑制NF-κB的激活,從而減弱TNF-α、IL-1β和IL-6等細胞因子的釋放,減輕腦組織損傷[19]。李依玲等[20]研究表明,CA可抑制NF-κB信號通路的激活,減輕脂多糖誘導的H9C2細胞損傷。本研究在使用CA治療缺血性腦卒中模型大鼠后,大鼠海馬組織p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表達水平顯著降低,提示CA可抑制p38 MAPK/NF-κB/NLRP3通路的激活。本研究結果還顯示,CA改善缺血性腦卒中大鼠腦損傷的作用可被Anisomycin逆轉,推測CA可通過抑制p38 MAPK/NF-κB/NLRP3信號通路來抑制炎癥反應,緩解缺血性腦卒中大鼠腦組織損傷,降低神經元凋亡。
綜上所述,CA可通過抑制p38 MAPK/NF-κB/NLRP3信號通路,抑制炎癥反應,降低神經元凋亡,保護缺血性腦卒中引起的大鼠腦損傷。

