精神分裂癥伴Hp感染患者腸道菌群變化及意義的初步探討*
目前,臨床上關于精神分裂癥的診斷主要采用ICD或DSM診斷系統,同時結合臨床精神量表等進行,精神分裂癥的前驅期主要是對患者的心境、認知、感知覺、行為以及生理功能改變的描述[1]。雖然上述診斷可以對首發精神分裂癥患者有較好的預測效度,但在實際應用中尚有很多不足,有時存在主觀因素的影響。因此從客觀指標了解精神分裂癥的病理機制可能成為新的研究方向。近年來,腸道菌群不僅可調控食物消化能力,維持免疫系統的運作,而且能通過腦-腸-微生物軸影響大腦的活動,已經在動物模型中得到證實,其中孤獨癥有較多的研究[2,3]。但關于精神分裂癥與腸道菌群的相關性研究尚少。幽門螺桿菌(Hp)感染是人體最常見的慢性感染性疾病,研究發現[4],我國Hp的感染率可高達70.0%。為此本研究即探討精神分裂癥伴Hp感染患者腸道菌群變化及意義。
1 對象與方法
1.1 對象 選取2018年2月~2020年2月84例確診為精神分裂癥的患者作為病例研究對象。納入標準:年齡≥18歲;病例精神分裂癥診斷符合美國精神障礙診斷與統計手冊第4版(DSM-Ⅳ)診斷標準[5],病程>2年但目前病情平穩;采用C14呼氣試驗檢測Hp感染情況,結果dpm/mmol CO2<100為陰性,>100為陽性;患者或直系親屬簽署知情同意;臨床資料完整。排除標準:年齡<18歲;妊娠或哺乳期;既往存在腸道功能異常或糖尿病、甲狀腺疾病等影響腸道菌群者;合并其他明確的精神障礙或認知障礙者;合并惡性腫瘤、免疫系統疾病者;近期服用治療Hp感染的抗生素者;臨床資料不完整者。根據是否合并Hp感染將所有入組患者分為Hp感染組50例和非Hp感染組34例,其中Hp感染組男30例,女20例;年齡18~62歲,平均(44.31±5.34)歲。非Hp感染組男20例,女14例;年齡18~63歲,平均(42.52±6.53)歲。同時選擇50名健康人群作為對照組,其中男26名,女24名;年齡18~63歲,平均(43.55±6.76)歲。三組性別、年齡比較差異均無統計學意義(P>0.05)。
1.2 方法
1.2.1 檢測方法 采用高通量測序聯合16S rRNA實時巧光定量PCR法(qPCR)檢測所有受試者腸道菌群差異。基于分類學信息,在門、屬分類水平上進行菌群多樣性的統計分析,其中Alpha多樣性分析包括:Chao1指數、Ace指數、Shannon指數和Simpson指數;Beta多樣性分析主要為weighted unifrac指數。采用酶聯免疫吸附法(ELISA)檢測腸道免疫球蛋白A(IgA)水平,采用NADH速率法檢測谷氨酸合成酶活性。采用直接涂片法直接計算腸道菌群球/桿比。
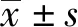
2 結果
2.1 三組腸道菌群多樣性比較 三組Alpha多樣性及Beta多樣性比較差異均無統計學意義(P>0.05)。見表1。
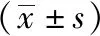
表1 三組腸道菌群多樣性比較
2.2 三組在門水平上的腸道菌群相對豐度比較 三組間放線菌門豐度比較差異有統計學意義(P<0.01)。進一步兩兩結果顯示,Hp感染組放線菌門豐度高于非Hp感染組(Z=-5.691,P=0.000)和對照組(Z=-6.012,P=0.000),非Hp感染組放線菌門豐度高于對照組(Z=-4.259,P=0.000) 。見表2。

表2 三組在門水平上的腸道菌群相對豐度比較[M(Q25,Q75)]
2.3 三組在屬水平上的腸道菌群相對豐度比較 三組間擬桿菌屬、糞桿菌屬、放線菌屬、羅氏菌屬、斯卡多維亞氏菌屬、奇異菌屬、乳桿菌屬、伊格爾茲氏菌屬、莫雷拉菌屬豐度比較差異均有統計學意義(P<0.01)。進一步兩兩比較結果顯示,Hp感染組擬桿菌屬、糞桿菌屬豐度低于非Hp感染組和對照組(P<0.05),而放線菌屬、羅氏菌屬、斯卡多維亞氏菌屬、奇異菌屬、乳桿菌屬、伊格爾茲氏菌屬、莫雷拉菌屬豐度高于非Hp感染組和對照組(P<0.05);非Hp感染組擬桿菌屬、糞桿菌屬豐度低于對照組(P<0.01),而放線菌屬、羅氏菌屬、斯卡多維亞氏菌屬、奇異菌屬、乳桿菌屬、伊格爾茲氏菌屬、莫雷拉菌屬豐度高于對照組(P<0.01)。見表3。

表3 三組在屬水平上的腸道菌群相對豐度比較[M(Q25,Q75)]
2.4 三組腸道粘膜免疫力比較及腸道菌群球/桿比 三組間IgA、谷氨酸合成酶活性及腸道菌群球/桿比比較差異均有統計學意義(P<0.01)。進一步兩兩比較結果顯示,Hp感染組IgA、谷氨酸合成酶活性及腸道菌群球/桿比均高于非Hp感染組和對照組(P<0.01),非Hp感染組IgA、谷氨酸合成酶活性及腸道菌群球/桿比均高于對照組(P<0.01) 。見表4。

表4 三組腸道粘膜免疫力比較及腸道菌群球/桿比[M(Q25,Q75)]
2.5 腸道菌群球/桿比與腸道粘膜免疫力相關性 腸道菌群球/桿比與IgA(r=0.398,P=0.000)、谷氨酸合成酶活性(r=0.445,P=0.000)均呈正相關,IgA與谷氨酸合成酶活性呈正相關(r=0.456,P=0.000) 。
3 討論
精神分裂癥是精神科常見的疾病之一,主要表現為特殊的思維、知覺、情感、行為等多方面的障礙和精神活動與環境的不協調,一般無意識及智能的障礙[6]。精神分裂癥不僅給患者帶來沉重的精神壓力,也會給其家庭帶來沉重的經濟負擔。目前精神分裂癥的病因尚不清晰,因此仍需從多方面對精神分裂癥病因進行探索。近年來研究發現腸道菌群組成及數量的改變會直接影響機體的免疫系統和中樞神經系統,進而可以對認知和行為等方面產生不同程度的影響[7,8];此外有研究發現機體免疫系統功能紊亂可促進精神分裂癥的發生、發展,因此可以認為腸道菌群與精神分裂癥存在密切關系[9,10]。目前腸道菌群和精神分裂癥之間的聯系機制未被闡明,但有研究認為腸道菌群可以通過腸-腦軸來與大腦進行雙向交流[11],而腸-腦軸主要是由激活迷走神經、影響人體免疫系統、調節神經內分泌系統及產生神經遞質等通路構成的,因此腸-腦軸作為一個雙向的神經體液傳播系統,其功能障礙可能會產生精神行為異常等后果[12,13]。Hp感染是機體最常見的腸道感染,其感染后會引起腸道PH值及腸道其他菌群的變化[14]。本研究對精神分裂癥伴Hp感染患者腸道菌群變化進行分析。
本研究發現精神分裂癥及健康人群腸道優勢菌群均為厚壁菌門、擬桿菌門、梭菌門、變形菌門、放線菌門;但門水平上精神分裂癥患者放線菌門豐度明顯升高,且合并Hp感染后升高更明顯。分析認為Hp是一種微厭氧菌,雖然存在于多數人的腸道菌群中,但其仍是一種致病菌,已被證實與消化系統潰瘍及腫瘤等密切相關。因此提示精神分裂癥合并Hp感染可能是精神分裂癥發生、發展的促進因素。本研究屬水平研究發現,Hp感染組擬桿菌屬、糞桿菌屬豐度低于非Hp感染組和對照組,且非Hp感染組擬桿菌屬、糞桿菌屬豐度低于對照組。分析認為擬桿菌屬、糞桿菌屬是典型的益生菌,且可以參與人體短鏈脂肪酸的代謝[15],而短鏈脂肪酸是腸上皮細胞能量的主要來源[16],因此擬桿菌屬、糞桿菌屬豐度降低可能會導致腸上皮細胞通透性改變進而影響人體各項生理功能。
本研究發現Hp感染組IgA、谷氨酸合成酶活性及腸道菌群球/桿比均高于非Hp感染組和對照組,非Hp感染組IgA、谷氨酸合成酶活性及腸道菌群球/桿比均高于對照組;此外本研究發現腸道菌群球/桿比與IgA、谷氨酸合成酶活性均呈正相關;且IgA與谷氨酸合成酶活性亦呈正相關。分析認為IgA是腸道黏膜表面的第一道免疫防線,主要由腸黏膜中的IgA漿細胞分泌,其受神經、內分泌和免疫系統的調節,發揮抑制腸道內的細菌黏附腸道黏膜表面,中和腸道內的毒素、酶和病毒的作用[17]。當Hp感染后腸道免疫屏障功能隨之降低,腸道IgA為保護腸道粘膜而分泌增加,進一步抑制致病菌而影響腸道菌群球/桿比。研究認為[18,19],谷氨酸作為神經遞質,參與了神經突觸可塑性形成及學習記憶過程,而與其相關的神經振蕩異常參與了精神分裂癥的發生過程。谷氨酸的合成需要谷氨酸合成酶在激活狀態催化氨基谷氨酰胺轉移到α-酮戊二酸上,因此谷氨酸合成酶活性的增加可以直接導致谷氨酸的增加[20,21],進而參與精神分裂癥的發生、發展過程。而Hp感染后可進一步降低腸道免疫力進而影響腸道谷氨酸的代謝功能,推測其可能就是通過增加了谷氨酸合成酶的活性,隨著谷氨酸的增加,腸道PH值改變,進而可影響腸道免疫功能及其他菌群數量的變化。
綜上所述,本研究顯示,精神分裂癥伴Hp感染后可進一步加重腸道菌群失調,通過影響腸道免疫功能及神經遞質可能增加精神分裂癥風險。本研究存在一定不足:首先本研究樣本量較小,且未考慮飲食習慣、 生活方式等對腸道菌群的影響;其次本研究中的患者在入組時已經服用抗精神病藥物,無法分析患者用藥前后腸道菌群變化情況,不能明確抗精神病藥物對腸道菌群有何影響,因此需進一步擴大樣本驗證。

