柴達木大肥菇發酵過程中酚酸抗氧化活性變化
鄧瑩瑩,焦迎春,蔣濤
(青海大學農牧學院,青海 西寧 810016)
柴達木大肥菇[Agaricus bitorquis(Quél.)Sacc.]不僅富含脂肪、氨基酸、蛋白質、礦物質、膳食纖維等營養成分[1],而且含有酚酸、三萜及多糖等活性物質[2],具有極高的開發價值。酚酸類化合物是指苯環上的氫原子被酚性羥基取代的一類化合物[3],存在多種形式,主要以化學鍵與其他物質相結合,極少為游離態。酚酸作為一種重要的天然酚類化合物,不僅是人類從自然界直接攝入的重要酚類物質,還是多酚重要的體內代謝物,具有抗炎、抗病毒、抗癌、抗氧化[4]等生物活性,可抑制肥胖、提高免疫力、改善情緒等。目前對于柴達木大肥菇研究多集中于柴達木大肥菇的生物學特性和馴化[5]菌絲體、子實體的成分分析[1]及多糖酚酸提取工藝優化[4,6],對其酚酸類活性成分缺乏較深入的研究[2]。
生物機體內的氧自由基經過不飽和脂肪酸的過氧化可引起細胞受到損傷,進而引起細胞新陳代謝和生理反應無法正常進行,使機體加速衰老。若機體內氧化和抗氧化反應失衡則容易引起氧化應激現象,這是一種負面效應,嚴重時會加快機體衰老和各種疾病的產生,人體內的自由基多數為活性氧自由基(reactive oxygen species,ROS),包括含氧自由基、超氧陰離子自由基和過氧化物。活性氧的生成伴隨生物的正常代謝過程,但過量的活性氧會對細胞造成氧化損傷,危害人體健康[7],因此,開發出具有低副作用天然無毒的抗氧化劑十分重要。抗氧化活性是酚酸最常見生物活性之一,酚酸以清除ROS為基礎實現抗氧化活性[8],決定抗氧化活性的主要因素是酚羥基數目及其在化學結構中的位置。柴達木大肥菇在發酵過程中,可以分泌出大量酚酸,存在于發酵液和菌絲體中,分別對其提取即得胞外酚酸和胞內酚酸。陳雅楠等[4]研究發現柴達木大肥菇胞內酚酸具有較強的抗氧化活性。Leonard等[9]發現發酵通常會增加酚酸含量及其抗氧化活性;孟歌等[10]發現藥食用真菌靈芝的自身生長情況、次級代謝產物分泌及還原能力等因素直接影響其抗氧化能力,表明大型食用真菌在液態發酵過程會提高其分泌出酚酸的含量,影響其抗氧化能力。因此,柴達木大肥菇做為食用真菌發酵過程中產生的酚酸也應具有類似的抗氧化活性。
綜上所述,以柴達木大肥菇為研究對象,采用液體發酵的方法,測定發酵過程中的生物量、酚酸含量和酚酸的5種抗氧化指標,探究柴達木大肥菇在發酵過程中的抗氧化活性變化以及胞內、胞外酚酸抗氧化活性的差異,為柴達木大肥菇酚酸中抗氧化功能因子的開發利用奠定理論基礎。
1 材料與方法
1.1 材料與試劑
柴達木大肥菇菌種:青海大學農牧學院食品工程實驗室提供;三氯化鐵、鐵氰化鉀、麥芽糖、果糖、蛋白胨、硫酸鎂、氯化鈣、無水乙醇、戊二醛(均為分析純):湖北永闊科技有限公司。
1.2 儀器與設備
鼓風干燥箱(ZXRD-B5110):上海智城分析儀器制造有限公司;數控超聲波清洗儀(KQ5200DE):昆山市超聲儀器有限公司;紫外可見分光光度計(UV-1780):日本島津儀器有限公司;臺式高速離心機(H/T16MM):湖南赫西儀器裝備有限公司;恒溫振蕩培養箱(BS-1EA):常州國華電器有限公司;掃描電鏡(EVO 18):北京歐波同光學技術有限公司。
1.3 方法
1.3.1 液體種子培養
無菌條件下,從斜面培養基中取出黃豆大小的菌塊,接入250 mL的三角瓶中,于25℃、100 r/min恒溫振蕩培養箱中培養,直到出現細小均勻的菌絲球且菌液澄清透明為最佳[11]。
1.3.2 液體發酵培養
在無菌條件下,以體積分數10%的接種量接入250 mL錐形瓶中,置于25℃、100 r/min恒溫振蕩培養箱中培養[11]。
1.3.3 柴達木大肥菇除糖工藝
菌絲體除糖:菌絲體與蒸餾水以1∶20(g/mL)放入燒杯,70℃、45 Hz超聲20 min后提取抽濾。
發酵液除糖:發酵液和無水乙醇以體積比1∶4放入燒杯,40℃、45 Hz超聲30 min后提取多糖,將上清液濃縮至原體積,即為胞外酚酸[4]。
1.3.4 柴達木大肥菇胞內酚酸的提取
將除糖后的菌絲體與90%乙醇以1∶20(g/mL)料液比放入燒杯,60℃、45 Hz超聲30 min后提取抽濾,濾液即為胞內酚酸。
1.3.5 菌絲體生物量的測定
根據參考文獻[12]測定菌絲體干重(g)。菌絲體生物量計算公式如下。
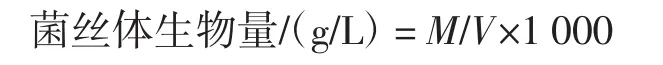
式中:M為菌絲體干重,g;V為發酵液總體積,mL。
1.3.6 菌絲體掃描電鏡觀察
將培養1 d~6 d的柴達木大肥菇菌絲體于2.5%戊二醛溶液中避光固定12 h。用0.1 mol/L磷酸鹽緩沖液沖洗2次,然后分別用30%、50%、70%、80%、90%和100%的乙醇溶液脫水2次[13]。
1.3.7 酚酸含量測定
制備沒食子酸對照品溶液,分別取 0.1、0.2、0.4、0.6、0.8 mL沒食子酸對照品溶液置于25.0 mL的容量瓶中,加入1.0 mL的無水乙醇、0.3% C12H25SO4Na溶液、0.6% FeCl3溶液和 0.9 mL 0.9% K3[Fe(CN)6]溶液,并用0.1 mol/L鹽酸溶液定容,靜置20 min,測定720 nm處的吸光度[4],得到標準曲線方程:y=1.267 8x-0.021 5,R2=0.996 4;確定酚酸的稀釋倍數,根據上述方法測得相應的吸光度后計算相應的胞內、胞外酚酸濃度。
1.3.8 抗氧化指標測定
1.3.8.1 超氧陰離子自由基清除能力測定
根據參考文獻[14]的方法測定超氧陰離子自由基清除能力。清除率計算公式如下。

式中:△A空白為用無水乙醇代替樣品的反應體系的吸光度;△A樣品為添加樣品的反應體系的吸光度;△A對照為以超純水代替鄰苯三酚的反應體系的吸光度。
1.3.8.2 鐵離子還原能力的測定
根據參考文獻[15]的方法測定鐵離子還原能力。
1.3.8.3 羥自由基清除能力測定
根據參考文獻[10]的方法測定羥自由基清除能力。清除率計算公式如下。
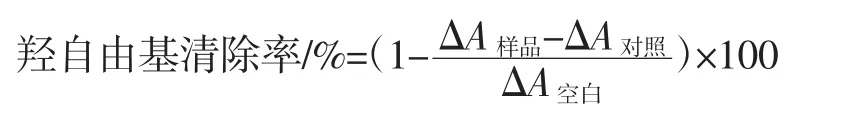
式中:△A空白為無水乙醇代替樣品的反應體系的吸光度;△A樣品為添加樣品的反應體系的吸光度;△A對照為以蒸餾水替代H2O2的反應體系的吸光度。
1.3.8.4 2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽陽離子 [2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate)cation,ABTS+]自由基清除能力測定
根據參考文獻[10]的方法測定ABTS+自由基清除能力。清除率計算公式如下。
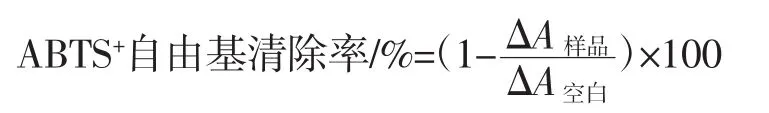
式中:△A樣品為添加樣品后溶液的吸光度;△A空白為未添加樣品后溶液的吸光度。
1.3.8.5 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力測定
根據參考文獻[16]的方法測定DPPH自由基清除能力。清除率計算公式如下。

式中:△A空白為無水乙醇替代樣品的反應體系的吸光度;△A樣品為添加樣品后溶液的吸光度;△A對照為無水乙醇替代DPPH的反應體系的吸光度。
1.4 數據分析
所有試驗數據用IBM SPSS Statistics 20分析顯著性,用Origin 2018做圖,顯著水平設定為P=0.05,差異極顯著水平設為P=0.01,相同小寫字母表示差異不顯著(P>0.05),不同小寫字母表示差異顯著(P<0.05)。
2 結果與分析
2.1 柴達木大肥菇發酵過程中菌絲體生物量變化
發酵過程中菌絲體生物量的變化見圖1。發酵過程中菌絲細胞的形態變化見圖2。
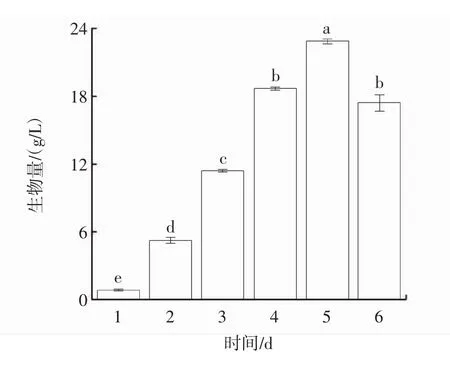
圖1 發酵過程中菌絲體生物量的變化Fig.1 Variation curve of hyphae biomass
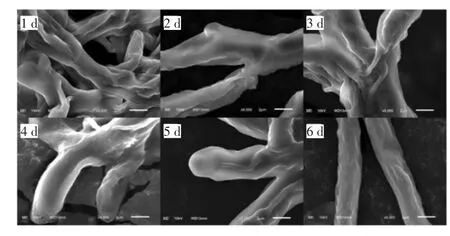
圖2 發酵過程中菌絲細胞的形態變化(掃描電鏡8 000×)Fig.2 Morphological changes of mycelium cells during fermentation(SEM 8 000×)
由圖1可知,在培養的6 d內,菌絲體生物量呈先上升后下降的趨勢,并在第5天達到峰值(22.91±0.21)g/L,較第1天提升了25.08倍。由圖2可知,在發酵過程中,柴達木大肥菇菌絲球直徑隨著時間的延長呈先上升后趨于平穩的趨勢。與雞腿菇菌絲體生物量的試驗結果趨勢[17]類似,但由于真菌種類的差異,生物量達到峰值的時間不一致,隨著發酵進程延續發酵液體系中溶解氧含量持續降低,菌體爭奪養分、生長空間受限,菌體產量開始下降。
由圖2可知,柴達木大肥菇在液體發酵過程中主要以圓球形態存在。在發酵初期,菌球較小,邊緣為絨毛狀,發酵液澄清透明,呈淡黃色,隨著發酵的進行,菌球逐漸變大,菌絲逐漸變粗,并出現分支,發酵液逐漸渾濁、黏稠,6 d時,菌絲體老化,菌絲變細。可能是由于發酵后期時發酵液中營養物質減少,菌絲開始自溶。
2.2 柴達木大肥菇酚酸含量變化
胞內、胞外酚酸含量變化見圖3。

圖3 胞內、胞外酚酸含量變化Fig.3 Changes of intracellular and extracellular phenolic acid content
由圖3可知,胞外酚酸含量始終高于胞內酚酸。在發酵過程中,胞內、胞外酚酸含量隨著時間的延長呈先上升后平緩的趨勢,并于第7天達到峰值,分別(6.73±0.05)、(10.11±0.05)g/L,較發酵第1天分別提高了 17.91倍、4.56倍,差異顯著(P<0.05)。發酵前期菌絲體需一定的時間適應新的液體環境,故產生的酚酸較少。進入對數生長期后,菌絲體顯著增長,酚酸含量開始增多,一直持續到穩定期,由于營養物質有限,從而導致酚酸含量增加速度變緩,最終趨于平穩。綜上所述,選擇發酵時間6 d作為一個發酵周期,完成對柴達木大肥菇發酵。
2.3 柴達木大肥菇發酵過程中胞內、外酚酸抗氧化活性變化
2.3.1 發酵過程中超氧陰離子自由基清除率變化
超氧陰離子自由基清除率變化見圖4。
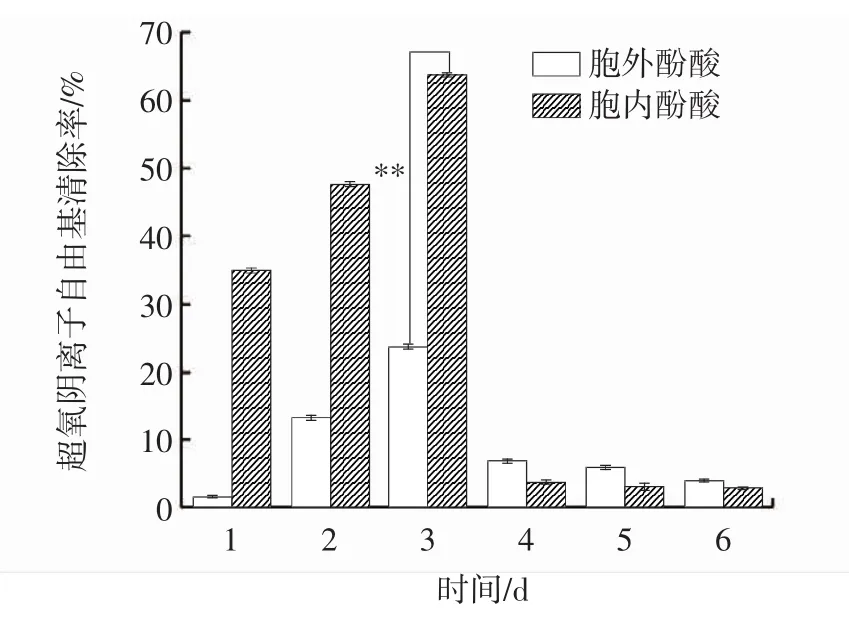
圖4 發酵過程中胞內、胞外超氧陰離子自由基清除能力變化Fig.4 Changes of intracellular and extracellular superoxide anion scavenging ability during fermentation
超氧陰離子自由基(·O2-)是基態氧接受一個電子后形成的第一個氧自由基,可以轉化為其他自由基如單線態氧、H2O2和羥自由基,其氧化能力很強,對組織產生氧化損傷而引發各種疾病[18]。因此,常用樣品對超氧陰離子自由基清除能力來反映其抗氧化活性。由圖4可知,1 d~3 d時胞內酚酸超氧陰離子自由基清除能力強于胞外酚酸,4 d~6 d時胞外酚酸超氧陰離子自由基清除能力強于胞內酚酸。在發酵過程中,胞內、胞外酚酸超氧陰離子自由基清除率隨著時間的延長呈先升高后下降最后趨于平穩的趨勢,并于第3天達到最大值,分別為 63.90%、23.95%,差異極顯著(P<0.01),較發酵第1天分別提高了1.82倍、13.09倍。與桑黃液體培養中超氧陰離子自由基清除能力趨勢類似[19]。
2.3.2 發酵過程中鐵離子還原能力變化
發酵過程中胞內、胞外酚酸鐵離子還原能力變化見圖5。
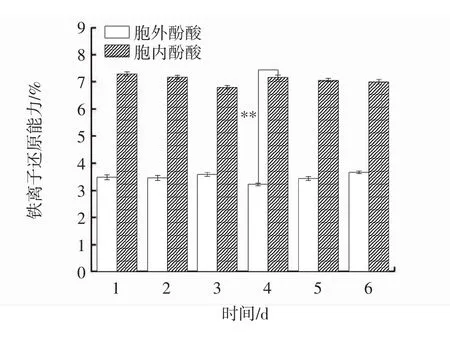
圖5 發酵過程中胞內、胞外酚酸鐵離子還原能力變化Fig.5 Changes of intracellular and extracellular phenolic acid iron ion reduction ability during fermentation
鐵離子還原能力的測定,實質上是檢驗樣品電子供應能力的過程。鐵離子還原能力可以參與多種抗氧化反應,可以破壞自由基鏈式反應和過氧化物的降解,鐵離子還原能力可用來評價樣品總的抗氧化活性,且鐵離子還原能力越強,酚酸抗氧化能力就越強[20]。由圖5可知,胞內酚酸鐵離子還原能力始終強于胞外酚酸,并在第4天達到最大差值,為3.93%,在第4天達到峰值,差異極顯著(P<0.01)。在發酵過程中,胞內、胞外酚酸鐵離子還原能力變化穩定,分別為7.08%、3.49%。與樺褐孔菌液體發酵培養的1 d~6 d胞內外多酚鐵離子還原能力變化趨勢一致[21]。
2.3.3 發酵過程中羥自由基清除率變化
發酵過程中胞內、外酚酸羥自由基清除能力變化見圖6。
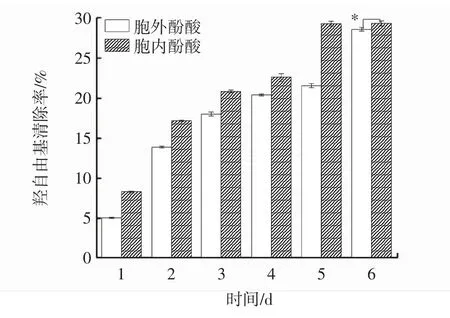
圖6 發酵過程中胞內、胞外酚酸羥自由基清除能力變化Fig.6 Changes of intracellular and extracellular scavenging ability of phenolic acid hydroxyl radical during fermentation
羥自由基是一種活性氧,可以破壞細胞膜與蛋白質等生物分子發生反應,造成組織破壞和細胞死亡,這也是引起衰老和其他疾病的重要因素[22]。因此,可用羥自由基的清除能力評價樣品的抗氧化能力。由圖6可知,胞內酚酸羥自由基清除能力始終強于胞外酚酸。在發酵過程中,胞內、胞外酚酸羥自由基清除率隨著時間的延長呈上升趨勢,并于第6天達到峰值,分別為 29.35%、28.61%,差異顯著(P<0.05),較發酵第 1天分別提高了2.52倍、4.61倍。與靈芝液體培養2 d~6 d的羥自由基清除能力變化趨勢類似[10]。
2.3.4 發酵過程中ABTS+自由基清除率變化
發酵過程中胞內、胞外酚酸ABTS+自由基清除能力變化見圖7。
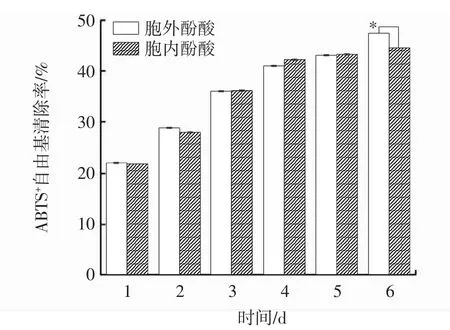
圖7 發酵過程中胞內、胞外酚酸ABTS+自由基清除能力變化Fig.7 Changes of intracellular and extracellular ABTS+scavenging ability during fermentation
ABTS是一種水溶性的自由基引發劑,在清除ABTS+自由基反應中,抗氧化劑通過抑制藍綠色的ABTS+自由基的產生來評價抗氧化性。當遇到具有抗氧化活性的物質時,ABTS+自由基會被還原,溶液顏色變淺,吸光值降低;吸光值越小,說明自由基清除劑的清除能力越強,以此可評價物質的抗氧化活性[23]。由圖7可知,胞內、胞外酚酸ABTS+自由基清除能力基本相同。在發酵過程中,胞內、胞外酚酸的ABTS+自由基清除率隨著時間的延長呈上升趨勢,并于第6天達到峰值,分別為 44.52%、47.32%,差異顯著(P<0.05),較發酵第1天分別提高了1.03倍、1.14倍。與桑黃液體發酵培養2d~6d過程中ABTS+自由基清除能力趨勢一致[19]。
2.3.5 發酵過程中DPPH自由基清除率變化
發酵過程中胞內、胞外酚酸DPPH自由基清除能力變化見圖8。
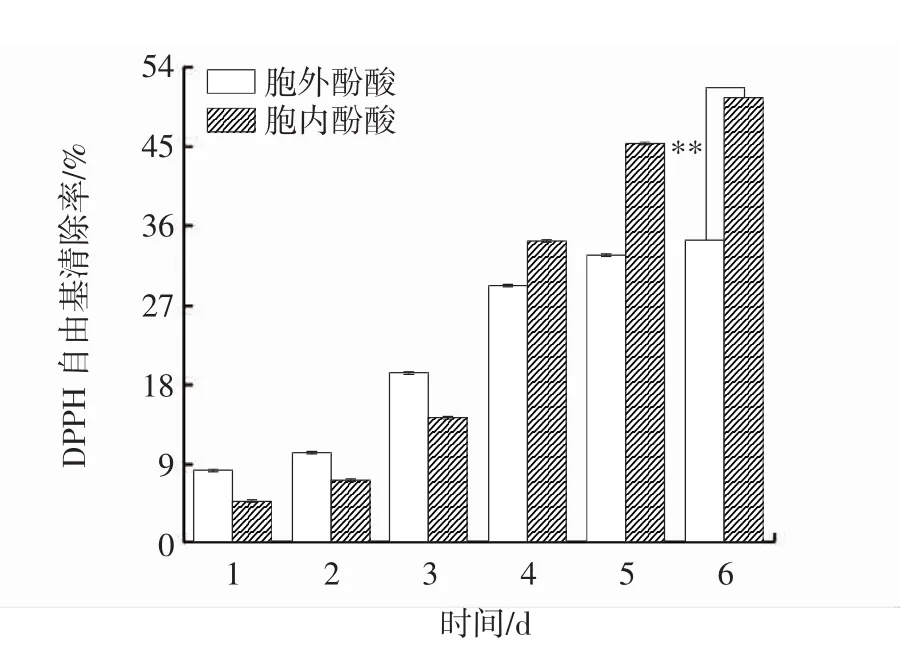
圖8 發酵過程中胞內、胞外酚酸DPPH自由基清除能力變化Fig.8 Changes of DPPH scavenging capacity of intracellular and extracellular phenolic acids during fermentation
DPPH是一種穩定的順磁化合物,若自由基清除劑存在時,則DPPH接受一個電子或氫原子,單電子被配對而形成穩定的DPPH-H化合物,使其乙醇溶液從深紫色變為黃色,變色程度與配對電子數(自由基清除活性)成正比[24]。因此通過DPPH的清除率可反映出酚酸的抗氧化活性。由圖8可知,在發酵前期,胞外酚酸DPPH自由基清除能力大于胞內酚酸,在發酵后期,情況相反。在發酵過程中,胞內、胞外酚酸DPPH自由基清除能力隨著時間的延長呈上升趨勢,并于第6天達到峰值,分別為50.54%、34.39%,差異極顯著(P<0.01),較發酵第1天分別提高了10.52倍、3.17倍。與櫟生桑黃液體發酵過程中DPPH自由基清除能力變化趨勢一致[25]。
3 結論
本文以發酵過程中的柴達木大肥菇為研究對象,利用超聲波輔助法提取胞內、胞外酚酸,采用ABTS+自由基、DPPH自由基、羥自由基、超氧陰離子自由基清除能力及鐵離子還原能力5個抗氧化體系,綜合分析柴達木大肥菇在發酵過程中胞內、胞外酚酸抗氧化活性變化。結果顯示:在發酵過程中菌絲體生物量呈現先上升后下降的趨勢,在第5天時菌絲體生物量達到最大,較第1天提升25.08倍;酚酸含量變化呈現先上升后趨于平穩的趨勢,胞外酚酸含量高于胞內酚酸含量,在發酵后胞外酚酸含量提升了4.56倍,胞內酚酸含量提升了17.91倍;柴達木大肥菇發酵過程中胞內、胞外酚酸具有良好的抗氧化活性,且胞內酚酸的抗氧化能力高于胞外酚酸的抗氧化能力。所得柴達木大肥菇胞內酚酸對ABTS+自由基、DPPH自由基、超氧陰離子自由基、羥自由基的最高清除率及最高鐵離子還原能力分別為44.52%、50.54%、63.90%、29.35%、7.17%,分別是最低值的2.03倍、11.52倍、20.61倍、3.52倍、1.05倍,胞外酚酸對4種自由基的最高清除率及鐵離子還原能力分別為47.32%、34.39%、23.95%、28.61%、3.67%,分別是最低值的2.14倍、4.17倍、14.09倍、5.61倍、1.13倍。柴達木大肥菇發酵過程中胞內、胞外酚酸體現了良好的抗氧化能力,可以作為天然抗氧化劑進一步開發利用。

