牛FoxO1基因啟動子轉錄調控分析
趙毅昂 魏大為,2* 張久盤 宋雅萍 姜 超 王興平,2 羅仍卓么,2 馬 云,2
(1.寧夏大學 農學院,銀川 750021; 2.寧夏大學 寧夏反芻動物分子細胞育種重點實驗室,銀川 750021; 3.寧夏農林科學院 動物科學研究所,銀川 750021)
牛肉因其具有營養豐富、低脂肪高蛋白等特點而深受人們所喜愛。近些年來我國牛肉產量穩步提升,但仍然供不應求,存在巨大缺口。骨骼肌作為肉牛的重要的組成部分,其生長發育及與個體產肉能力和肉品質密不可分。此外,肌內脂肪(Intramuscular fat,IMF)含量與牛肉的嫩度和風味密切相關。影響骨骼肌和脂肪生成的因素有很多,大量研究發現營養、環境和遺傳等是調控動物骨骼肌和脂肪生成的主要因素,但更多取決于基因調控。因此,篩選并鑒定調節骨骼肌與脂肪生長發育的功能基因對肉牛產肉力和肉質的改良有重要意義。
本研究前期通過全基因組關聯分析(Genome-wide association study,GWAS)秦川牛的生長性狀,篩選發現FoxO1
基因與秦川牛個體體重和體高關聯密切,且Sun等研究發現叉頭框轉錄因子1(Forkhead box,FoxO1)的多態性與秦川牛的體長顯著相關。通過進一步對FoxO1
深入挖掘發現,FoxO1
作為Fox
家族17個亞群中的成員之一,受胰島素磷脂酰肌醇-3激酶PI3K/Akt信號通路的負反饋調節,參與機體多種器細胞代謝、自噬以及DNA損傷修復等過程,在機體胰島β細胞分化和氧化應激中也扮演著重要角色。除以上功能外,大量研究發現FoxO1
基因在動物骨骼肌發育和脂肪的生成中也發揮著重要作用。如Yang等研究發現FoxO1
的表達量和豬Ⅰ型肌纖維的含量成反比;Kamei等報道,FoxO1
基因參與骨骼肌的發育和Ⅰ型纖維正常發生,敲除FoxO1
基因的小鼠骨骼肌功能受損,全身肌肉發育不全。另一方面,FoxO1
在脂肪組織中大量表達,并參與其分化過程。研究發現,FoxO1
可以抑制脂肪生成和儲存的主要調節因子PPARγ(Peroxisome proliferator-activated receptor γ),進而調控脂肪;此外,FoxO1
可通過誘導脂肪細胞中脂肪甘油三酯脂肪酶(ATGL)和溶酶體脂肪酶(LIPA)來調節脂質分解代謝。這些研究均表明FoxO1
基因在動物生長發育過程中十分重要,并有可能在牛的脂肪和肌肉中扮演著重要角色,因此,探究其在牛上的調控機制及基因功能尤為重要。啟動子作為關鍵的轉錄元件,對轉錄因子結合進而調控基因的表達水平起到決定性作用。對FoxO1
基因啟動子的探究,是揭示其調控骨骼肌和脂肪形成過程中轉錄調控機制的重要手段。同一基因啟動子在不同物種間的核心區和轉錄因子結合均有差異,且目前尚未發現牛FoxO1
基因啟動子轉錄調控機制的報道,因此,本研究以秦川牛血液基因組DNA為模板,擴增了FoxO1
基因啟動子和7個逐段缺失的啟動子片段,并構建雙熒光素報告載體,將其轉染至C2C12和3T3-L1細胞系,通過酶活檢測來確定FoxO1
基因的啟動子核心區域,進一步通過在線網站預測影響牛FoxO1
基因的關鍵轉錄因子,并通過定點突變技術確定核心區的關鍵轉錄因子,初步探究了牛FoxO1
啟動子的轉錄調控作用,為研究FoxO1
基因對牛肌肉脂肪發育過程的調控作用奠定了理論基礎。1 材料與方法
1.1 材料和試劑
采集24月齡秦川牛血液樣本;PrimeScriptTM RT Reagent Kit with gDNA Eraser(Perfect Real Time)反轉錄試劑盒、總RNA提取試劑盒、總DNA提取試劑盒、T4DNA連接酶、高保真PCR擴增酶GXL、限制性內切酶QuickCutKpn
I和QuickCutHind
Ⅲ和大腸桿菌DH5α感受態細胞均購自TaKaRa公司;Lipofectamine 3000 Reagent轉染試劑盒購自Invitrogen公司;pGL3-Basic 質粒、去內毒素質粒提取試劑盒、DNA膠快速回收試劑盒、雙熒光素酶基因內參pRL-TK載體和Dual-Luciferase Reporter Assay System 雙熒光素酶報告系統試劑盒購自Promega公司;Fast MultiSite Mutagenesis System定點突變試劑盒購自Transgen Biotech公司;OPTI-MEM培養基和胎牛血清(Fetal bovine serum,FBS)購自Gibco公司;DMEM培養基購自Hyclone公司。1.2 試驗方法
1
.2
.1
牛FoxO1
基因結構及蛋白序列分析根據NCBI數據庫(https:∥www.ncbi.nlm.nih.gov)中已公布的海福特牛FoxO1
基因的序列信息和轉錄起始位點,利用Ensembl(https:∥asia.ensembl.org/index.html)在線工具初步預測牛FoxO1
基因的啟動子位置;根據GenBank數據庫中已公布的牛、綿羊、山羊等物種FoxO1
基因的蛋白質序列信息,利用ProtPram 在線程序(https:∥web.expasy.org/protparam/)分析蛋白質的理化性質;使用Mega 5.0軟件構建不同物種FoxO1蛋白質系統進化樹。1
.2
.2
牛FoxO1
基因啟動子克隆提取秦川牛血液基因組DNA,于4 ℃冰箱保存備用。參照GenBank數據庫中已公布的牛FoxO1
基因序列,針對其啟動子區域使用Primer 5.0軟件設計引物FoxO1
-PF和FoxO1
-PR(表1),以血液基因組DNA為模板,使用Takara公司的GXL高保真酶擴增牛FoxO1
基因的啟動子區(位置:-1 722/+198)。PCR 反應總體系為:上、下游引物(10 μmol/L) 各2 μL;2×PrimeSTAR GXL Buffer 25 μL;PrimeSTAR GXL DNA Polymerase 2 μL;模板50 ng;ddHO補齊至50 μL。反應條件:98 ℃ 5 min;98 ℃ 10 s,60 ℃ 15 s,68 ℃ 20 s,30個循環。使用1%瓊脂糖凝膠電泳對擴增產物進行檢測,對檢測正確的目的條帶進行切膠回收純化,使用T4DNA連接酶將其連接于PMD19-T(Simple)載體后將其轉化到大腸桿菌DH5α感受態細胞中,12 h后進行單克隆篩選后測序。1
.2
.3
牛FoxO1
基因啟動子逐段缺失片段的克隆通過Primer premier 5.0軟件設計7條用于啟動子遞減缺失片段擴增的上游引物FoxO1
-P1~FoxO1
-P7和1條固定的下游引物FoxO1-R(引物信息見表1,斜體堿基為上、下游引物5′端分別添加的Kpn
I、Hind
Ⅲ雙酶切位點),來鑒定牛FoxO1
基因啟動子的核心區域。使用在上一步獲得的測序正確的牛FoxO1
基因啟動子片段為模板進行啟動子遞減缺失片段的PCR擴增(擴增條件及體系同上),擴增片段測序鑒定正確后可用于下一步試驗。1
.2
.4
雙熒光素酶報告載體的構建使用限制性內切酶Kpn
Ⅰ和Hind
Ⅲ于37 ℃條件下分別雙酶切7個牛FoxO1
基因逐段缺失啟動子片段和pGL3-Basic載體2 h,用T4 DNA連接酶將雙酶切后的載體和7個啟動子片段在16 ℃金屬浴恒溫儀上逐一連接后于大腸桿菌DH5α感受態細胞中進行轉化,12 h后挑選陽性單克隆菌落擴繁,小提質粒后通過雙酶切鑒定。將鑒定正確的菌液大量擴繁后使用去內毒素試劑盒提取質粒,測定純度和質量濃度。將重組質粒分別命名為:pFoxO1-1 722/+198、pFoxO1-1 330/+198、pFoxO1-1 004/+198、pFoxO1-717/+198、pFoxO1-471/+198、pFoxO1-285/+198和pFoxO1-27/+198。表1 牛基因啟動子及其遞減缺失片段克隆引物
Table 1 Primers were used in promoter and diminishing deletion fragment cloning of gene
用途Usage引物名稱Primername引物序列(5'→3')Primersequence(5'→3')退火溫度/℃Tm擴增片段長度/bpProductlength擴增區域Amplifiedregion啟動子克隆PromotercloningFoxO1-PFGACGGGTGAGAATGTCAACGA601 920-1 722/+198FoxO1-PRCCTCCGGGTCCGCTGCACTGACFoxO1-P1CGGGGTACC GACGGGTGAGAATGTCAACGA601 920-1 722+198FoxO1-P2CGGGGTACC ATGGGAGGGGGCGGTGATTGAC601 528-1 330/+198FoxO1-P3CGGGGTACC TGCCTTCGGGTCTCAGGGTGC601 202-1 004/+198啟動子逐段缺失片段克隆PromoterdeletionfragmentscloningFoxO1-P4CGGGGTACC ACACGCGTGTGTGCGGCCCGC60915-717/+198FoxO1-P5CGGGGTACC CGGGCTCCCGAGCGCAGGTCGA60669-471/+198FoxO1-P6CGGGGTACC ACCAGAAAATAATAACAGAGAG60483-285/+198FoxO1-P7CGGGGTACC CGGCGGCAGATCCCGTAAGTC60225-27/+198FoxO1-RCCCAAGCTT CCTCCGGGTCCGCTGCACTGAC
1
.2
.5
細胞培養、轉染及酶活測定使用含10%胎牛血清和1%雙抗的DMEM培養基培養小鼠成肌細胞(C2C12)系和脂肪細胞(3T3-L1)系,將其分別接種至24孔板,每孔細胞的量為1×10個,置于37 ℃、體積分數5% CO2培養箱中培養,待細胞匯合度達70%~80%時,分別將構建的0.8 μg牛FoxO1
基因啟動子不同的5′端遞減缺失片段重組質粒和0.02 μg內參質粒pRL-TK共轉染至C2C12和3T3-L1細胞系中,轉染步驟詳見Lip3000轉染試劑盒說明書。以pGL3-Basic 質粒為陰性對照(n
=3)。轉染48 h后裂解細胞,通過檢測并計算螢火蟲熒光素酶活性(F
值)和海腎熒光素酶活性(R
值)的比值(F
/R
)來確定FoxO1
基因啟動子核心區域。數據采用SPSS軟件中2個獨立樣本t
檢驗進行方差分析。1
.2
.6
關鍵轉錄因子預測和鑒定通過在線軟件Genomatix(http:∥www.Genomatix.de/cgibin∥matinspector)和JASPAR(http:∥jaspar.genereg.net/)預測啟動子核心區潛在轉錄結合因子,設置閾值大于90%,通過將兩者預測結果進行數據庫比對,篩選出交集,標注牛FoxO1
基因啟動子核心區轉錄因子結合序列。根據在線軟件Genomatix和JASPAR預測的潛在轉錄因子,使用Fast MultiSite Mutagenesis System定點突變試劑盒進行定點突變,設計定點突變引物(表2),并進行突變片段的制備,具體操作詳見說明書(目錄號:FM201)。將得到的突變型和野生型分別轉染C2C12細胞系后測定酶活,操作方法同上。
表2 定點突變引物信息
Table 2 Primers used in site-directed mutation
引物名稱Primer name引物序列(5'→3')Primer sequence (5'→3')mMEF2A-FACAGAGAGCCAAAAATTTTAAAAAAAACCAGAGAmMEF2A-RAAAATTTTTTGGCTCTCTGTTATTATTTTCTGGTmSREBF1-FGTCAAATAGAAAAATTTTCCACTACCCCCCACCmSREBF1-RAAAATTTTTCTATTTGACATGCACACTCGCTCGCmHOXA5-FCAGGCCGGCGCCCATAAAAGGCCCGGGCGGCGCCmHOXA5-RTTTTATGGGCGCCGGCCTGGGCGGGGCTCGGTTTTmKLF4-FTGGAAAACCGAGCTTTTCCCAGGCCGGCGCCCmKLF4-RAAAAGCTCGGTTTTCCACGGGGAGGTGGCAGmKLF5-FGGGGCCGTCCGTCAGTTTTGGGCCGGCGCGCGCGmKLF5-RAAAACCCGGCCGCGCGCGCGGCGGCGGCGGCG
2 結果與分析
2.1 牛FoxO1基因結構及蛋白序列分析
查找NCBI(NC_037339.1)及Ensembl數據庫公布的牛FoxO1
基因信息發現,牛FoxO1
基因位于12號染色體上,全長9 3695 bp;開放閱讀框(Open reading frame,ORF)分析發現,牛FoxO1
包括3個外顯子和2個內含子;確定FoxO1
轉錄起始位點鳥嘌呤(G)為+1位置,并向上游查找2 000 bp的序列,初步預測其啟動子位置(圖1)。理化性質分析發現,FoxO1
基因編碼665個氨基酸,分子量(Molecular weight)為69958.93,理論pI值為6.38,不穩定性指數(Instability index)為59.53(>40.0),推測牛FoxO1蛋白為不穩定蛋白。利用GenBank數據庫中公布的10個物種的蛋白質序列構建系統發育樹,經過相似性比對后,結果表明(圖2和表3),牛FoxO1蛋白與山羊和綿羊相似性最高分別為97.76%和97.60%,且FoxO1蛋白在除原雞以外的不同物種間較為保守,尤其在復胃動物(綿羊、山羊和牛)之間進化保守。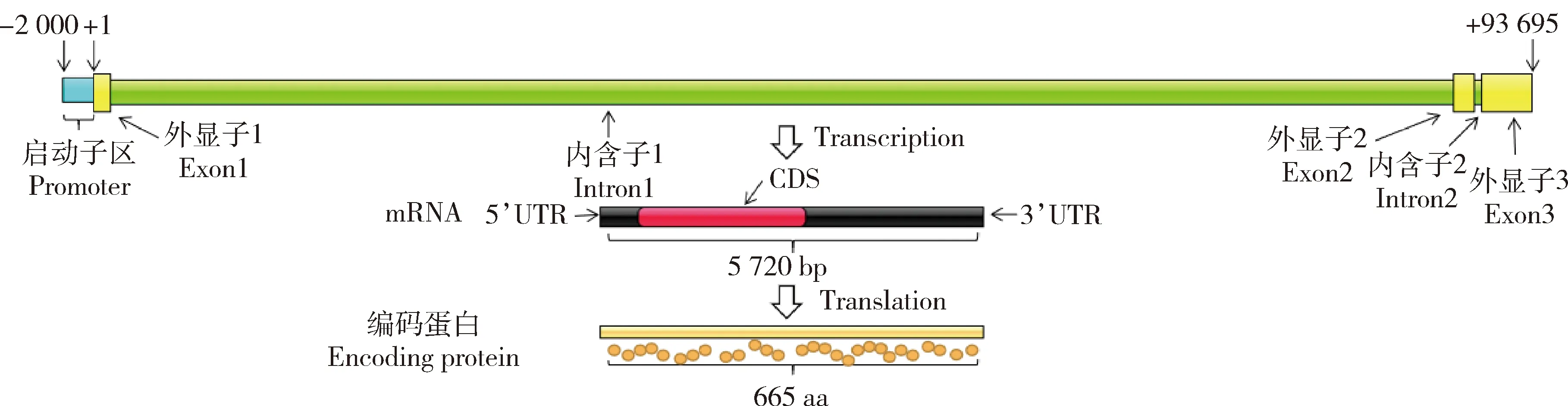
圖1 牛FoxO1基因結構示意圖Fig.1 Schematic diagram of bovine FoxO1 gene structure
表3 FoxO1蛋白質序列登錄號及相似性比對結果
Table 3 GenBank number of the FoxO1 protein sequence and homology comparison results
物種Specie登錄號GenBank No.相似性/%Similarity牛Bos taurusXP_024855821.1綿羊Ovis ariesXP_027829397.197.60犬Canis lupusXP_038290656.194.91人Homo sapiensQ12778.293.69小鼠Mus musculusQ9R1E0.290.24山羊Capra hircusXP_017912175.197.76豬Sus scrofaNP_999179.395.05家貓Felis catusXP_023106848.195.35大鼠Rattus norvegicusNP_001178775.189.34原雞Gallus gallusNP_989659.175.04

圖2 牛與其他物種FoxO1蛋白質序列進化樹Fig.2 FoxO1 protein sequence phylogenetic tree among Bos taurus and other species
2.2 牛FoxO1基因啟動子片段的擴增
PCR擴增牛FoxO1
基因啟動子序列,凝膠電泳檢測結果顯示(圖3(a)),該條帶與目的條帶大小基本吻合,且條帶整齊、無雜帶和拖帶。經測序鑒定,其長度為1 920 bp,與GenBank中已公布的序列對比完全一致,可用于后續試驗。
(a)PCR擴增牛FoxO1基因的啟動子片段。M,DL 4500 DNA Marker;1,啟動子-1 722/+198區擴增結果;(b)牛FoxO1基因啟動子逐段缺失片段擴增電泳圖。M,DL 2000 DNA Marker;1~7 分別為FoxO1-P1/FoxO1-R~FoxO1-P1/FoxO1-R7擴增產物;(c)牛FoxO1基因啟動子雙熒光素報告重組質粒雙酶切鑒定電泳圖。M, DL 2000 DNA Marker;1~7,分別為Kpn Ⅰ、Hind Ⅲ雙酶切pGLFoxO1-1 722/+198、pGLFoxO1-1 330/+198、pGLFoxO1-1 004/+198、pGLFoxO1-717/+198、pGLFoxO1-471/+198、pGLFoxO1-285/+198和pGLFoxO1-27/+198的結果。
2.3 牛FoxO1基因啟動子核心區鑒定
2
.3
.1
啟動子逐段缺失片段的擴增使用逐段缺失引物進行PCR擴增牛FoxO1
基因的逐段缺失啟動子區片段,電泳檢測后(圖3(b))分別獲得了1 920、1 528、1 202、915、669、483和225 bp的單一條帶,經測序驗證后與預期片段長度一致,可用于后續試驗。2
.3
.2
FoxO1
基因啟動子核心區的確定經過雙酶切鑒定后(圖3(c)),成功構建了牛FoxO1
基因逐段缺失的pGL-Basic重組質粒,將其分別命名pGLFoxO1-1 722/+198、pGLFoxO1-1 330/+198、pGLFoxO1-1 004/+198、pGLFoxO1-717/+198、pGLFoxO1-471/+198、pGLFoxO1-285/+198和pGLFoxO1-27/+198。經測序驗證無誤后,抽提去內毒素質粒,將其轉染至C2C12和3T3-L1細胞系。通過分析逐段缺失啟動子活性片段發現(圖4),FoxO1
基因啟動子-1 722/+198區域在兩種細胞系中活性較好,進一步對缺失區域進行比對發現,缺失-285/-27片段后,雙熒光素報告載體pFoxO1-27/+198在C2C12及3T3-L1細胞中的活性較pFoxO1-285/+198極顯著下降(P
<0.01)。由此推測,FoxO1
基因5′端上游1.9 kb序列為具有調控基因轉錄活性功能的啟動子區;此外缺失-285/-27 片段時酶活極顯著下降,由此確定-285/-27 區域為牛FoxO1
基因啟動子核心區。另一方面,研究發現FoxO1
基因在C2C12細胞系的轉錄活性高于3T3-L1,這一結果說明了在C2C12細胞系中更適合FoxO1
基因轉錄活性的測定。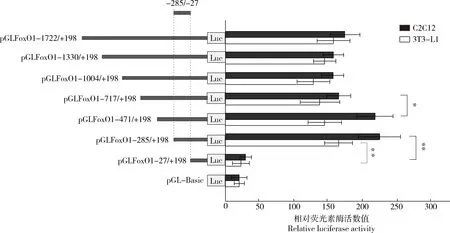
*和**分別表示差異顯著(P<0.05)和極顯著(P<0.01)。下同。 * and ** indicate significant difference (P<0.05) and extremely significant difference (P<0.01), respectively. The same below.圖4 逐段缺失檢測牛FoxO1基因啟動子核心區Fig.4 Detection of core promoter region of bovine FoxO1 gene by series deletion
2.4 關鍵轉錄因子預測及鑒定
利用Genomatix和JASPAR軟件對牛FoxO1
基因啟動子核心區域(-285/-27片段)的關鍵轉錄因子進行預測分析。結果顯示,牛FoxO1
基因啟動子核心區包含肌細胞增強因子2(MEF2A)、固醇調節元件結合轉錄因子1(SREBF1)、同源異型盒基因5(HOXA5)、Krüppel樣因子4(KLF4)和Krüppel樣因子5(KLF5)等關鍵轉錄因子的結合位點(圖5(a))。因此初步推測,MEF2A、SREBF1、HOXA5、KLF4和KLF5轉錄因子可能對FoxO1
基因的轉錄活性有重要的調控作用。將進一步構建的野生型載體和定點突變后構建的突變型載體分別轉染C2C12細胞系中測定酶活性。結果顯示,突變MRF2A位點后,酶活相比野生型降低了49.48%(P
<0.01);突變SREBF1位點后,酶活相比野生型升高了1.73%(P
>0.05);突變KLF4位點后,酶活相比野生型升高了35.15%(P
<0.01);突變HOXA5和KLF5位點后,酶活相比野生型分別降低了23.73%(P
<0.01)和33.75%(P
<0.05)(圖5(b))。此結果說明,MEF2A、KLF4、HOXA5和KLF5轉錄因子是調控牛FoxO1
轉錄活性的重要因子,MEF2A和KLF4起到正向調控作用,HOXA5和KLF5起到負向調控的作用;而突變SREBF1位點后,酶活差異不顯著,說明SREBF1對牛FoxO1
轉錄活性沒有調控作用。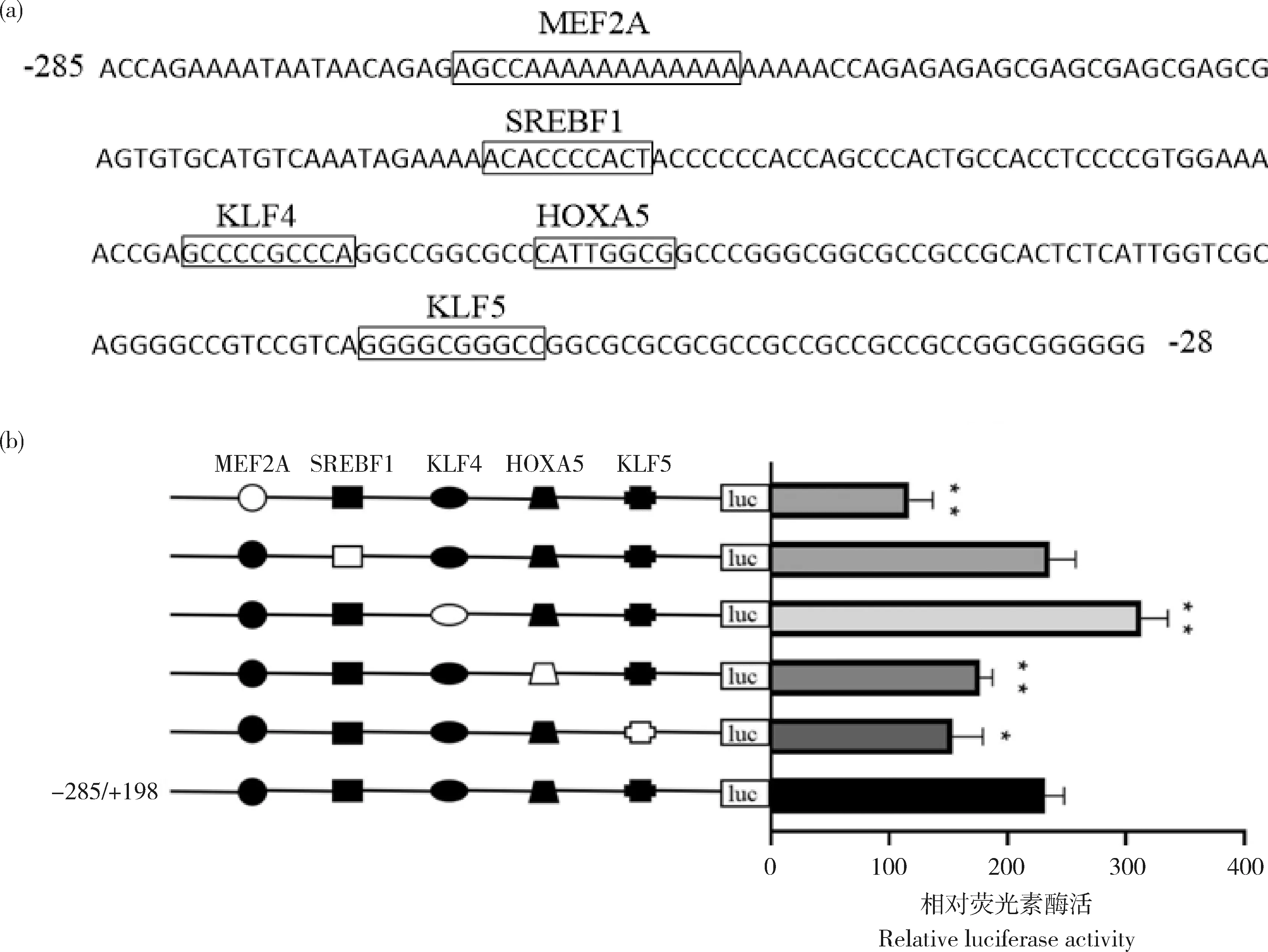
(a)牛FoxO1基因核心區域轉錄因子預測。方框表示相對于的轉錄因子結合位點。(b)定點突變關鍵轉錄因子酶活測定。縱坐標左側為-285/+198 bp區域轉錄因子,白色圖形為突變型,黑色圖形為野生型。
3 討論與結論
FoxO1
作為Fox
家族17個亞群中的成員之一,在脂肪細胞分化、肌纖維形成等重要生物學功能中起到重要的作用。啟動子為轉錄調控中關鍵元件,其核心區存在著轉錄因子的結合位點,目前已有大量研究發現這些轉錄因子可以識別特定DNA序列,并與基因組中的調控區域結合,從而激活或抑制靶基因的轉錄來調節mRNA的轉錄水平。因此確定牛FoxO1
基因核心啟動子并鑒定其轉錄因子結合位點對研究牛FoxO1
基因的轉錄調控機制至關重要。本研究通過構建逐段缺失片段,進行雙熒光素酶活檢測確定FoxO1
啟動子的核心區為-285/-27。利用在線軟件預測到FoxO1
啟動子核心區域有MEF2A、SREBF1、HOXA5、KLF4和KLF5共5個轉錄因子的結合位點。其中,MEF2A
作為MEF2
基因家族中的一員,肌纖維穩態、對肌纖維形成、成肌細胞的分化、心肌細胞增殖、骨骼肌干細胞和再生有促進作用。研究表明,MEF2A
是骨骼肌生成過程中的重要轉錄調控蛋白,在成肌細胞增殖和分化中發揮重要作用,其沉默會抑制成肌細胞分化,并顯著下調鈣調磷酸酶肌小節結合蛋白2(MYOZ2)的表達量。HOXA5
基因作為同源框基因(Homeobox genes)家族中重要發育轉錄因子之一,與個體組織和器官發育密切相關。HOXA5
基因主要參與BMP4/Samd1信號通路,在脂肪組織形成和脂肪細胞分化過程中發揮著重要的調控作用。研究表明,沉默HOXA5
可有效減少3T3-L1細胞中的脂質積累。Kr
üppel
樣因子(Krüppel-like factors,KLFs)家族為鋅指蛋白類轉錄因子,具有參與調控細胞增殖和胚胎發育等生命過程的重要作用,在細胞分化和細胞周期阻滯中也扮演著重要角色。KLF4
和KLF5
均為KLF家族成員,其中KLF4作為脂肪形成的直接早期調節因子,可以誘導同為脂肪形成的早期的C/EBPβ(Enhancer binding protein β);若敲除KLF4
基因則會下調C/EBPβ水平,從而抑制脂肪生成。KLF5
因在腸上皮細胞中表達水平較高也被稱為腸Krüppel樣因子,有研究發現KLF5
對肌肉脂質代謝有著重要作用,如KLF5
可參與Krox20(Early growth response 2,EGR2/Krox20)誘導的C/EBP/PPARγ通路,KLF5
由C/EBPβ、C/EBPδ激活并與C/EBPα、C/EBPβ和C/EBPδ協同激活脂肪重要調節因子PPARγ2的表達。本研究通過定點突變牛FoxO1
基因啟動子核心區KLF4和KLF5結合位點,發現FoxO1
轉錄活性分別上升和下降,這說明KLF4和KLF5對FoxO1
基因轉錄活性有負向和正向調控作用。綜上,MEF2A、HOXA5、KLF4和KLF5均在肌肉或脂肪形成過程中起著重要的作用且其對牛FoxO1
基因轉錄活性具有重要調控作用,但基因的調控機制十分復雜,因此還需使用凝膠遷移阻滯試驗(EMSA)和染色質免疫共沉淀(ChIP)等技術來進一步驗證MEF2A、HOXA5、KLF4和KLF5轉錄因子是否均能結合到FoxO1
基因啟動子核心區,進一步探究FoxO1
基因的轉錄調控機制。本研究成功克隆出牛FoxO1
基因長1 920 bp的啟動子序列,確定了牛FoxO1
基因啟動子的核心區為-285/-27,進一步驗證出MEF2A、KLF4、HOXA5和KLF5為牛FoxO1
基因啟動子核心區的關鍵轉錄因子。