螢火蟲熒光素酶標記的馬爾尼菲籃狀菌的構建與應用*
羅 強,韋吳迪,,3,王 剛,何錦豪,張 洪,包秀麗,陳麗香,蔣俊俊,,3,葉 力,,3,梁 浩,,3△
(1.廣西醫科大學生命科學研究院,再生醫學與醫用生物資源開發應用省部共建協同創新中心,南寧 530021;2.廣西醫科大學公共衛生學院,廣西艾滋病防治研究重點實驗室,南寧 530021;3.中國(廣西)-東盟新發傳染病聯合實驗室,南寧 530021)
馬爾尼菲籃狀菌(talaromyces marneffei,TM)是一種溫度依賴型二相真菌,作為一種機會性的致病性真菌,可在免疫系統功能低下人群中引起感染性疾病,尤其是在HIV/AIDS 人群[1]。HIV/AIDS 合并TM感染可導致高復發率與病死率[2],是一種嚴重危害人類健康的病原體。目前的研究主要聚焦于TM與宿主間的相互作用[3],但關于TM潛伏感染與復發的機制尚未闡明。傳統真菌相關研究主要涉及細胞與動物感染模型構建,而動物實驗需在特定時間處死小鼠并取材,觀察臟器變化和真菌負荷等指標,進而評估TM的感染進程[4-6]。然而,該手段無法實現對TM感染全過程的動態監測。因此建立一種可追蹤的工具菌來實時評估TM的感染進程尤為重要。
生物發光成像作為一種非侵入性的成像方法,廣泛的應用于細胞、細菌、真菌及病毒的實時追蹤。其中,基于螢火蟲熒光素—熒光素酶(firefly luciferase,Luc)的報告系統研究最為廣泛,該方法涉及腫瘤進展的監測、疾病診斷與治療、病原微生物感染的實時監測等多個方面[7-10]。該技術已應用在白色念珠菌的研究中,以基因組學技術將Luc 基因整合至真菌基因組,實現對真菌的標記,可視化真菌在宿主體內的定植部位以及評價藥物對真菌的清除效果[11]。然而,尚未有利用Luc標記TM菌株的報道。本研究采用農桿菌介導轉化(agrobacteriun tumefaciens-mediated transformation,ATMT)將Luc基因插入TM基因組,使TM菌株可穩定表達Luc基因,并在形態與功能上與TM標準株比較,探究TMLuc作為工具菌的效果及潛力。
1 材料與方法
1.1 材料
1.1.1 細胞與菌株 TM 標準株ATCC18224,購買于美國ATCC;pASP-hyg 質粒購于武漢銳志魔方生物科技有限公司;農桿菌感受態細胞EHA105 購于上海維地生物技術有限公司;THP-1 細胞系購于中國科學院上海生命科學研究院細胞庫。
1.1.2 主要試劑 Q5 High-Fidelity DNA Polymerase(NEB),2×Taq Plus Master Mix Ⅱ(Dye Plus)(Vazyme),ClonExpress ⅡOne Step Cloning Kit(Vazyme),HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)(Vazyme),EHA105(pSoup)(唯地生物),LB培養基(海博生物),沙氏葡萄糖液體培養基(青島海博),卡那霉素(索萊寶),利福平(索萊寶),As 乙酰丁香酮(索萊寶),潮霉素B(索萊寶),DMEM basic 高糖培養液(Gibco),RPMIMedium 1640 basic培養液(Gibco)。
1.1.3 主要儀器 PCR 儀(ABI),北京六一電泳儀(DYY-7C),哈東聯恒溫搖床(DLHR-X250),化學成像系統(Bio-Rad Chem Doc),冷凍離心機(Beckman Microfuge 20R),微量移液器(瑞寧),微量分光光度計(Thermo Nanodrop 2000),活體成像動物儀(PerkinElmer),Cyto FLEX2 流式細胞儀(Beckman Coulter)。
1.2 方法
1.2.1 重組質粒pCAMBIA1303-TrpC-Hygro-gpdALuc的構建 以pGL3-basic質粒為模板,設計Luciferase 引物進行擴增,引物序列見表1。對pCAMBIA1303-TrpC-Hygro-gpdA-GFP載體骨架進行雙酶切。37 °C 反應1 h,80 °C 失活10 min,之后通過1.5%瓊脂糖凝膠電泳回收酶切后的載體骨架,將回收的PCR 產物與酶切后回收的pCAMBIA1303-TrpC-Hygro-gpdA-GFP 載體骨架進行重組連接。37°C 反應30 min 后迅速置于冰上冷卻;隨后將重組產物轉化至TranT1感受態細胞,涂布于含有卡那霉素(50 μg/mL)的LB 培養基上,37°C 培養箱中倒置培養12~16 h;挑取重組反應轉化平板上若干個克隆進行菌落PCR 鑒定,引物見表1。擴增后進行電泳驗證,隨后對目標菌落擴大培養,進行小質粒提取并進行測序。
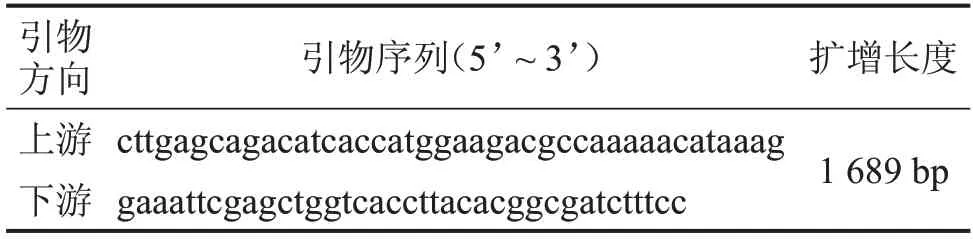
表1 Luciferase引物序列
1.2.2 潮霉素濃度篩選 將TM標準株涂布于含有不同濃度潮霉素(0 μg/mL,20 μg/mL,40 μg/mL,60 μg/mL,80 μg/mL,100 μg/mL)沙氏葡萄糖培養基平板中,在37°C溫箱中培養3 d,篩選出無菌落生長的最低潮霉素濃度。
1.2.3 農桿菌轉化培養及TM-Luc轉化子的構建 取適量重組質粒與EHA105 感受態細胞,加入無抗生素的LB 液體培養基在28°C 環境下培養2~3 h,離心留取上清,將上清涂布于含50 μg/mL 卡那霉素,20 μg/mL 利福平的LB 平板繼續培養2 d,挑取陽性克隆株于含20 mg/LAs 的LB 液體培養基,28°C震蕩培養至OD600nm為0.8左右待用。將含有質粒的EHA105感受態細胞與TM標準株按比例進行共培養24 h,收集懸液涂布至含潮霉素的沙氏葡萄糖培養基平板上,放入37°C 溫箱培養至有菌落產生,隨后挑取菌落至新的含潮霉素的沙氏葡萄糖培養基平板進行擴大培養,提取基因組進行PCR 鑒定,引物見表2。
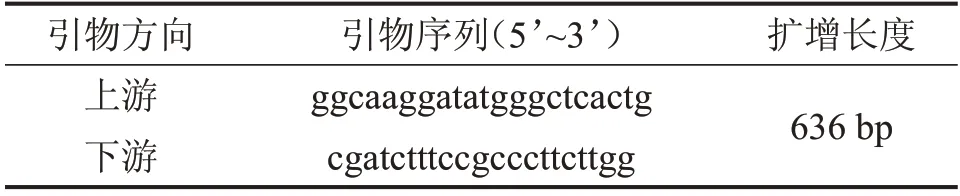
表2 TM-Luc引物序列
1.2.4 TM 標準株與TM-Luc 生長形態對比 根據說明書配比配置PDA與BHI培養基,121°C,20 min高壓后,倒入培養皿中,待其冷卻后分別在培養皿中央滴加10 μL TM 標準株菌液或TM-Luc 菌液,PDA和BHI培養基分別放入27°C和37°C培養箱,持續培養18 d;每日取出培養皿進行拍照,采用十字交叉法量取菌落直徑。
1.2.5 細胞培養與感染模型構建 使用RPMIMedium 1640 basic(含10%胎牛血清,1%青鏈霉素混合液)完全培養液培養THP-1 細胞,并置于37 °C、含5%CO2的恒溫培養箱中。使用含有PMA的DMEM(含10%胎牛血清,1%青鏈霉素混合液)完全培養液刺激48 h,即可轉化為THP-1 來源的巨噬細胞。隨后用TM標準株與TM-Luc感染THP-1巨噬細胞,感染復數為1∶3,分別收集感染后24 h、48 h的總RNA進行后續炎癥因子檢測,同時收集24 h、48 h和72 h的細胞懸液進行細胞死亡情況的檢測。
1.3 統計學方法
采用GraphPad Prism 8與SPSS Statistics 26軟件進行統計學分析,計量資料采用均數±標準差(),假設檢驗采用Student t檢驗與雙因素重復測量方差分析檢驗,以P<0.05 為差異具有統計學意義。
2 結果
2.1 重組質粒pCAMBIA1303-TrpC-Hygro-gpdALuc的構建及驗證
使 用NcoI、BstEII酶切pCAMBIA1303-TrpCHygro-gpdA-GFP 質粒(圖1A),經瓊脂糖凝膠電泳回收后與擴增的Lucifera 產物(圖1D)進行重組連接,構建pCAMBIA1303-TrpC-Hygro-gpdA-Luc 重組質粒(圖1B),挑取重組反應產物進行PCR 鑒定,在12 個單克隆菌落中發現3 個菌落在目的位置出現條帶(圖1C)。隨后挑選其中一個單克隆菌落(泳道7)進行擴大培養,提取少量質粒進行測序比對,比對結果證明重組質粒構建成功。
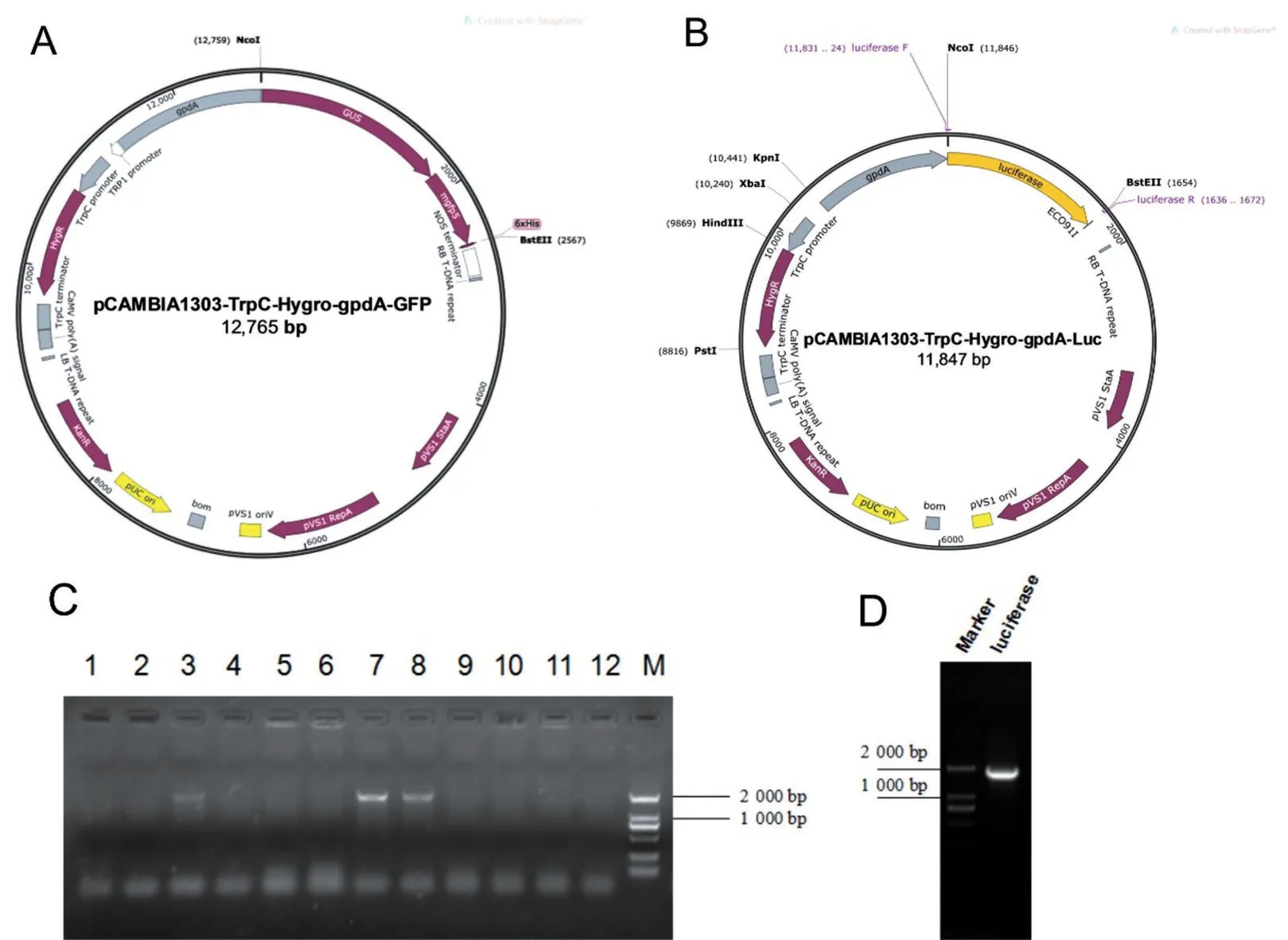
圖1 Luc質粒和轉化產物的構建與驗證
2.2 TM標準株對潮霉素的敏感性篩選
在早期研究結果的基礎上[12],本課題組摸索了TM標準株在含不同濃度的潮霉素培養基上的生長情況。結果顯示TM 標準株在含有80 μg/mL 的潮霉素培養基上不生長,見圖2。
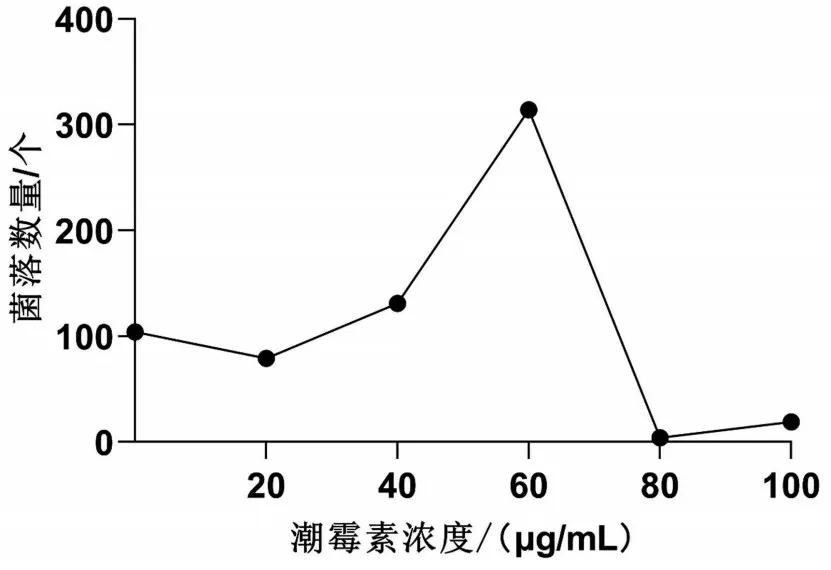
圖2 潮霉素濃度對TM標準株的生長影響
2.3 農桿菌侵染TM標準株
通過ATMT 法將Luc 基因插入TM 標準株的基因組中,對轉化子進行PCR 擴增和Luciferase 的檢測,電泳結果在500~750 bp 之間出現條帶(圖3A);成像結果見圖3B,在D-熒光素鉀鹽底物存在時,TM-Luc 可發出明顯的熒光,證明TM-Luc 構建成功。
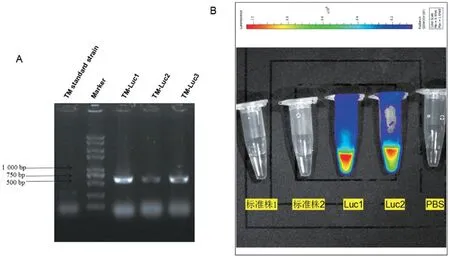
圖3 TM-Luc的驗證
2.4 TM-Luc 與TM 標準株生長形態與生長速率的對比
兩種菌株分別放置于27°C 與37°C 培養箱培養,連續14 d記錄菌落生長情況。二者在PDA培養基生長形態均為扁平絨毛狀,可在菌落底部觀察到特征性紅色素擴散現象(圖4A);在BHI培養基上呈深褐色,表面光滑(圖4A)。培養14 d后,在PDA培養基中,TM 標準株生長直徑為(6.54 ± 0.22)cm,TM-Luc 生長直徑為(6.45 ± 0.23)cm,兩者之間的生長曲線(P=0.273)與生長速率曲線(P=0.49)比較,差異均無統計學差異(圖4B、圖4C)。熒光顯微鏡下觀察二者形態相似,均可發現經典的帚狀枝形態(圖4A)。
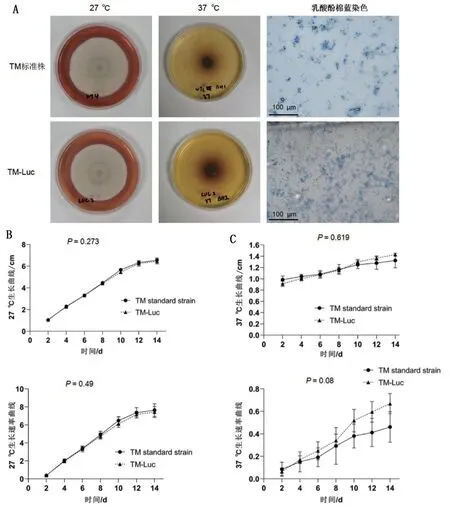
圖4 TM標準株與TM-Luc生長情況
2.5 TM標準株與TM-Luc對THP-1巨噬細胞的影響
在比較了二者的生長情況后,本課題組探索了兩種菌株對THP-1巨噬細胞的影響。TM標準株和TM-Luc 與THP-1 來源的巨噬細胞共培養后,檢測24 h 和48 h 的炎癥因子TNFA、IL1B和IL10的表達水平,差異無統計學意義(圖5A);在細胞死亡的檢測中,觀察到TM-Luc 對于THP-1 巨噬細胞的殺傷稍少于TM 標準株(圖5B),雖在48 h 時有差異,但隨著時間延長,二者對細胞殺傷效果趨于一致。
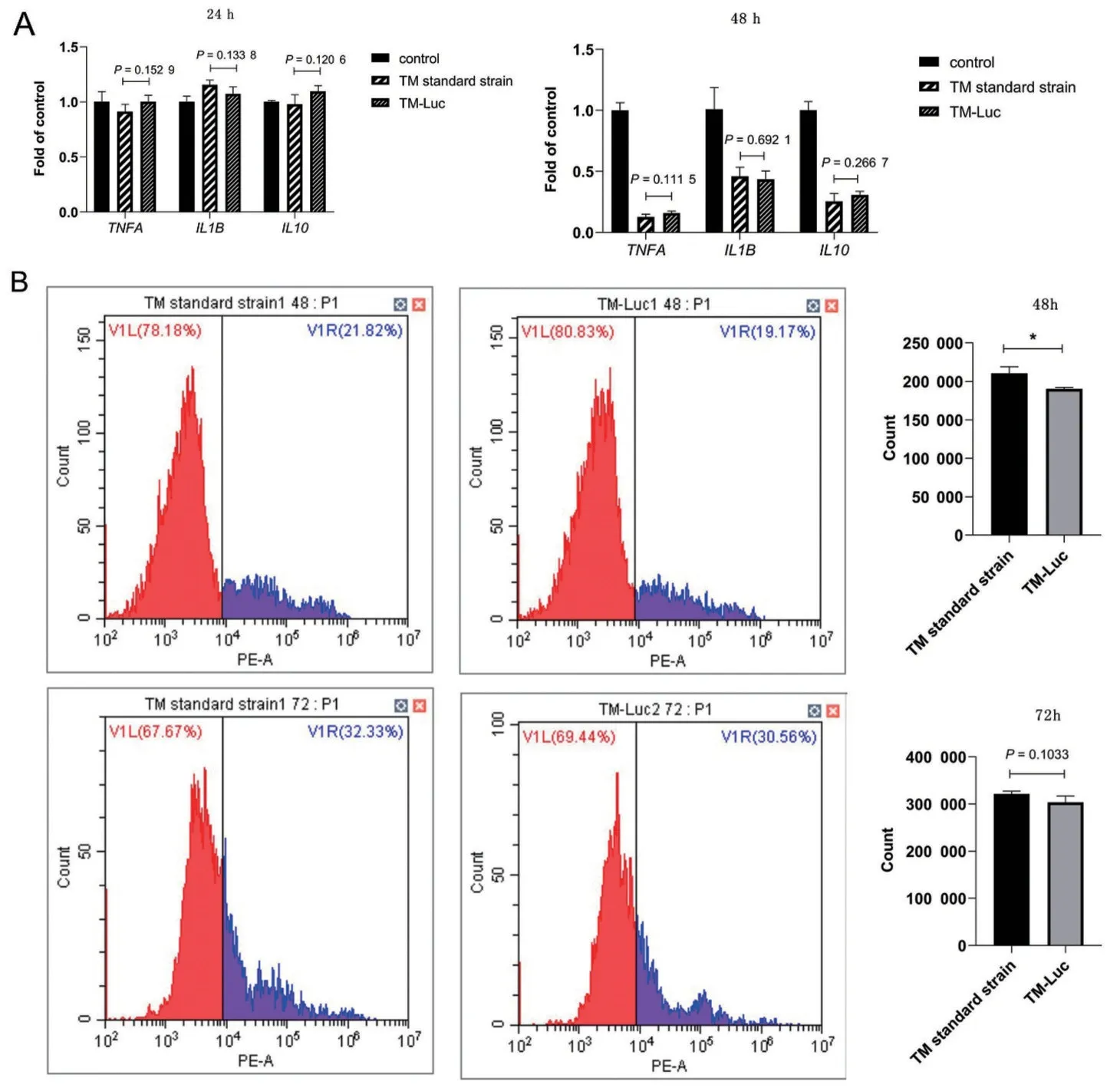
圖5 TM標準株與TM-Luc感染THP-1巨噬細胞
3 討論
本研究采用ATMT 法將Luc 基因轉入TM 的基因組,從而構建穩定轉化的TM-Luc。農桿菌介導的轉化法受體材料廣泛,分生孢子、原生質體、菌絲體等材料都可進行遺傳轉化。相較于原生質體轉化、脂質體轉化等方法,ATMT 轉化難度低、轉化效率高、轉化子遺傳穩定高,并且T-DNA 隨機整合至基因組,這些優點讓ATMT廣泛應用于動植物的真菌疾病病理研究中[13]。在TM基因組插入誘變的研究中,發現T-DNA在TM基因組的整合方式為隨機整合,并且部分突變體表現出形態方面的異質性,如可溶性紅色素產生缺陷、分生孢子較少甚至無分生孢子等現象[14]。這表明T-DNA 的插入可能會對宿主的基因組造成影響,從而影響宿主的形態或功能。
本課題組將農桿菌LB 與RB 序列間的T-DNA替換為Luc 基因,從而將Luc 基因整合至TM 基因組,因其在整合過程中的隨機性,筆者針對TM-Luc與TM標準株之間的形態與部分功能特征進行了對比,結果發現TM-Luc 可產生特征性的可溶性紅色素,并且菌落形態、生長直徑等與TM 標準株無差異。TM-Luc 和TM 標準株與THP-1 來源的巨噬細胞共培養后,TNFA、IL10等炎癥因子的表達趨勢一致;在TM 殺傷巨噬細胞實驗中,發現TM-Luc 對巨噬細胞的殺傷較弱于TM 標準株,在48 h 時差異具有統計學意義,而72 h時細胞死亡趨勢趨于一致。
Luc 在動物活體成像領域的應用十分廣泛,同一批次的動物可得到所有動物的橫向實驗數據,也可得到單個動物的縱向實驗數據,避免了批次間的誤差,實驗數據更加真實。本研究構建的TM-Luc目前僅用于細胞感染模型的構建,和TM 標準株進行了部分形態與功能學特征進行了對比。后續將TM-Luc應用于動物感染模型的構建,可為TM的體內機制研究提供新的手段。

