淫羊藿苷對人牙囊干細胞旁分泌作用的影響
鄭曉雪 王乙行 陶天翼 韓 冰
牙囊干細胞(dental follicle stem cell,DFSC)來自間充質組織,是一種牙源性干細胞,可從第三磨牙或多生牙牙囊中獲取。與其他間充質干細胞類似,DFSC具有分泌多種生物活性因子的旁分泌功能,這些因子已被報道可以調節免疫、促進細胞增殖、遷移及血管生成等。收集間充質干細胞的培養上清,這些生物活性因子存在其中,稱為條件培養基(conditioned medium,CM),可用于基于干細胞分泌細胞因子的無細胞療法,具有廣泛的應用價值。多項研究表明,多種牙源性干細胞CM可以促進細胞的增殖、遷移及成骨分化。來源于多生牙的DFSC-CM能否在骨再生中發揮作用尚不明確。淫羊藿苷(icariin, ICA)是淫羊藿中提取的有效單體。研究發現,ICA類似于雌激素,可以刺激骨形成,抑制骨吸收。ICA能否調控DFSC旁分泌功能,發揮定向成骨的作用,尚少見報道。本研究通過ICA誘導多生牙來源的DFSC,制備了DFSC-CM,并通過檢測其對小鼠胚胎成骨細胞前體細胞(MC3T3-E1)增殖、遷移和成骨分化的影響,探究了ICA能否作為骨誘導因子,促進DFSC定向成骨的旁分泌作用。
材料與方法
1.主要試劑與儀器:高糖培養基、α-培養基購自美國HyClone公司;胎牛血清購自美國Gibco公司;Ⅰ型膠原酶購自德國Sigma公司;淫羊藿苷購自北京索萊寶科技有限公司;人間充質干細胞成脂誘導培養基購自廣州賽業生物科技有限公司;β-甘油磷酸二鈉購自北京酷來博科技有限公司;地塞米松和維生素C均購自上海源葉生物科技有限公司;兔抗波形絲蛋白、角蛋白8抗體、DAB試劑盒均購自沈陽萬類生物有限公司;小鼠抗IGg、CD34、CD45、CD90、CD105抗體均購自美國Bio Legend公司;CCK-8、PCR試劑盒購自上海翌圣股份有限公司;酶標儀購自美國Thermo Fisher公司;流式細胞儀購自美國BD公司;倒置相差顯微鏡購自日本Olympus公司;熒光定量PCR儀購自美國Bio-Rad公司。
2.細胞分離、培養、鑒定:(1)MC3T3-E1(吉林省牙齒發育與頜骨重建與再生重點實驗室贈予),用含10% FBS的高糖培養基于 37℃、5% CO細胞孵箱中培養。(2)提取原代DFSC:牙囊組織由吉林大學口腔醫院口腔頜面外科提供,術前檢測無傳染性疾病,并經患兒家長知情同意。拔除多生牙的同時刮出牙囊組織,冰盒運至實驗室。剪取約0.5cm×0.5cm大小,加入2.5g/L Ⅰ型膠原酶,消化30min,1000r/min離心5min。用含20% FBS、1%青霉素-鏈霉素混合液的α-培養基,放入細胞孵箱中培養。當細胞融合至90%,可1∶2傳代,第3~5代DFSC進行后續實驗。(3)細胞免疫化學:第4代DFSC,固定細胞20min,抗原修復后滴加1∶150 兔抗人波形絲蛋白抗體、1∶200兔抗人角蛋白8抗體,4℃孵育24h,次日用DAB試劑盒檢測細胞著色情況。(4)流式細胞術:第4代DFSC,細胞密度為1×10個/100微升,加入5μl抗體,分別為IGg、CD34、CD45、CD90、CD105,IGg為同型對照,冰上孵育30min, 避光,清洗2次,400μl PBS重懸細胞沉淀,換用流式管,上機檢測。(5)DFSC多向分化能力鑒定:第3代 DFSC,分別使用成骨誘導培養基(10mmol/L β-磷酸甘油二鈉,50μg/ml維生素C,0.01μmol/L地塞米松)、成脂誘導培養基培養細胞21天,分別行茜素紅、油紅染色,顯微鏡下觀察鈣結節、脂滴形成情況。
3.制備DFSC-CM:第3~5代DFSC,當細胞融合度達90%時,加入0、1和10μmol/L ICA,換用無血清的α-培養基培養24h,以1000×離心收集的培養上清5min,去沉淀后分裝,-80℃保存備用,與新鮮培養液1∶1 混合后用于后續實驗。實驗分為6組,分別為對照組(完全培養基)、0ICA-CM組(含0μmol/L ICA的DFSC-CM)、1ICA-CM組(含1μmol/L ICA的DFSC-CM)、10ICA-CM組(含10μmol/L ICA的DFSC-CM)、1ICA組(含1μmol/L ICA的完全培養基)、10ICA組(含10μmol/L ICA的完全培養基)。
4.細胞增殖檢測:按照2×10個/孔的細胞密度將MC3T3-E1接種在96孔板上,放入孵箱中培養,次日更換實驗組培養基。分別在培養的第1、3和5天時,取10μl的CCK-8檢測液加入100μl的培養基中,1.5h后酶標儀檢測450nm處的吸光度值。檢測結束后,棄液,結晶紫染色30min,顯微鏡下拍照。
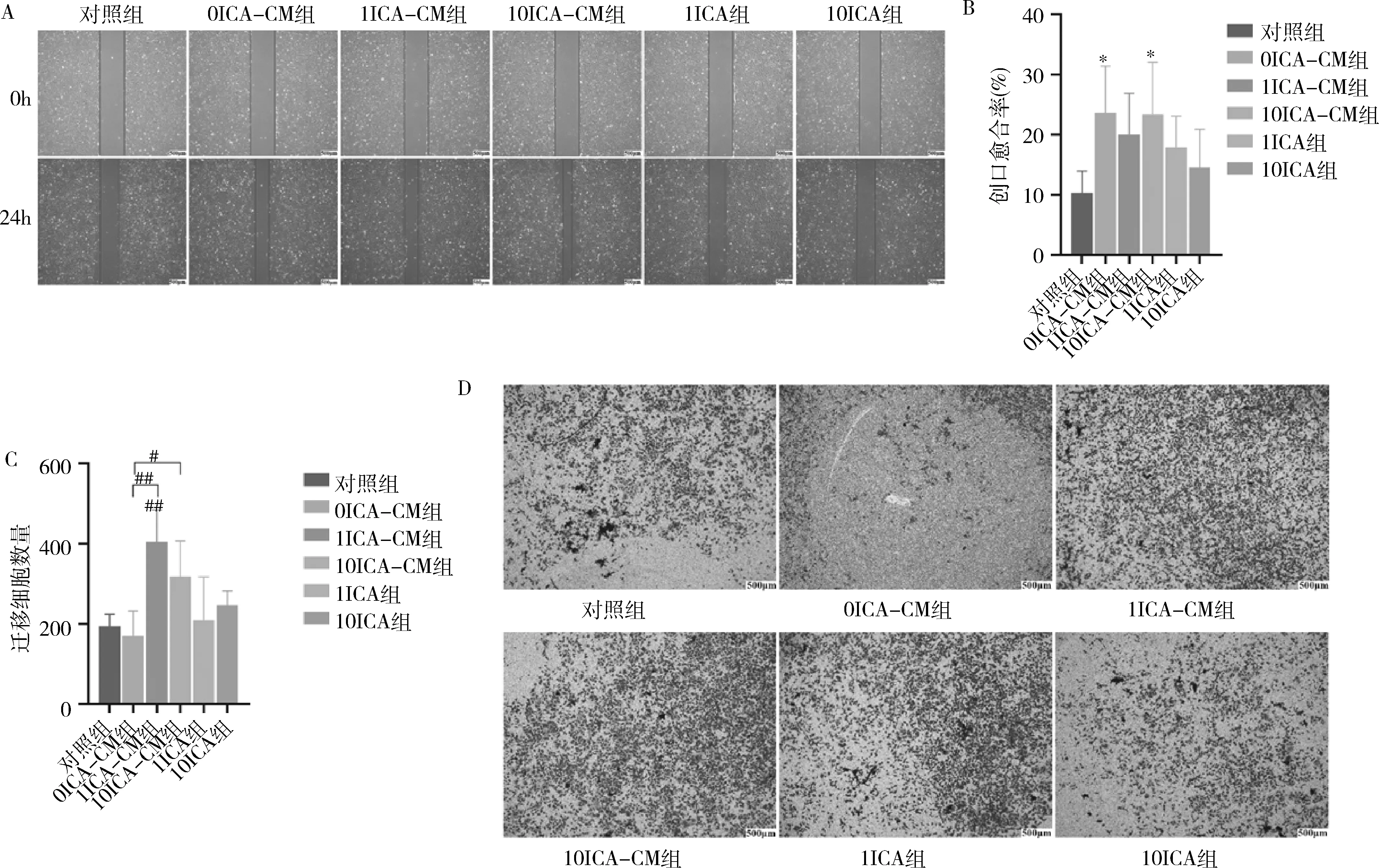
5.細胞遷移檢測:(1)劃痕實驗:按20×10個/孔細胞密度將MC3T3-E1接種在預先底部水平畫線的6孔板上,細胞長滿后,用200μl槍頭垂直水平線劃開3處創口,PBS洗去劃脫細胞,更換無血清實驗組培養基,孵育24h后取出拍照,運用ImageJ軟件計算創口愈合面積。(2)Transwell小室實驗:選用24孔板小室,下室加入500μl實驗組培養基,MC3T3-E1按2×10個/200微升置于上室,12h后固定,結晶紫染色拍照,運用ImageJ軟件計算穿膜細胞數。
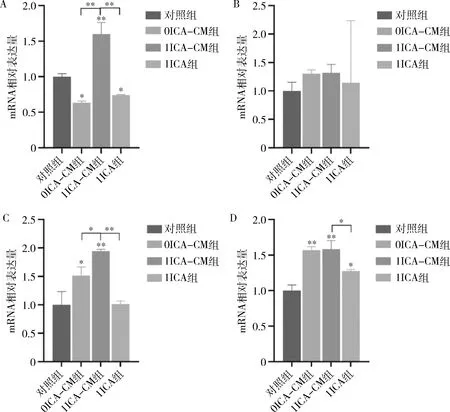
6.qRT-PCR檢測成骨基因表達水平:按照20×10個/孔細胞密度將MC3T3-E1接種在6孔板上,使用成骨誘導培養基(5μmol/L β-磷酸甘油鈉、50μg/ml維生素C、0.01μmol/L地塞米松)誘導7天,使用TRIeasy試劑分離總RNA,反轉錄合成為cDNA。在CFX96 RT-PCR檢測系統中使用 SYBR-Green實時PCR預混液擴增mRNA。表1為引物序列,使用比較2方法計算基因的相對表達水平,3-磷酸甘油醛脫氫酶(GAPDH)用作內部對照。

結 果
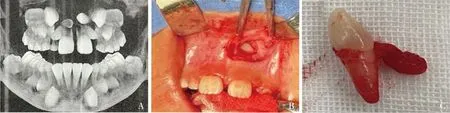
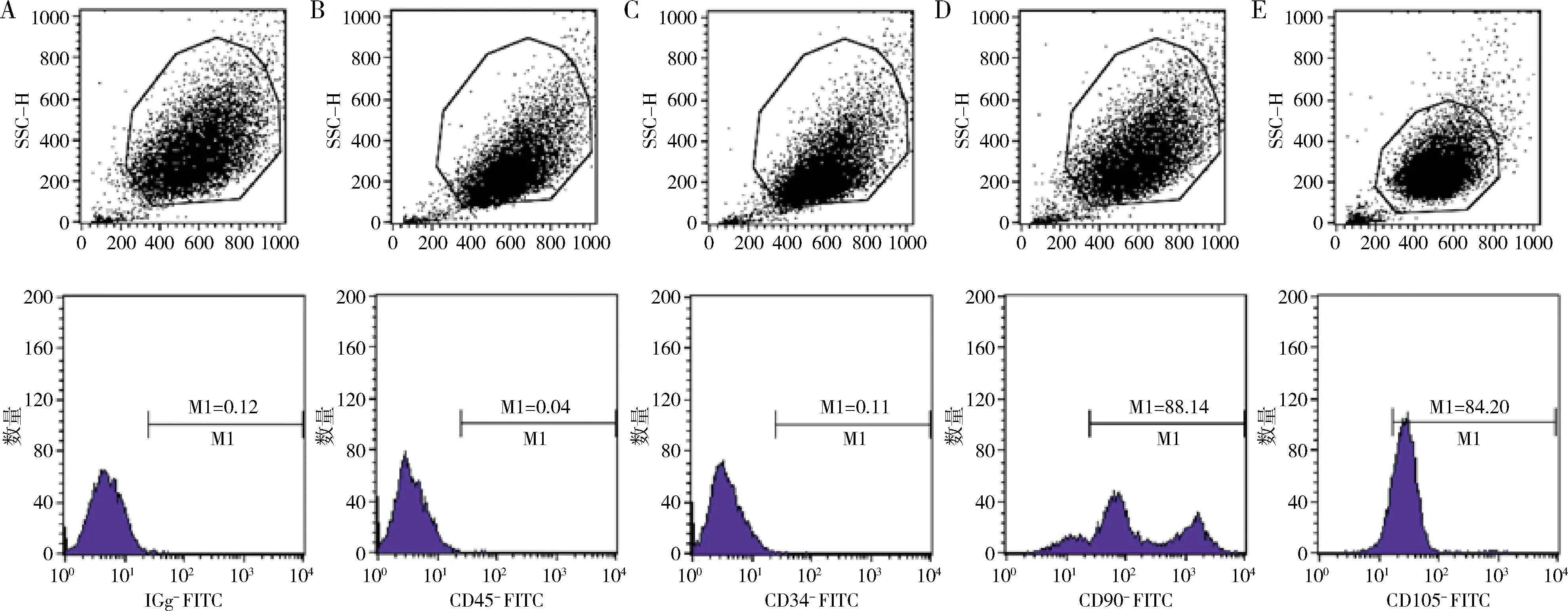
1.細胞分離及鑒定:本實驗取自多生牙患者的牙囊組織(圖1),原代培養3天,可見DFSC從組織塊中爬出,呈長梭形(圖2A),細胞集落呈旋渦狀(圖2D)。免疫細胞化學染色顯示,當DFSC細胞質無著色,上皮標志物角蛋白8表達陰性(圖2B);DFSC細胞質呈棕黃色,間充質標志物波形絲蛋白表達陽性(圖2E)。成骨誘導后,DFSC內可見紅色鈣結節(圖2C);成脂誘導后,DFSC可見到橙紅色脂滴(圖2F)。并且DFSC陽性表達間充質表面標志物CD90(88.14%)、CD105(84.20%),而陰性表達血液細胞表面標志物CD45(0.04%)、CD34(0.11%),同型對照IGg(0.12%)。圖2、圖3結果表明,埋伏多生牙來源的DFSC符合間充質干細胞特征。

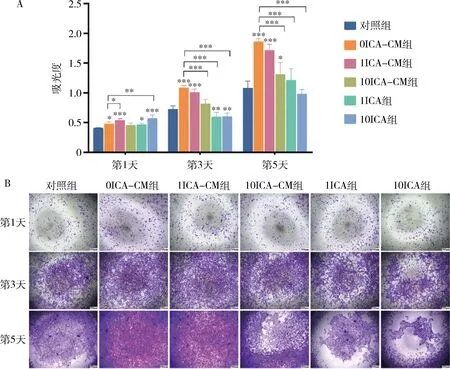
2.ICA誘導的DFSC-CM對MC3T3-E1增殖影響:如圖4A所示,1ICA組和10ICA組在第3天、第5天抑制了MC3T3-E1細胞活力(<0.01),然而10ICA-CM組在培養5天后仍未見明顯毒性,0ICA-CM組與1ICA-CM組在第1天、3天、5天時細胞活力明顯高于對照組(分別為<0.05、<0.01、<0.001)。結晶紫染色顯示(圖4B),0ICA-CM組與1ICA-CM組培養基在第3天、第5天時,細胞數量明顯多于對照組,1ICA組和10ICA組在第5天時細胞數量明顯減少。CCK-8實驗和結晶紫染色實驗結果相符合,因此表明,單純的DFSC-CM可以促進MC3T3-E1的增殖,DFSC-CM緩解了高濃度ICA對MC3T3-E1的毒性作用。
3.ICA誘導的DFSC-CM促進了MC3T3-E1遷移:如圖5中A、B示,MC3T3-E1在劃痕創口形成24h后,0ICA-CM組、1ICA-CM組、10ICA-CM組劃痕創口面積均較對照組小(對照組0.104±0.036;0ICA-CM組0.236±0.078,<0.05;1ICA-CM組0.200±0.069;10ICA-CM組0.234±0.087,<0.05)。Transwell結果表明,各組培養基培養MC3T3-E1 24h后,均有細胞遷移至下室,各CM組隨著ICA誘導劑量的增加,呈現劑量依賴方式(對照組194.000±29.816;0ICA-CM組170.333±62.164;1ICA-CM組404.333±79.651,<0.01;10ICA-CM組318.000±88.792)。1μmol/L ICA誘導的DFSC-CM細胞遷移數量顯著高于0μmol/L和10μmol/L ICA誘導的DFSC-CM(分別為<0.05、<0.01)。
4.ICA誘導的DFSC-CM上調了成骨標志基因的表達:與對照組比較,1ICA-CM組顯著上調了RUNX2的表達水平(圖6A,<0.001),在圖6C中,0ICA-CM組和1ICA-CM組均上調了OCN表達水平(分別為<0.01、<0.001),且與0ICA-CM組比較,1ICA-CM組升高的更多(<0.01),圖6D和圖6C的結果相符,0ICA-CM組和1ICA-CM組均上調了OPN表達水平,差異均有統計學意義(均<0.001)。從qPCR結果可以看出,成骨誘導7天時,ICA誘導的DFSC-CM可以上調成骨標志基因的表達水平。
討 論
多生牙在牙齒發育過程中屬于數目異常。多生牙可以產生如恒牙遲萌,牙列不齊,頜骨囊腫等多種口腔頜面部發育的問題,本實驗應用多生牙患者的牙囊提取牙囊干細胞,無取材和倫理限制,且患者年齡小(4~10周歲),細胞增殖活躍,多生牙來源的DFSC有可能成為間充質干細胞臨床應用的候選種子細胞。
研究表明,間充質干細胞可分泌多種生物活性因子,如血小板生長因子、血管內皮生長因子等,通過細胞外囊泡或者條件培養基的形式改變組織細胞所處的微環境,促進周圍干細胞的增殖、遷移及分化,從而發揮旁分泌作用。近年來研究發現,DFSC-CM可以促進牙周創口愈合,并且鼠DFSC-CM通過下調ERK1/2和NF-κB信號通路拯救發炎的大鼠牙髓再生。
研究表明,ICA常被作為骨誘導因子加載在支架或者納米纖維膜上,通過持續可控的方式釋放,在骨缺損的修復中得到了良好的修復效果。本研究利用ICA作為骨誘導因子,定向調節DFSC-CM的旁分泌作用,促進MC3T3-E1成骨分化。在增殖實驗中,1ICA-CM組與0ICA-CM組比較,ICA與DFSC-CM之間并未起到協同促進MC3T3-E1增殖的作用。據文獻報道,ICA促進鼠MSCs增殖濃度在0.01~0.10μmol/L。筆者前期實驗結果也表明,不同種屬對ICA的耐受程度不同,ICA(0.1~1.0μmol/L)可以促進人DFSC增殖,而ICA(5~20μmol/L)對人DFSC有抑制增殖并促進成骨作用。猜測原因可能是加入的ICA濃度是促進人DFSC成骨分化的最適濃度,DFSC-CM促進細胞增殖和促進細胞成骨可能存在不同的分子機制,因此ICA誘導DFSC旁分泌作用,釋放更多調節成骨分化的細胞因子,而釋放很少的促進增殖的細胞因子。
研究表明,缺損區創口的愈合、組織的生長、炎癥的調節等生理活動都離不開細胞的遷移與趨化。本研究驗證了DFSC-CM可以促進MC3T3-E1的橫向與縱向遷移,說明ICA可以上調DFSC旁分泌作用促進MC3T3-E1遷移。
ALP、OCN、OPN、COL-1等骨特異性基質蛋白、RUNX2、OSX等轉錄因子的表達可以調控ICA誘導的骨形成。本研究發現,0ICA-CM組可以上調OCN及OPN的表達,并且1ICA-CM組與其他組比較,RUNX2、OCN、OPN的表達具有顯著差異性。提示1μmol/L的ICA可能通過促進DFSC成骨的旁分泌作用,從而上調了MC3T3-E1的成骨相關基因的表達。
綜上所述,多生牙來源的DFSC可能成為候選的種子細胞,ICA誘導的DFSC-CM可以促進MC3T3-E1遷移和成骨分化。ICA可能通過調控DFSC旁分泌作用來發揮效果,具體的分子機制需要進一步的實驗研究來驗證。

