多囊卵巢綜合征患者腰圍/身高比值與心血管疾病危險指標相關性研究
高金金 王美玲
多囊卵巢綜合征(polycystic ovarian syndrome,PCOS)是一種發病多因性、臨床表現高度異質,以長期無排卵和雄激素分泌過多為特征的臨床綜合征。患者通常存在胰島素抵抗(insulin resistance,IR),且發生代謝綜合征、糖尿病、高血脂、心腦血管疾病和子宮內膜癌等遠期并發癥的風險更高,PCOS患者常伴有肥胖、代謝異常、IR、血栓前狀態等,導致高血壓及冠狀動脈粥樣硬化性心臟病發病風險增加,IR的增加與甘油三酯升高和膽固醇水平下降有關,這是促進冠狀動脈粥樣硬化性心臟病發生的潛在因素,增加了PCOS患者出現心血管疾病的風險。因此,在PCOS的病理改變中,明確PCOS與心血管疾病危險因素間的相關性,可有效地對心血管疾病結局進行早期干預。
腰圍(cm)/身高(cm)比值(waist-to-height ratio,WHtR),是近年來被推薦可替代腰圍(waist circumference,WC)和腰臀比(waist-to-hip ratio,WHR)的腹型肥胖判斷指標。WHtR較WHR更方便測量,同時避免了WC測量時因皮下脂肪過多而非腹內脂肪過度堆積帶來的干擾。WHtR校正了年齡、身高和種族的設定,且人群差異度小,使得其在預測心腦血管疾病危險因素中具有一定的優越性。《中國成人超重與肥胖癥預防控制指南》指出,WHtR≥0.50為超標,與國際上目前比較公認的中心性肥胖切點值的標準一致。因此,本研究選取0.5為WHtR的切點值,旨在觀察不同WHtR值的PCOS患者臨床特征及WHtR與心血管疾病危險指標的相關性,為防治PCOS遠期并發癥提供理論依據。
對象與方法
1.一般資料:回顧性分析2019年4月~2020年10月于山西省中西醫結合醫院確診為PCOS的118例患者的臨床資料,患者均簽署知情同意。根據WHtR水平將PCOS患者分為WHtR<0.5組(=52)和WHtR≥0.5組(=66)。本研究通過筆者醫院醫學倫理學委員會審批(倫理審批號:ZXY2022JY003)。
2.診斷標準:PCOS診斷標準參照2003 年鹿特丹聯合修訂的診斷標準。胰島素抵抗指數(HOMA-IR)≥2.69判定為IR。
3.納入標準:年齡19~39歲,符合PCOS診斷標準。
4.排除標準:①其他原因所致的與PCOS臨床和內分泌征象相仿的疾病;②近3個月應用過激素類藥物和避孕藥者;③患有嚴重心臟、肝臟、肺、腎臟等臟器疾病、精神系統疾病或認知障礙者及糖尿病。
5.觀察指標:(1)一般臨床特征:年齡、收縮壓、舒張壓、身高、體重、WHtR、體重指數(body mass index,BMI)、腰圍、臀圍、WHR。身高、體重測量標準:患者赤足免冠測量身高、體重。身高單位為米(m),數據精確到0.01m,體重單位為千克(kg),數據精確到0.1kg,體重指數(BMI)=體重(kg)/身高(m)。腰圍、臀圍測量標準:患者著貼身衣物,測量腰圍,直立雙臂自然下垂,正常呼吸。腰圍:測臍1周;臀圍:測臀部最大徑線,單位為厘米(cm),數據記錄精確到0.1cm,計算WHR=腰圍/臀圍。(2) 生化特征:①性激素指標:患者于自然月經周期或孕激素撤退出血的3~5天檢測性激素指標,囑患者檢查前一日晚20:00時后禁食、禁水,于次日上午8:00~10:00時之間肘靜脈采血15ml,血清標本采用免疫法檢測,包括促卵泡激素(follicle stimulating hormone,FSH)、黃體生成素 (luteinizing hormone,LH)、睪酮(testosterone,T)以及計算LH/FSH比值;②糖脂代謝指標:囑患者禁食12h以上,于次日清晨8:00時空腹采血,測定甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TC)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、載脂蛋白A1(apoli-poprotein A,ApoA1)、載脂蛋白B(apoli-poprotein B,ApoB)、尿酸(uric acid,UA)、空腹葡萄糖(fasting plasma glucose,FPG)、空腹胰島素(fast insuline,FINS),并計算HOMA-IR。以上指標由山西省中西醫結合醫院檢驗科測定。
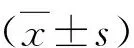
結 果
1.臨床特征比較:兩組年齡均具有可比性。WHtR≥0.5組體重、BMI、腰圍、臀圍、WHR、舒張壓均顯著高于WHtR<0.5組,差異均有統計學意義(均<0.05)。兩組年齡、身高、收縮壓比較,差異均無統計學意義(均>0.05,表1)。
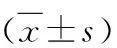
2.性激素水平比較:WHtR≥0.5組LH、LH/FSH均顯著低于WHtR<0.5組,差異均有統計學意義(均<0.05)。兩組FSH、T比較,差異均無統計學意義(均>0.05,表2)。
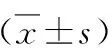
3.糖脂代謝指標比較:WHtR≥0.5組FPG、FINS、HOMA-IR、TG、ApoB、UA均顯著高于WHtR<0.5組,差異有統計學意義(<0.05)。WHtR≥0.5組HDL顯著低于WHtR<0.5組,差異有統計學意義(<0.05)。兩組TC、LDL、ApoA1水平比較,差異無統計學意義(>0.05,表3)。
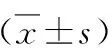
4.PCOS患者WHtR與心血管疾病危險因素的相關性分析:WHtR與收縮壓、舒張壓、BMI、FPG、TG、LDL、UA呈正相關(<0.05),與HDL呈負相關(<0.05),與TC無相關性(>0.05,表4)。

討 論
臨床上約半數以上的PCOS患者合并超重或肥胖,同時肥胖也是心血管疾病的獨立危險因素。本研究結果顯示,WHtR≥0.5組BMI和WHR高于WHtR<0.5組,存在超重并表現為更明顯的腹型肥胖,腹型肥胖可以增加2型糖尿病、心血管疾病、代謝性疾病的發病風險。WHR>0.85表示存在雄激素性脂肪分布,是脂肪積累在腹壁和內臟系膜處的結果。研究表明,PCOS患者脂肪組織分泌過多的脂肪因子導致缺氧和慢性炎癥發生,且BMI越高,越能刺激炎性因子參與IR的過程,即相對于皮下脂肪,內臟脂肪的代謝和炎癥活動更活躍。高血壓是心血管疾病的主要危險因素,一項針對中國PCOS患者的研究顯示,PCOS合并高血壓的患病率為19.2%。肥胖可增加高血壓的發病風險,本研究WHtR≥0.5組的舒張壓顯著高于WHtR<0.5組,提示隨著WHtR的增加,PCOS患者發生高血壓的風險也隨之增加,說明PCOS高血壓的發生還可能與脂肪組織的聚集部位有關,但舒張壓的升高能否作為PCOS發生心血管疾病的獨立危險因素還有待于進一步研究。
高雄激素血癥是PCOS的基本特征之一,本研究中,WHtR≥0.5組較WHtR<0.5組患者表現為高T水平,且WHtR≥0.5組表現為明顯的IR和高胰島素血癥。IR在PCOS發病機制中起著重要作用,當胰島素受體被阻斷或數量下降時,增加了卵泡膜細胞雄激素的合成,使雄激素分泌過多,出現卵泡發育和成熟障礙。高胰島素血癥導致高血壓及冠狀動脈粥樣硬化性心臟病發病風險增加。IR的增加與TG升高有關,這是促進冠狀動脈粥樣硬化性心臟病發生的潛在因素。
糖脂代謝紊亂是PCOS的主要臨床特征,脂肪組織代謝活性度高,患者常表現為高脂血癥。由于PCOS患者表現為明顯的腹型肥胖,其堆積在腹部的脂肪經脂肪酸合成酶的作用,促進了TG的合成,且PCOS患者體內的高雄狀態能增加體內脂蛋白酯酶的活性,增加TG、TC含量。本研究中WHtR≥0.5組表現為明顯的TG升高,HDL減低,提示WHtR≥0.5組有明顯的血脂代謝異常,WHtR≥0.5組TC水平高于WHtR<0.5組,但差異無統計學意義。ApoB是LDL受體配體,能準確反映動脈粥樣硬化循環蛋白總量,從而反映脂質異常和潛在動脈粥樣硬化的風險。本研究中WHtR≥0.5組的ApoB水平顯著高于WHtR<0.5組,提示該組患者發生心血管疾病的風險較WHtR<0.5組高。雖然PCOS女性常存在脂質和脂蛋白的異常狀態,但一般在生育年齡不出現高血壓,隨著年齡增長才會表現出來。如果WHtR能夠控制在0.5以下,則可以對PCOS患者出現高血壓、空腹血糖升高、血脂異常以及其他危險因素起到預防作用。
PCOS患者發生心血管疾病的機制目前尚不明確,國內外學者研究發現,炎性因子、血脂參數和人體測量學指標(包括體重指數、腰臀比、腰圍、臀圍等)可作為PCOS發生心血管疾病預測標志物。對WHtR與心血管疾病危險指標進行相關性分析,發現WHtR與收縮壓、舒張壓、BMI、FPG、TG、LDL、UA呈正相關,與HDL呈負相關。WHtR≥0.5組TG水平升高的原因,可能是由于血小板過度活化導致的動脈粥樣硬化血栓形成。有研究指出,HDL對動脈粥樣硬化具有拮抗作用,可通過減少血液黏度來抑制血小板聚集和紅細胞凝集,從而消除血栓。反之, HDL-C降低則增加了PCOS患者出現心血管疾病的風險。尿酸是嘌呤代謝的終產物,在糖脂代謝中發揮著重要作用。血清尿酸的水平可直接影響血清脂聯素水平,尿酸通過誘導脂肪細胞發生炎性反應和氧化應激反應,抑制脂聯素的生成,降低胰島素的敏感度,進而發生代謝綜合征。同時,高尿酸血癥會增加心血管疾病、肥胖的發生風險,血清尿酸可作為心血管疾病風險、肥胖的預測因子。本研究中WHtR與血清尿酸呈正相關,提示脂肪堆積尤其是內臟脂肪堆積增加高尿酸血癥的發生。
綜上所述,本研究發現,WHtR與主要心血管疾病危險因素收縮壓、舒張壓、BMI、FPG、TG、LDL、UA、HDL具有相關性,而心血管風險的改善與中心型脂肪的減少相關,因此,PCOS患者通過改善生活方式、控制體重可降低WHtR值,從而預防和延緩心血管疾病的發生。在臨床診療過程中,應加大對該類患者的監測,以減少遠期心血管疾病的發生風險。

