鮮黃花菜衰老機制與采后貯藏保鮮技術研究進展
李可昕,張超凡,劉佩冶,趙玉梅,曹建康
(中國農業大學食品科學與營養工程學院,北京 100083)
黃花菜(Baroni)又稱“金針菜”“忘憂草”,一般被認為是百合科、萱草屬的多年生草本植物。但是根據《中國植物志》和黃花菜葉綠體全基因組的報道,黃花菜已被更新為阿福花科(Asphodelaceae)萱草屬植物。黃花菜常以新鮮花蕾或干制品食用。黃花菜富含多種生物活性化合物,具有防治炎癥、失眠和抑郁癥等功能。黃花菜開花時正值6—8月高溫多雨季節,新鮮黃花菜(花蕾)采摘后生命活動仍非常旺盛,具有強烈的呼吸作用和蒸騰作用,極易發生花蕾開放和衰老,出現變黃、失水、萎蔫、甚至腐爛等現象,從而嚴重影響商品價值。為此,本文系統地綜述了近年來鮮黃花菜采后衰老的生物學變化、生理生化代謝機制、影響因素,以及貯藏保鮮技術等方面的研究進展,以期為鮮黃花菜采后衰老機制研究與貯藏保鮮技術開發探索發展方向。
1 鮮黃花菜衰老的生物學特性
1.1 外觀及品質變化
黃花菜的花由3 片花瓣、3 片萼片組成。花粉通常為棕色、紅色或黃色。黃花菜劃分為白天開花類群和夜間開花類群。生產上一般于花蕾開放前采收。黃花菜花蕾(可食用部分)一旦開放后迅速進入衰老階段(圖1)。隨著衰老,花的鮮質量和干質量下降,花瓣組織呈水浸狀。黃花菜采后在常溫下很快失水,容易出現花蕾松動、萎蔫;第2天,大部分花蕾開放,花瓣顏色變黃,部分褐變;第3天時出現嚴重褐變、腐敗變質,甚至有霉菌生長和異味。研究表明,保持黃花菜鮮嫩狀態和成熟花蕾開放所需的膨脹壓力是由原生質膜的半滲透性來提供的,組織衰老過程中因細胞膜完整性的破壞和水分散失,從而出現萎蔫現象。

圖1 不同發育與開放時期的黃花菜[5]Fig. 1 Photographs of daylily in different stages of development and blooming[5]
研究表明,果聚糖代謝在黃花菜的發育與開花過程中起著重要作用,在花朵開放時,果聚糖水解為葡萄糖和果糖,導致滲透壓增加,能夠吸收水分和維持花瓣膨脹舒張狀態。研究還發現,在衰老時,花中的大多數可溶性碳水化合物和氨基酸通過韌皮部轉移,被植株其他部位吸收,尤其花瓣中碳水化合物的流出量明顯增加。蛋白質組學分析表明,在黃花菜衰老過程中,己糖(主要是半乳糖、果糖和葡萄糖)代謝在基因本體(gene ontology,GO)分類上顯著富集,其中,半乳糖代謝可能是與黃花菜短暫壽命相關的核心途徑。黃花菜采收后品質迅速劣變,總糖、可溶性糖、還原糖、可溶性固形物、VC、葉綠素含量呈不斷下降趨勢。但也有研究認為,采后黃花菜還原糖、可溶性固形物含量呈先上升后下降的趨勢。因此,對于鮮黃花菜采后衰老過程內在品質變化的研究還有待深入。
1.2 細胞結構變化
在黃花菜的衰老過程中花瓣細胞的大小、形狀和細胞間黏附作用發生了很大的變化。微觀結構觀察結果表明,開花前36 h,花瓣細胞呈圓形并緊緊地包裹在一起;在開花前12 h時,細胞擴大,橫截面變厚但包裹不緊密;在開花后12 h,細胞仍然較大但形狀不規則,形成了網狀圖案;在開花后的24 h,細胞之間的空隙開始消失,細胞開始降解。黃花菜衰老可能是一種遺傳調控的程序性細胞死亡(programmed cell death,PCD)。PCD是多細胞真核生物用來清除系統中多余和受損細胞的基本機制,受多種途徑控制。在發生PCD時出現細胞皺縮、DNA片段化、凋亡小體形成和吞噬作用。黃花菜衰老過程中會出現由蛋白酶激活引起的蛋白質降解,由核酸酶激活導致的核酸損失、DNA片段化以及由酶介導的碳水化合物多聚物的改變。但是,目前黃花菜PCD機制涉及的許多復雜生化途徑多為研究者們的推測,仍缺乏直接的證據。
在鮮黃花菜采后衰老過程中,細胞壁物質相關酶活性變化很大,使細胞壁結構與強度改變,從而導致了花瓣細胞形態結構的改變。黃花菜開花后多聚半乳糖醛酸酶、-半乳糖苷酶和纖維素酶活性增加,內切-1,4--葡聚糖酶轉錄物的豐度增加。這些酶可能參與了細胞壁物質的降解,使碳水化合物轉移到植株的其他部位。研究發現兼產果膠酶和纖維素酶的黑曲霉可刺激黃花菜花瓣的衰老,伴隨著糖醛酸物質含量的增加和離子泄漏,這些變化與脂氧合酶活性增加導致的脂質過氧化和膜通透性喪失有關。黃花菜衰老早期(開花后10~13 h),細胞膜磷脂合成過程被抑制,磷酸己糖的比例下降,磷脂前體的比例大幅增加,花瓣的表觀自由空間從30%增加到38%。目前缺乏采后衰老過程中鮮黃花菜微觀結構變化的報道。生長期黃花菜衰老的細胞組織學變化可為采后研究提供理論依據和思路。
2 鮮黃花菜采后衰老的影響因素
2.1 黃花菜品種
黃花菜在湖南、山西、甘肅、陜西、浙江、四川等地都有種植,形成了眾多的地方特色品種,現有栽培種近50 種、野生種10余種。湖南省祁東縣主栽品種為‘祁珍花’‘白花’‘猛子花’;四川省渠縣主栽品種為‘渠縣花’‘武坪早’‘沖里花’;甘肅慶陽以‘馬藺黃花’質量最佳;‘沙苑金針’為陜西大荔縣主栽品種。各品種采后衰老進程存在一定的差異,但缺乏系統的研究。總地來說,中、晚熟品種黃花菜采收期相對較晚,采后衰老進程稍慢,比較適宜貯藏,可以延長鮮黃花菜的供應時間。從目前的研究來看,栽培較廣泛的‘猛子花’‘白花’‘大烏嘴’等采后衰老較慢,在貯藏過程中質量損失率、開花率、腐爛率低,還原糖含量維持在較高的水平,較耐貯藏。而‘蕃龍花’‘明針針’等采后衰老相對較快,貯藏時間較短。
2.2 黃花菜生長發育程度
黃花菜一般在抽薹現蕾期后進行采收,采收時生長發育程度會影響其貯藏性。采收過早,生長發育程度過低,花蕾生長發育不完全,食用品質和風味未形成。采收過晚,生長發育程度過高,花蕾膨大,采收后極易開花、衰老。研究發現,以花表皮顏色1/3轉黃、平均花長7.5~9.0 cm的八成黃花菜最適宜采收和貯藏。黃花菜具體采收時的生長發育程度因品種、產地、用途而異。
2.3 貯藏溫度
溫度是影響黃花菜開花與采后衰老最重要的環境因素。鮮黃花菜在采后常溫(20~35 ℃)條件下放置1 d時花蕾就會全部開放,發生明顯黃化,采后3 d時嚴重失水干縮。低溫(0~5 ℃)貯藏能夠有效地抑制鮮黃花菜的衰老進程,但是不同研究者報道的結果差異非常大。許國寧等研究表明新鮮黃花菜在3 ℃條件下貯藏6~7 d開始腐爛;龔吉軍報道黃花菜在2 ℃下貯藏,外加保鮮劑處理,28 d時仍有商品價值;高建曉等發現在0~2 ℃條件下貯藏黃花菜,保鮮期可達14 d;張欣等報道0~1 ℃條件下貯藏鮮黃花菜,30 d時好花率達99.47%。研究發現黃花菜花蕾在低溫下仍具有伸長、開放的能力,但對其低溫生長開花的機制尚不清楚。因此,黃花菜采后低溫生物學特性仍需深入研究。
2.4 貯藏相對濕度
相對濕度是影響黃花菜采后衰老、失水萎蔫的重要環境因素之一。較高相對濕度可以降低黃花菜蒸騰速度,減緩水分的散失,延遲黃花菜的萎蔫與褐變,但是有利于微生物的繁殖,會促進黃花菜的腐爛。相對濕度過低會引起黃花菜過快失水萎蔫。貯藏濕度的選擇與貯藏溫度、包裝材料等因素相關。普遍在較高的相對濕度條件下貯藏黃花菜,如相對濕度70%~80%或80%~90%。
2.5 貯藏環境氣體成分
貯藏環境中適宜的O、CO氣體成分比例能夠起到良好的保鮮作用。研究表明,當O體積分數為2.5%時能夠有效抑制黃花菜的采后衰老。黃花菜對CO氣體耐受程度較高,采用較高體積分數CO(14%~16%)處理可以明顯地降低黃花菜采后的質量損失率,抑制退綠變黃和開花衰老進程,降低腐爛率,形成較好的保鮮效果。但是,目前尚缺少對黃花菜O、CO耐受的臨界點以及適宜的氣體成分組合的深入研究。
3 鮮黃花菜衰老生理及機制
3.1 呼吸代謝
Bieleski等研究發現,黃花菜開花時呼吸速率穩定地保持在480 mg CO/(kg·h),呼吸速率在開花16 h時開始增加,在20 h完全開花時達到峰值,約為600 mg CO/(kg·h),然后緩慢降低至約320 mg CO/(kg·h),黃花菜的品質隨之明顯劣變。黃花菜開花過程中呼吸代謝受到授粉的影響,可能出現抗氰呼吸,但是還缺少實驗證實。不同的研究表明,采后黃花菜呼吸強度的變化趨勢多樣,這可能是受到發育程度和貯藏溫度的影響。如黃花菜在2 ℃貯藏時,前3 d呼吸強度迅速下降,之后呼吸強度變化很小。使用帶孔聚乙烯薄膜袋包裝的黃花菜置于冷庫(0~2 ℃)貯藏21 d,呼吸強度整體也呈現下降趨勢。另有研究發現,黃花菜在室溫保鮮袋貯藏7 d,呼吸強度整體呈現先上升后下降的趨勢;新鮮黃花菜于(4.0±0.5)℃貯藏12 d,呼吸強度也呈先上升后下降的趨勢。采后及時預冷能夠顯著降低貯藏過程中黃花菜的呼吸強度。在適宜的低溫、低O和CO濃度條件下貯藏可以有效抑制黃花菜的呼吸強度,延緩采后衰老進程。
3.2 激素代謝
乙烯可以調節許多植物的開花、成熟與衰老進程。花瓣衰老過程中乙烯生成速率快速增加,授粉可導致乙烯產量的激增,乙烯合成途徑中的關鍵基因表達上調。黃花菜從花芽生長到花朵開放,乙烯產量極低,但是隨著花開始衰老,乙烯的產量瞬間提高,隨后又維持在較低水平,其中的乙烯大部分來自花瓣。Lay-Yee等認為黃花菜屬于乙烯不敏感型,外源乙烯或乙烯生物合成抑制劑處理都不會改變黃花菜衰老進程。關于乙烯在黃花菜發育與衰老過程中的作用還有待深入研究。黃花菜內源乙烯的代謝規律、相關基因的表達與調控、外源乙烯對黃花菜呼吸作用和內源乙烯合成的影響尚不清楚。
脫落酸可促進植物器官的衰老和脫落,在切花的衰老中具有重要的調控作用,脫落酸含量越高,切花壽命越短,切花衰老時脫落酸含量增加。脫落酸可能是介導乙烯不敏感型物種花瓣衰老過程的重要激素信號。Panavas等研究表明,脫落酸參與了黃花菜花瓣的衰老,內源脫落酸含量在黃花菜開花前增加,在花瓣衰老期間繼續增加;外源脫落酸會引起黃花菜衰老,促進脂質過氧化作用和離子泄漏,增強蛋白酶和核糖核酸酶活性。研究發現,在采后貯藏過程中黃花菜中脫落酸含量不斷增加,外源2,4-表油菜素內酯處理可以有效地抑制內源脫落酸的產生,延緩黃花菜的衰老。
植物激素對黃花菜采后衰老進程的調控是一個復雜的過程,該過程不止取決于某一種激素絕對濃度的變化,內源激素間的相互平衡及協同作用更為重要。有關黃花菜內源激素的代謝水平、消長平衡與基因表達的關系,以及植物激素對黃花菜采后衰老調控的分子機理還有待進一步研究。
3.3 衰老相關基因表達
一些基因在非衰老組織中以基礎水平表達,而在衰老組織中或衰老過程中表達量明顯增加,這類基因被稱為衰老相關基因(senescence-associated gene,SAG)。在黃花菜衰老過程中,DNA片段化的細胞核數目增加,各種核酸酶的活性也明顯增加。Panavas等分析了黃花菜花瓣中與衰老相關的6 個cDNA,通過同源分析推測DSA3為含有細胞色素P450的脂肪酸羥化酶,DSA4為天冬氨酸蛋白酶,DSA5未鑒定,DSA6為核酸酶,DSA12為丙二烯氧合酶,DSA15為脂肪酸延伸酶,并且這些DSA的mRNA主要在花瓣衰老過程中積累,而不是在所有衰老器官中積累。Yang Huanhuan等通過轉錄組學分析了黃花菜6 個發育階段(其中花的開放和衰老是黃花菜發育中最重要的過程)的相關基因,將23 019 個基因歸屬于8 個生物學過程,包括DNA代謝、脂質代謝、轉運、細胞間信號傳導、多細胞生物發育、晝夜節律、細胞死亡、花的發育。
環境因素(包括光周期、溫度)和內源信號都影響植物從營養生長向生殖生長的轉變。春化是指將植物暴露在寒冷環境中一定時間來促使其開花。春化作用會通過降低開花抑制基因的表達、激活開花控制基因來促進開花,能將光周期、春化和自主途徑所感知的信號整合在一起,編碼觸發成花的誘導信號,以正確響應不斷變化的環境。基因是典型的R1類MYB轉錄因子,研究表明,黃花菜生物鐘基因在開花前12 h時在花瓣中表達量最高,顯著高于葉片、雌蕊、雄蕊、花萼及根。黃花菜開花節律及光周期調節的關鍵基因能在光暗交替時期呈現出高表達,該基因的表達具有明顯時間差異性和生物鐘調節特性。采后低溫貯藏期間黃花菜的開花與衰老是否也受到和、、的調控非常值得研究,對于從根本上深入揭示黃花菜采后衰老進程具有重要意義。
3.4 蛋白質合成與降解
PCD依賴于蛋白質的合成與降解。黃花菜開花后可溶性蛋白、微粒體蛋白、質體蛋白水平降低。黃花菜花瓣的PCD涉及蛋白酶的活性增加,而羧肽酶的活性在整個衰老過程中保持相對不變;亮氨酸氨基肽酶的活性增加,并且比內肽酶提前數小時達到峰值。推測亮氨酸氨基肽酶可能在開花期間參與了蛋白質的運輸,且在花瓣衰老相關蛋白質水解的起始過程中起作用,而內肽酶可能負責開花后期大部分蛋白質的水解。Guerrero等發現,在黃花菜花瓣衰老過程中兩個巰基蛋白酶基因(和)表達量增加;使用赤霉素處理開花的黃花菜時和的轉錄本增加。Valpuesta等分離鑒定出了一個與花衰老密切相關的半胱氨酸蛋白酶基因。Ma Guangying等發現,在黃花菜衰老過程中至少有2 種轉化酶(催化蔗糖轉化為果糖和葡萄糖的酶)、3 種天冬氨酸蛋白酶、1 種半胱氨酸蛋白酶和1 種巰基蛋白酶的表達量上升。黃花菜衰老過程中表達的天冬氨酸蛋白酶、半胱氨酸蛋白酶和枯草桿菌類絲氨酸蛋白酶可能是氨基酸重組所需的水解蛋白酶,也可能是引發花序PCD的凋亡蛋白酶,蛋白磷酸酶的表達可能參與了PCD的信號轉導途徑。泛素-蛋白水解途徑對于黃花菜花發育和衰老過程中特定蛋白質的選擇性分解代謝很重要。在黃花菜發育和衰老過程中,在花瓣中檢測到多達100 種泛素-蛋白質結合物,隨著衰老過程的進行,蛋白質泛素化的模式發生了變化。環己酰亞胺作為蛋白質翻譯的抑制劑,能夠抑制黃花菜的開放和呼吸躍變,延緩衰老。用環己酰亞胺處理黃花菜,可以阻止大多數蛋白質的泛素化并抑制蛋白質的水解。
3.5 活性氧代謝
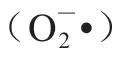
Panavas等研究發現黃花菜開放之前,脂質過氧化作用增加,并伴隨著脂氧合酶活性的增加以及HO含量的升高,在開花后10 h時HO含量再次升高,此時花已經衰老。這表明ROS不僅在花開放中起作用,在衰老中也起作用。黃花菜在衰老過程中HO等自由基的積累能誘發脂質過氧化作用增強和丙二醛(malondialdehyde,MDA)積累,造成細胞膜透性增加和電解質外泄。黃花菜衰老過程中ROS水平的變化與自由基清除系統的作用密切相關。黃花菜ROS水平的升高與過氧化氫酶(catalase,CAT)和抗壞血酸過氧化物酶(ascorbate peroxidase,APX)比活力降低、抗壞血酸含量降低以及超氧化物歧化酶(superoxide dismutase,SOD)和過氧化物酶(peroxiredoxin,POX)比活力的增加有關。Chakrabarty等從黃花菜中檢測到3 種SOD同工酶,其中SOD-III同工酶的活性最大,檢測到3 種APX同工酶,它們在衰老的不同階段差異表達,并且發現黃花菜在衰老過程中內源性HO含量顯著下降。
4 鮮黃花菜采后貯藏保鮮技術
4.1 低溫貯藏保鮮
低溫(0~5 ℃)貯藏可有效延長黃花菜采后壽命,其中,以0~2 ℃較為適宜。黃花菜的最低冷藏溫度可達-1 ℃。如果貯運溫度不適宜,可能引起黃花菜出現褐變、組織潰爛和品質下降。采后及時預冷、低溫貯藏和冷鏈運輸是鮮黃花菜貯運保鮮的適宜方式,而且經真空預冷的黃花菜呼吸強度明顯低于冷庫預冷。
4.2 氣調包裝保鮮
氣調包裝(modified atmosphere packaging,MAP)又稱自發氣調保鮮包裝。當包裝薄膜對于O和CO的氣體滲透率與果蔬自發呼吸代謝消耗O和產生CO的速率達到一定的比值時,會在包裝中建立平衡的氣體比例。MAP中的氣體混合比例取決于產品的種類、包裝材料和貯藏溫度。黃花菜MAP微環境中可形成較高CO和較低O的比例,能夠抑制呼吸強度,起到延緩衰老的作用。不同條件下MAP貯藏黃花菜的保鮮效果見表1。黃花菜的MAP保鮮操作方便、效果顯著,具有一定的實際應用價值。
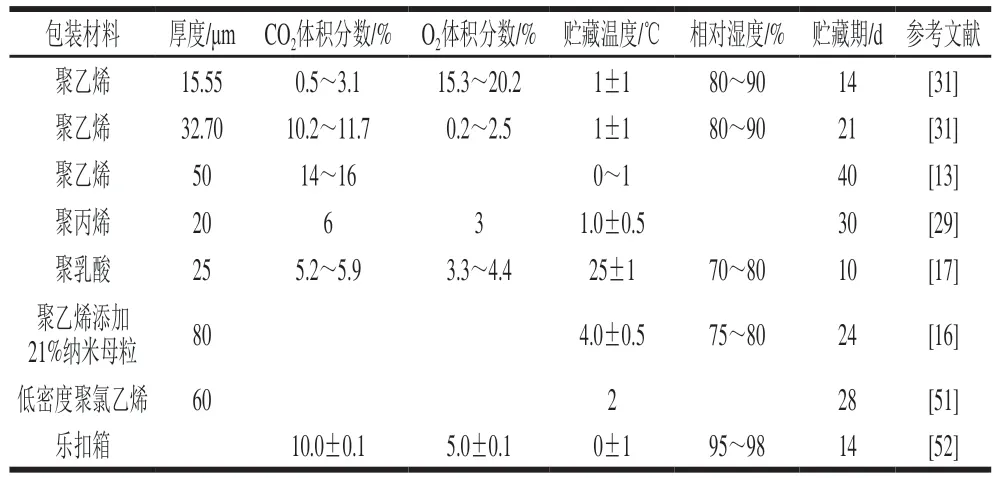
表1 不同條件下MAP貯藏黃花菜的保鮮效果Table 1 Different modified atmosphere packaging conditions for postharvest preservation of daylily
4.3 化學保鮮
4.3.1 1-甲基環丙烯
1-甲基環丙烯(1-methylcyclopropene,1-MCP)能夠不可逆地與果蔬細胞的乙烯受體結合,通過阻斷乙烯的作用與信號轉導,強烈地抑制乙烯的生理效應,從而對呼吸代謝等多種生理代謝過程產生抑制。1-MCP處理能夠減緩果蔬的成熟和軟化,延緩花瓣組織膨脹壓力的喪失和衰老。研究發現,經過250 μL/L 1-MCP處理的黃花菜可在室溫(22~25 ℃)下貯藏7 d。1.5 μL/L 1-MCP結合冷庫預冷處理的黃花菜可貯藏18 d,好花率提高,質量損失率、開花率和腐爛率降低。
4.3.2 植物生長調節劑
4.3.3 小分子信號物質干預保鮮
近年來研究證實,一些小分子信號物質對植物體具有重要的生理調節作用。Liu Dan等研究發現黃花菜在采后衰老過程中,內源性硫化氫(HS)產生量逐漸減少,HS動態平衡受到破壞。外源施用硫氫化鈉(NaHS)釋放HS熏蒸處理可降低黃花菜MDA含量,激活抗氧化酶,保持較高水平的總葉綠素和可溶性蛋白,延遲PCD,從而延緩黃花菜采后的衰老。甲烷(CH)也是一種信號分子,可以在多種非生物脅迫中保護植物組織免受氧化損傷。研究發現,內源性CH水平的升高能減緩黃花菜的衰老進程,而其水平降低會加劇衰老進程。外源施用CH可以顯著降低黃花菜的呼吸速率,抑制組織褐變,極大地減緩黃花菜采后衰老進程。
4.4 輻照保鮮
通常使用γ射線、X射線或電子束對新鮮果蔬進行輻射處理,可抑制貯藏過程中發芽、微生物繁殖和病蟲害的發生。研究發現,低劑量(0.5~1.0 kGy)Co放射源γ射線輻照相比高劑量(4.0~8.0 kGy)輻照,可以延長黃花菜貯藏時間,在相同輻射劑量時,不同劑量率(0.500、0.250、0.167 kGy/h)對保鮮效果沒有影響。但有研究認為,1.0 kGy或更高劑量的γ射線輻照會使黃花菜花瓣表皮細胞受損。因此,黃花菜的輻照保鮮技術需更加細致地進行研究。
5 結 語
黃花菜營養豐富、品質獨特,具有極高的食用價值與醫療保健作用。但鮮黃花菜采后極易泛黃、褐變、枯萎、腐爛,嚴重影響其經濟價值。經過近年來的研究,人們對鮮黃花菜的生長、開放、衰老生物學機制有了一定的認識,從細胞學、分子生物學等方面解釋了黃花菜衰老機制,探討了采后保鮮的機理,開發了物理、化學的采后處理保鮮技術。然而,鮮黃花菜采后生物學研究還不夠深入。目前,主要通過低溫處理來延長貯藏期。因此研究鮮黃花菜采后衰老機制與貯藏保鮮技術對于促進黃花菜產業的發展具有重要意義。
基于黃花菜采后衰老的機制以及貯藏保鮮特性,建議應從以下幾個方面著重研究:1)深入研究黃花菜內源激素的代謝水平和變化規律,以及外源激素對其采后衰老調控機理;2)加強黃花菜采后衰老分子水平的研究,篩選采后衰老等關鍵的調控因子,利用基因組學、轉錄組學、代謝組學等技術,從分子生物學層面揭示黃花菜采后衰老調控機制;3)開發新的貯藏保鮮技術,嘗試低溫貯藏與其他保鮮技術聯合應用,通過協同作用達到更好的保鮮效果,并結合規范的冷鏈物流措施,延長鮮黃花菜的供應期。

